Токсикология аргентум. Изолирование. Метод изолирования Минерализация
 Скачать 54.62 Kb. Скачать 54.62 Kb.
|
|
Изолирование. Метод изолирования – Минерализация – это окисление (сжигание) органического вещества (объекта) для освобождения металлов из комплексов с белками и др. соединениями. Стадия деструкции Происходит разрушение биологических субстратов организма (белков, жиров, углеводов) на составные части: белки разрушаются до аминокислот, углеводы (полисахариды) до ди- и моносахаридов, жиры до глицерина и жирных кислот. Менее всего подвержены разрушению на первой стадии жиры. Температура - не превышает 110 оС. Длится 15 - 40 минут. По окончании деструкции получается прозрачная желтовато-бурая жидкость, иногда с пленкой жира, т.к. на этой стадии все элементы объекта разрушены, кроме жиров. Конц. H2SO4 - дегидратирует молекулы органических веществ, повышает температуру кипения реакционной смеси, тем самым повышая окислительное действие конц. HNО3 Конц. HNО3 - окисляет молекулы органических веществ. 2 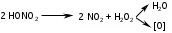 .2. Стадия глубокого жидкофазного окисления Происходят процессы окисления белков до диоксида углерода, простейших аминов и воды; жиров и сахаров до диоксида углерода и воды. Необходимо добавлять в колбу свежие порции окислителя (кислота азотная разведенная) Температура превышает 110 оС Длится 3-4 часа Окислитель на 2 стадии - конц. H2SO4. 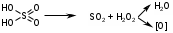 Минерализация считается законченной когда: начинает выделяться белый туман (пары SO2) жидкость остается бесцветной минерализат не темнеет в течение 30 минут без добавления азотной кислоты Денитрация. Процесс удаления из минерализата окислителей (HNО3, HNО2, оксиды азота, нитрозилсерная кислота). Для их удаления проводят денитрацию формальдегидом, процесс денитрации длится 1-2 мин. 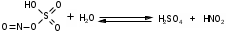  4 HNO2 + 2 H2CO 2 NO + N2 + 2 CO2 + 4 H2O 4 HNO2 + 2 H2CO 2 NO + N2 + 2 CO2 + 4 H2O 4 HNO3 + 3 H2CO 4 NO + 3 CO2 + 5 H2O 4 HNO3 + 3 H2CO 4 NO + 3 CO2 + 5 H2O 4 HNO3 + 5 H2CO 2 N2 + 5 CO2 + 7 H2O 4 HNO3 + 5 H2CO 2 N2 + 5 CO2 + 7 H2O 2 NO + O2 + H2O HNO2 + HNO3 2 NO + O2 + H2O HNO2 + HNO3Для проверки полноты денитрации минерализата проводят реакцию с дифениламином в среде концентрированной серной кислоты.  По реакции с дифениламином в среде концентрированной серной кислоты синего окрашивания не должно быть, что свидетельствует об отсутствии окислителей в минерализате. При появлении синего окрашивания по данной реакции денитрацию формальдегидом повторяют. Затем минерализат количественно переносят в мерную колбу на 200 мл и доводят водой очищенной до метки, используя для обнаружения катионов (100 мл) и количественного определения (100 мл). При разбавлении минерализата водой может выпадать осадок (в случае если в образце присутствуют ион свинеца или бария). Отделение осадка (в случае если исследование проводят на свинец или барий) - осадок отфильтровывают, и обрабатывают горячим раствором ацетата аммония, полученный фильтрат с ацетатом свинца используют для проведения анализа на катион свинца. PbSO4 + 2 CH3COONH4  (CH3COO)2Pb + (NH4)2SO4 (CH3COO)2Pb + (NH4)2SO4 Качественный анализ серебра. 1. Основной реакцией при обнаружении серебра является реакция образования серебра дитизоната. Для отличия серебра дитизоната от ртути дитизоната окрашенный хлороформный слой обрабатывают при энергичном встряхивании 1 мл 0,5моль/л раствором кислоты хлороводородной. Серебра дитизонат в этих условиях разрушается и золотисто – жёлтая окраска хлороформного слоя переходит в зелёную. 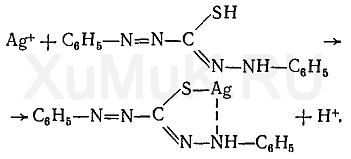 При положительном результате реакции с дитизоном серебро из минерализата выделяют в виде серебра хлорида. 2. Реакция образования серебра хлорида Ag2SO4 + 2NaCl = 2AgCl ¯ + Na2SO4 При наличии иона сереба образуется белый осадок или муть. Жидкость нагревают до кипения и осадок отделяют фильтрованием после охлаждения, промывают его один раз водой очищенной и растворяют в 0,5 – 2,5 мл 25 % раствора аммиака. AgCl + 2(NH4)OH = [Ag(NH3)2]Cl + 2H2O Аммиачный раствор исследуют следующим образом: а) Каплю раствора помещают на предметное стекло, дают капле медленно (без нагревания) испариться. При наличии серебра выделяются мелкие прозрачные кристаллы в виде кубов, октаэдров, четырёхугольников. (Смотреть под микроскопом при большом увеличении). б) К капле исследуемого раствора на предметном стекле прибавляют каплю кислоты азотной разведённой – выпадает белый творожистый осадок серебра хлорида. [Ag(NH3)2]Cl + 2HNO3 = AgCl ¯ + 2NH4NO3 в) 1 – 2 капли исследуемого раствора упаривают на предмет-ном стекле. На остаток наносят по 1 капле насыщенных растворов тиомочевины и калия пикрата. Образуются жёлтые призматические кристаллы в виде розеток пикрата тиомочевинного комплекса серебра: [AgSC(NH2)2] [C6H2(NO2)3OH]. Количественное определение. 1) Атомно-абсорбционная спектрометрия - определение ведут по величине светопоглощения при длине волны 328,1 нм. Расчет концентрации ведут по градуировочному графику или с использованием метода добавок. 2) Метод тиоцианометрии (роданометрия). Основан на свойстве серебра нитрата количественно осаждаться аммония тиоцианатом. Вариант прямого титрования. Индикатор – железоаммонийные квасцы. Среда – азотнокислая (для предотвращения гидролиза индикатора). AgNO3 + NH4SCN AgSCN + NH4NO3 Избыточная капля титранта – аммония тиоцианата взаимодействует с индикатором – железоаммонийными квасцами, окрашивая смесь по окончании титрования в желто-розовый цвет: Fe(NH4)(SO4)2 + 3NH4SCN Fe(SCN)3 + 2(NH4)2SO4 Желто-розовое окрашивание 3) Экстракционно-фотометрический метод - основан на образовании окрашенного комплекса дитизоната серебра и измерении его оптической плотности в видимой области спектра. Фотоколориметрический метод анализа основан на измерении поглощения света немонохроматического излучения окрашенными соединениями в видимой области спектра. Расчет ведут по клабировочному графику. |
