|
|
дом зал по химии. Классы неорганических соединений
Раздел 13. Гальванический элемент
13.1 Для металлов, указанных в таблице, составьте схему работы гальванического элемента, напишите электронные уравнения реакций для анодного и катодного процессов, а также уравнения токообразующей реакции в кратком ионно-молекулярном и молекулярном виде.
13.2 Рассчитайте значения электродных потенциалов металлов для указанных в таблице концентраций по формуле Нернста, определите ЭДС гальванического элемента в данных условиях.
Таблица 13
Вариант
|
Концентрация ионов металлов
|
|
Вариант
|
Концентрация ионов металлов
|
1
|
2
|
|
1
|
2
|
1
|
Mg / Fe [10-2 / 10-4]
|
|
19
|
Mg / Ni [10-2 / 10-4]
|
2
|
Mg / Ag [10-2 / 10-3]
|
|
20
|
Al / Ag [10-2 / 10-3]
|
3
|
Al / Cd [102 / 10-4]
|
|
21
|
Al / Cr [102 / 10-4]
|
4
|
Al / Cu [10-2 / 10-3]
|
|
22
|
Ti / Fe [10-2 / 10-3]
|
5
|
Ti / Co [102 / 10-3]
|
|
23
|
Mn / Cu [10-2 / 10-4]
|
6
|
Mn / Ni [10-1 / 10-2]
|
|
24
|
Mn / Zn [10-2 / 10-4]
|
7
|
Mn / Bi [102 / 10-1]
|
|
25
|
Cr / Cu [10-2 / 10-4]
|
8
|
Cr / Ag [102 / 10-2]
|
|
26
|
Cr / Pb [10-2 / 10-4]
|
9
|
Cr / Sn [10-2 / 10-4]
|
|
27
|
Zn / Fe [10-2 / 10-4]
|
10
|
Zn / Pb [102 / 10-4]
|
|
28
|
Zn / Bi [10-2 / 10-4]
|
11
|
Zn / Cu [10-2 / 102]
|
|
29
|
Fe / Co [10-4 / 102]
|
12
|
Fe / Cu [10-4 / 102]
|
|
30
|
Fe / Sn [10-4 / 10-2]
|
13
|
Fe / Ni [10-6 / 10-4]
|
|
31
|
Ni / Co [10-2 / 104]
|
14
|
Ni / Sn [10-2 / 10-4]
|
|
32
|
Ni / Ag [10-4 / 104]
|
15
|
Ni / Cu [10-2 / 10-4]
|
|
33
|
Mg / Pb [10-4 / 10-2]
|
16
|
Pb / Cu [10-2 / 10-4]
|
|
34
|
Pb / Bi [10-2 / 102]
|
17
|
Pb / Fe [10-2 / 10-4]
|
|
35
|
Ti / Cu [10-6 / 104]
|
18
|
Mg / Cu [10-2 / 10-4]
|
|
|
|
Раздел 14. Коррозия металлов
14.1 Для указанных в задании сплавов составьте схему электрохимической коррозии и напишите электронные уравнения катодных и анодных процессов в кислой среде. Укажите вторичный процесс и продукт коррозии.
14.2 Первый металл в данном сплаве рассмотрите в виде возможного металлического покрытия для защиты от коррозии второго металла. Определите тип покрытия, составьте схему коррозии и напишите электронные уравнения катодных и анодных процессов в нейтральной среде. Укажите вторичный процесс и продукт коррозии.
Таблица 14
Вариант
|
Сплав металлов
|
|
Вариант
|
Сплав металлов
|
1
|
2
|
|
1
|
2
|
1
|
Mg / Fe
|
|
19
|
Mg / Ni
|
2
|
Mg / Ag
|
|
20
|
Al / Ag
|
3
|
Al / Cd
|
|
21
|
Al / Cr
|
4
|
Al / Cu
|
|
22
|
Ti / Fe
|
5
|
Ti / Co
|
|
23
|
Mn / Cu
|
6
|
Mn / Ni
|
|
24
|
Mn / Zn
|
7
|
Mn / Bi
|
|
25
|
Cr / Cu
|
8
|
Cr / Ag
|
|
26
|
Cr / Pb
|
9
|
Cr / Sn
|
|
27
|
Zn / Fe
|
10
|
Zn / Pb
|
|
28
|
Zn / Bi
|
11
|
Zn / Cu
|
|
29
|
Fe / Co
|
12
|
Fe / Cu
|
|
30
|
Fe / Sn
|
13
|
Fe / Ni
|
|
31
|
Ni / Co
|
14
|
Ni / Sn
|
|
32
|
Ni / Ag
|
15
|
Ni / Cu
|
|
33
|
Mg / Pb
|
16
|
Pb / Cu
|
|
34
|
Pb / Bi
|
17
|
Pb / Fe
|
|
35
|
Ti / Cu
|
18
|
Mg / Cu
|
|
|
|
Раздел 15. Органическая химия
15.1 Для заданного в таблице соединения определите принадлежность к гомологическому ряду, тип гибридизации всех атомов углерода, дайте ему название по систематической номенклатуре. Укажите типы всех связей, отметьте первичные, вторичные, третичные, четвертичные атомы углерода.
15.2 Изобразите формулы всех структурных и пространственных изомеров.
15.3 Напишите реакцию данного вещества с приведенным реагентом. Рассмотрите его в качестве мономера в реакциях полимеризации и поликонденсации.
Таблица 15
Вариант
|
Формула соединения
|
Реагент
|
1
|
2
|
3
|
1
|
CH3-CH2-CH2-Cl
|
NaOH / H+
|
2
|
CH3-CH2-CH2-OH
|
HCl / H+
|
3
|
CH3-CH2-CH2-COOH
|
CH3-OH / H+
|
4
|
CH3-CH2-CH2-NH2
|
HCl
|
5
|
CH3-CH2-CH2-COH
|
K2Cr2O7/H+
|
6
|
CH3-CO-CH2-CH3
|
CH3OH
|
7
|
CH3-CH(CH3)-CH2-OH
|
Na
|
8
|
CH3-CH2-CH(C2H5)-COOH
|
NaOH
|
9
|
CH(CH3)=C(C2H5)-CH3
|
HBr
|
10
|
CH2=C(CH3)-CH3
|
H2O / H+
|
11
|
CH3-CH=CH-CH2-CH3
|
Br2 / н.у.
|
12
|
CH3-CH(CH3)-CH2-CH(CH3)-CH3
|
Br2 / hν
|
13
|
CH3-CH(CH3)-CH2-CH3
|
HNO3 (разб.) / t, p
|
14
|
HC≡C-CH(CH3)-CH2-CH3
|
2Br2 / н.у.
|
15
|
HC≡C-CH2-CH2-CH3
|
[Ag(NH3)2]OH
|
16
|
CH2=CH-CH2-CH2-CH3
|
KMnO4 / Na2CO3
|
17
|
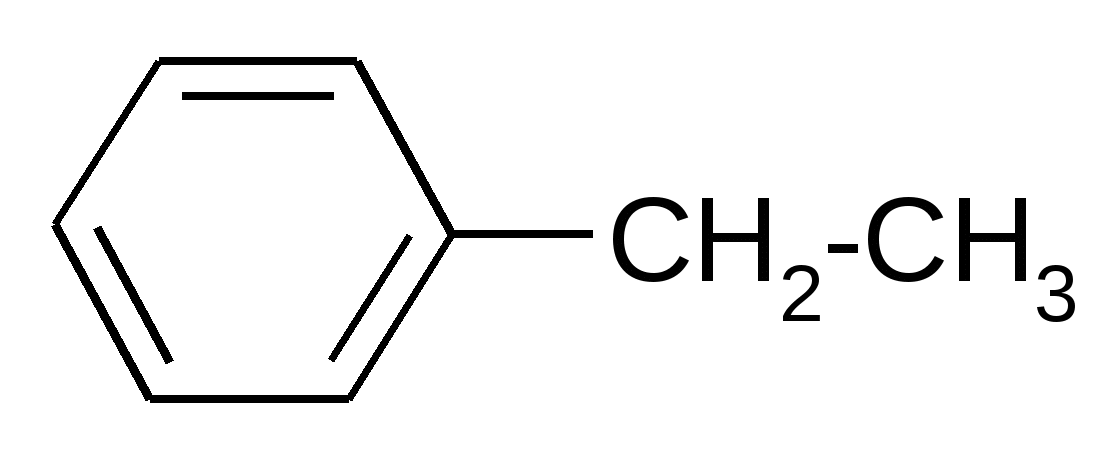
|
Br2 / hν
|
18
|
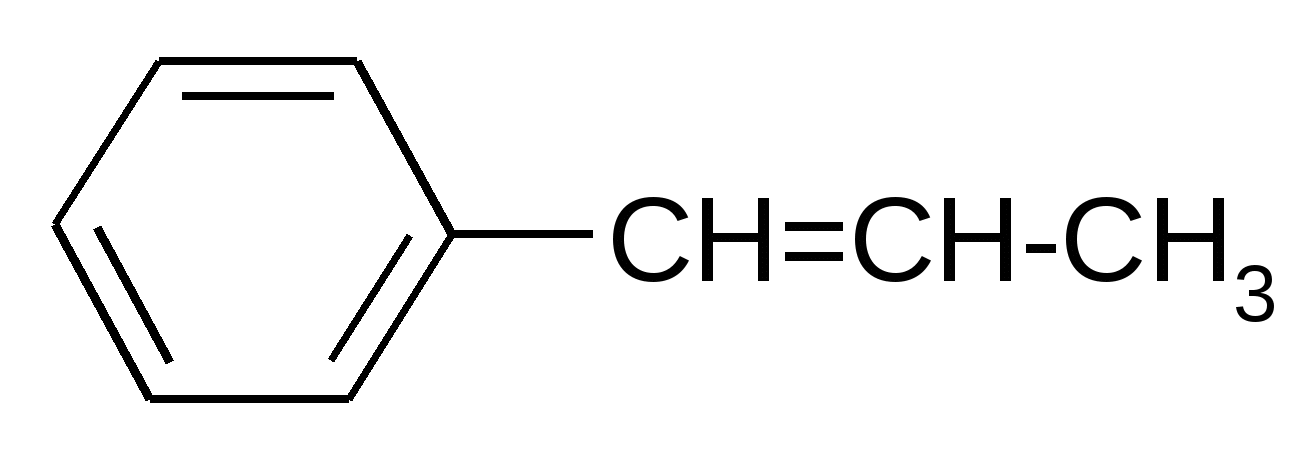
|
Br2 / н.у.
|
19
|
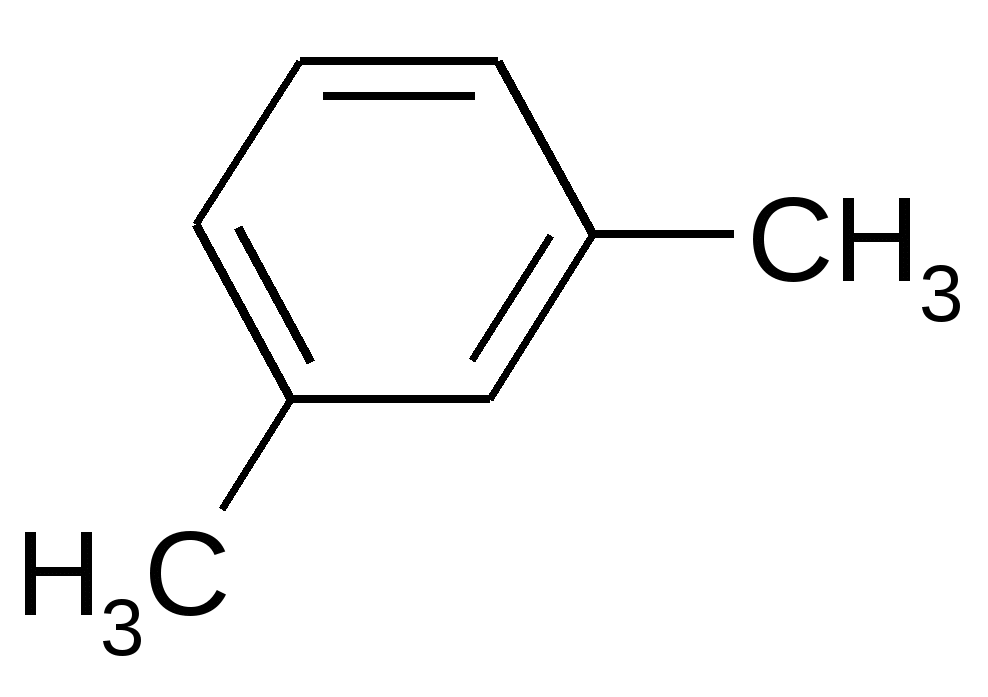
|
KMnO4 / H2SO4
|
20
|
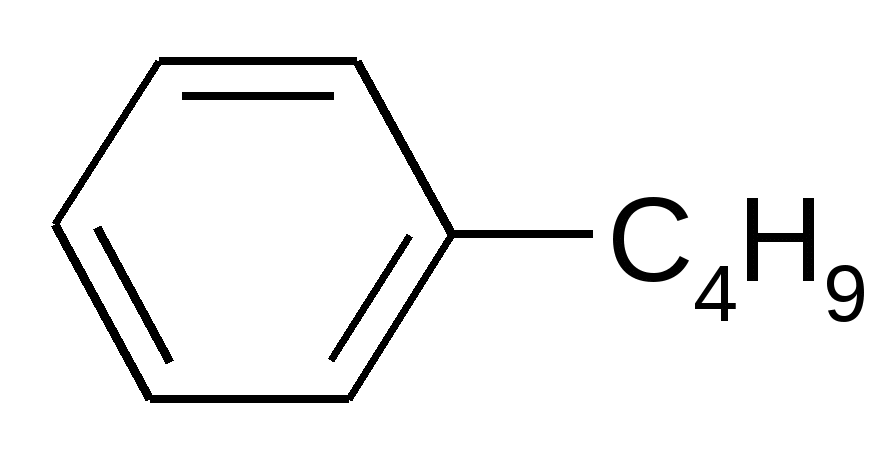
|
Cl2 / AlCl3
|
21
|
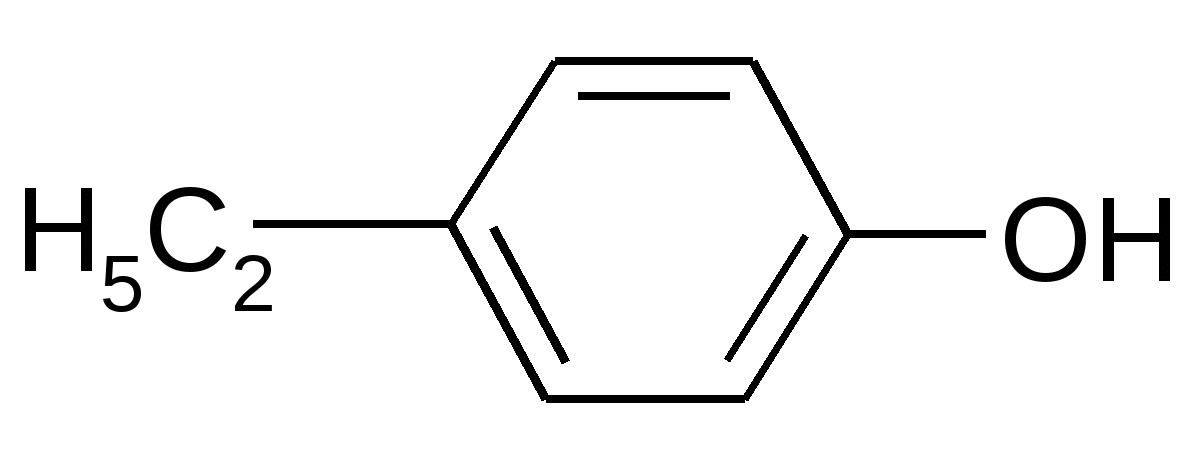
|
NaOH
|
22
|
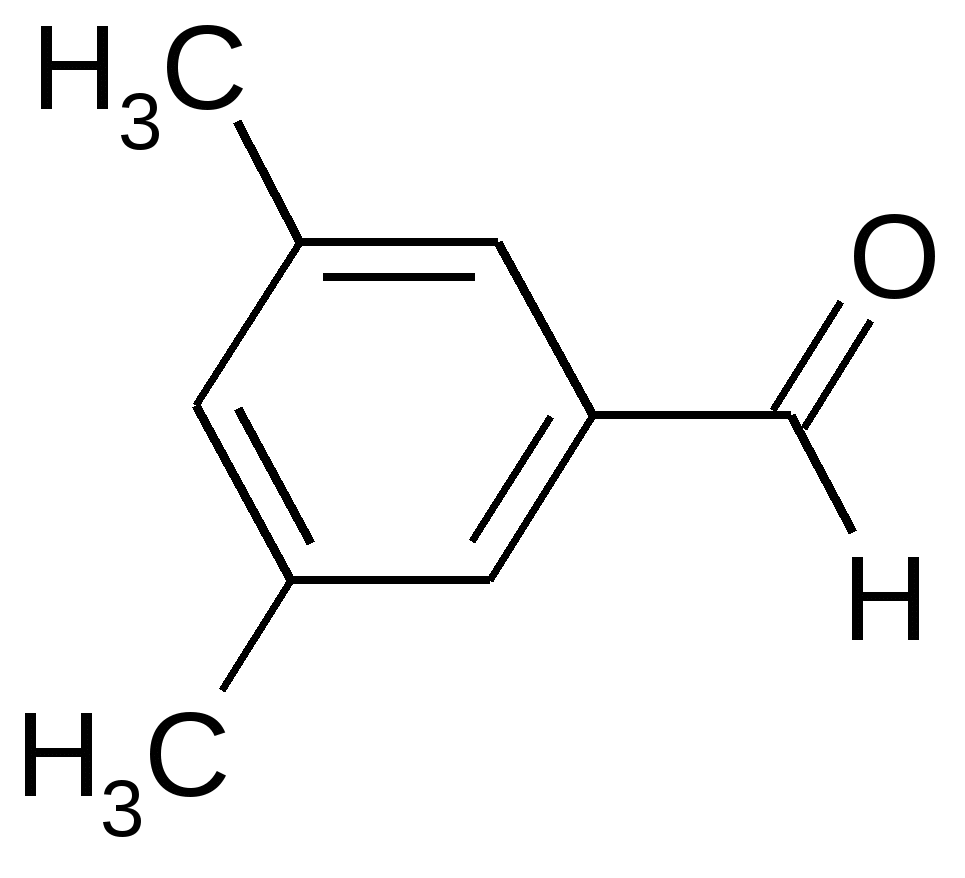
|
O2
|
23
|
HCHO
|
[Ag(NH3)2]OH
|
24
|
CH3-CH2-CH3
|
Cl2 / hν
|
25
|
CH3-CH2-OH
|
СH3COOH/ H+
|
|
|
|
Продолжение таблицы 15
|
1
|
2
|
3
|
26
|

|
СН3I / AlCl3
|
27
|

|
H2SO4/SO2
|
28
|

|
Br2 / н.у.
|
29
|
HC≡C-CH3
|
H2O / H+,Hg2+
|
30
|
HC2=CH-CH=CH2
|
2Br2 / н.у.
|
31
|
HC≡CH
|
[Ag(NH3)2]OH
|
32
|
 (это анилин) (это анилин)
|
Br2 / н.у.
|
33
|
CH3-CH2-CH(C2H5)-COOH
|
C3H7OH/H+
|
34
|

|
[Ag(NH3)2]OH
|
35
|

|
Br2 / FeCl3
|
|
|
|
 Скачать 0.73 Mb.
Скачать 0.73 Mb.

