Биохимия 1 коллоквиум. БХ коллок1. Классификация аминокислот По полярности различают гидрофобные(неполярные) и гидрофильные(полярные) Гидрофобные
 Скачать 1.12 Mb. Скачать 1.12 Mb.
|
|
БХ коллок №1 Аминокислоты – структурные молекулы белка. Их строение, свойства. Классификации аминокислот. Привести примеры. Заменимые и незаменимые аминокислоты. Роль аминокислот в формировании нативного белка и образовании внутримолекулярных связей. 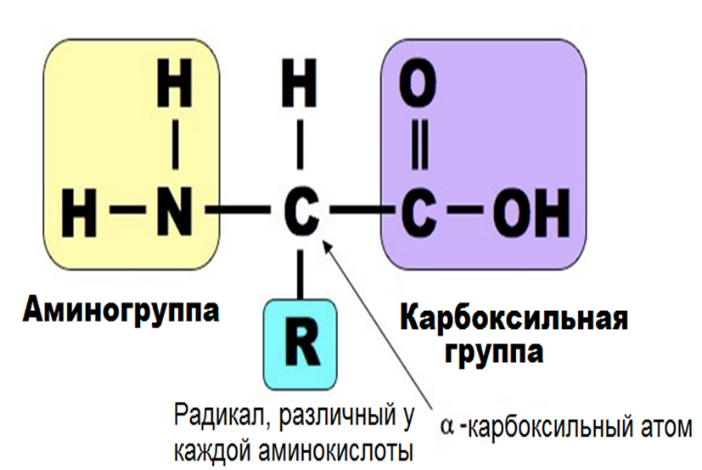 Свойства аминокислот: Свойства аминокислот: Все они являются альфа-аминокислотами Принадлежат к L-ряду Хорошо растворимы в воде Способны диссоциировать Наличие ИЭТ Классификация аминокислот По полярности различают: гидрофобные(неполярные) и гидрофильные(полярные) - Гидрофобные имеют в своем составе радикалы: -CH3; - ароматические; не взаимодействуют с водой: аланин, валин, глицин, лейцин, изолейцин, фенилаланин, триптофан, метионин. - Гидрофильные (полярные) имеют в своем составе такие радикалы, как -OH, -COOH, -NH2, -SH, NH2-C=O. При этом из них диссоциируют только -COOH и -NH2, ну и -SH (при значении pH=8). В связи с этим гидрофильные делятся на заряженные и незаряженные. Заряженные бывают отрицательно (-) заряжены и положительно (+) заряжены. (-) – имеют в своем составе дополнительную карбоксильную группу, она и дает отрицательный заряд: глутаминовая и аспарагиновая кислота. (+) – аргинин, лизин, гистидин Незаряженные – цистеин, серин, треонин, тирозин. По заменимости различают: - заменимые (аланин, аспартат, глутамат, аспарагин, глутамин, пролин, глицин, серин) - условно заменимые (тирозин, цистеин); - частично заменимые (гистидин, аргинин) - незаменимые (лейцин, изолейцин, лизин, триптофан, метионин, фенилаланин, валин и треонин); Роль аминокислот в формирование нативной (правильной) структуры белка: Последовательность и соотношение аминокислот в первичной структуре определяет дальнейшее поведение молекулы: ее способность изгибаться, сворачиваться, формировать те или иные связи внутри себя. Например, замена глутаминовой кислоты на валин в структуре гемоглобина ведет к формированию неправильной формы эритроцитов, что вызывает серповидно-клеточную анемию. Поэтому последовательность аминокислот очень важна. Ступени структурной организации глобулярного белка. Первичная структура - порядок чередования аминокислотных остатков в линейной цепи, соединенных пептидной связью (глутатион, глюкагон). Связи - пептидные Вторичная структура - расположение полипептидной цепи в пространстве, образующаяся в результате взаимодействий между функциональными группами пептидной связи, с образованием спиральной структуры (α-спираль) или плоского слоя (β-складчатость), а также аморфных участков. Связи – пептидные, водородные Третичная структура - объемная организация вторичных структур в единую трехмерную конструкцию с определенной конформацией, образующаяся за счёт взаимодействий между радикалами аминокислот. Связи – водородные, гидрофобные, дисульфидные мостики, ионные. Четвертичная структура - количество и взаиморасположение полипептидных цепей олигомерного белка в пространстве. Первичная структура белка. Написать тетрапептид, выделить пептидные связи. Зависимость конформации и свойств белков от первичной структуры. Биологическая роль пептидов. Первичная структура белка – линейная последовательность аминокислотных остатков в полипептидной цепи, связанная между собой пептидными (ковалентными) связями. Тетрапептид:  Зависимость конформации и свойств белков от первичной структуры: формирование дальнейших структур будет зависеть от радикалов этих аминокислот, которые будут взаимодействовать между собой, изгибая полипептидную цепь, образуя трёхмерную нативную структуру. Вся информация о формировании пространственной структуре белка находится в полипептидной цепи. Биологическая роль пептидов: выполняют функцию биорегуляторов различных биологических и физиологических процессов регулируют тонус сосудов (вазопрессин, ангиотензин) моторику и секрецию ЖКТ (гастрин, холецистокинин) стимулируют секрецию гормонов гипофиза (АКТГ, соматотропный гормон) регулируют иммунитет (гормоны тимуса) Вторичная структура белка. Связи, ее стабилизирующие. Написать два трипептида и соединить их водородными связями. Супервторичная структура. Вторичная структура – пространственная структура, образующаяся в результате взаимодействий между функциональными группами, входящими в состав пептидного остова. При этом пептидные цепи могут приобретать регулярные структуры двух типов: альфа-спираль и бэтта-складчатость. Связи, стабилизирующие вторичную структуру, - водородные, образуются между карбоксильным кислородом одной цепи и амидным азотом другой цепи. Альфа-спираль. Пептидный остов закручивается в виде спирали за счет образования водородных связей между атомами кислорода карбонильных групп и атомами азота аминогрупп. Водородные связи ориентированы вдоль спирали. На один виток приходится 3,6 аминокислотных остатка. Радикалы снаружи, т.к. гидрофобны. Бэтта-складчатость. Формируется за счет образования множества водородных связей между атомами пептидных групп линейных областей одной полипептидной цепи, делающей изгибы или между разными. «Лист, сложенный гармошкой». Водородные связи, образующиеся внутри одной полипептидной – внутрицепочечные, между разными – межцепочечные. Существует также так называемая «надвторичная структура» - локальная конформация, образующаяся в результате объединения нескольких участков одной полипептидной цепи, которые имеют вторичную структуру. К ней относится: супервторичная структура «альфа-спираль – поворот – альфа-спираль», формируется за счет межрадикальных взаимодействий. Еще пример «цинковый палец» - фрагмент ДНК-связывающего белка в форме «цинкового пальца». Третичная структура молекулы как высшая ступень организации мономерных белков. Связи, ее стабилизирующие. Домены и кластеры. Понятие о фолдинге белков. Участие фолдаз и шаперонов. У мономерного белка конформация складывается из его вторичной и третичной структуры. Третичная структура белка – это трехмерная пространственная структура, образующаяся за счет взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи. Связи, участвующие в формировании: гидрофобные взаимодействия – гидрофобные радикалы внутри глобулярной структуры, между ними возникают силы ван дер Ваальса (формируется гидрофобное ядро). Ионные связи и водородные связи – гидрофильные радикалы располагаются на поверхности белковой молекулы, все гидрофильные радикалы, оказавшиеся внутри гидрофобного ядра, взаимодействуют с друг другом с помощью ионных и водородных связей. Третичную структуру некоторых белков стабилизируют дисульфидные связи (взаимодействие -SH – групп двух остатков цистеина). Третичная структура – глобула, образуется одной полипептидной цепью, а четвертичная структура – это комплекс глобул, а несколько глобул, значит, и несколько полипептидных цепей, то есть только олигомерный белок. Домен - участок полипептидной цепи, который в процессе формирования пространственной структуры приобрёл независимо от других участков той же цепи конформацию глобулы. Характерны для белков, состоящих из более чем 200 аминокислот (полидоменные белки). Кластеры – это определенные зоны на поверхности молекулы белка, содержащие однотипные группировки и служащие для присоединения различных веществ к молекуле белка. Фолдинг – это процесс формирования нативной структуры белка. Осуществление фолдинга происходит с помощью фолдаз (ферменты, катализирующие сборку полипептидной цепи путем образования ковалентных промежуточных комлпексов) и шаперонов (вспомогательные специализированные белки, обеспечивающие фолдинг, рефолдинг и предотвращение реагрегации неправильно свернутых или частично развернутых белков). Четвертичная структура белковой молекулы как высшая ступень организации олигомерных белков. Связи, ее стабилизирующие. Привести примеры белков, обладающих четвертичной структурой. Четвертичная структура – это количество и взаиморасположение полипептидных цепей в пространстве. Протомеры – отдельные полипептидные цепи в белке (субъединицы). Олигмерный белок – белок, состоящий из четного количества протомеров. Связи, стабилизирующие, такие же, как и в третичной. У олигомерного белка конформация складывается из его вторичной, третичной, четвертичной структур. Примеры: гемоглобин, лактатдегидроденаза, цитохромоксидаза, глутаминсинтетаза. Принципы классификации белков. Привести примеры. Биологические функции белков. Понятие о протеомике. В основе имеющихся классификаций обычно лежит один признак. Так, белки можно классифицировать по: Форме молекул (глобулярные – миоглобин; и фибриллярные – коллаген, кератин.) Молекулярной массе (низкомолекулярные, высокомолекулярные и т.д.) Химическому строению (наличие или отсутствие небелковой части) Выполняемым функциям (транспортные, защитные, структурные белки и др.) Локализации в клетке (ядерные, цитоплазматические, лизосомальные и др.) Биологические функции белков: Ферментативная Транспортная Энергетическая Регуляторная Защитная Рецепторная Структурная Сократительная Протеомика – наука, изучающая белковый набор организма, а также структуру белков (в т.ч. и пространственную) и их функции. Белок-лигандные и белок-белковые взаимодействия. Избирательность взаимодействия. Типы лигандов и особенности их взаимодействия с белками, примеры, роль в образовании межмолекулярных комплексов. Лиганд - молекула, которая связывается с белком в процессе выполнения его функций. Взаимодействие белка с лигандом высокоспецифично, осуществляется на основе комплементарности лиганда и активного центра белка. Белок – белковое взаимодействие – обозначает ситуацию, когда в качестве регулятора выступают не метаболиты биохимических процессов, а специфичные белки. В целом ситуация схожа с аллостерическим механизмом: после влияния каких-либо факторов на специфичные белки изменяется активность этих белков, и они, в свою очередь, воздействуют на нужный фермент. Белок – лигандное – на белковых молекулах есть участки, к которым присоединяются лиганды – активный центр. Активный центр формируется из аминокислотных остатков, сближенных в результате формирования вторичной и третичной структур. Связи между белком и лагандом могут быть нековалентными и ковалентными. Высокая специфичность взаимодействия («узнавания») белка и лиганда обеспечивается комплементарностью структуры активного центра и лиганда. Под комплементарностью понимают химическое и пространственное соответствие активного белка и лиганда. Виды лигандов: 1) Лиганд белка-фермента - субстрат. 2) Лиганд траспортного белка - транспортируемое вещество (гемоглобин-кислород). 3) Лиганд антитела (иммуноглобулина) - антиген. 4) Лиганд рецептора гормона или нейромедиатора - гормон или нейромедиатор. Образование внутренней сферы комплексов происходит по донорно-акцепторному механизму. Комплексообразователь – акцептор, предоставляющий свободные орбитали. Лиганды – доноры, предоставляющие свободные пары электронов. Физико-химические свойства белков. Изоэлектрическая точка. Влияние рН среды на заряд белков. 1. Форма молекул 2. Молекулярная масса 3. Суммарный заряд Изоэлектрическая точка (pI) - значение рН раствора, при котором суммарный заряд белковой молекулы равен 0. Белки, находящиеся в изоэлектрическом состоянии, малоактивны, неустойчивы и могут выпадать в осадок, поскольку резко уменьшается их гидратная оболочка. 4. Растворимость белков Растворимость белков определяется соотношением полярных и неполярных группировок на его поверхности, суммарного заряда. 5. Способность к денатурации Денатурация - нарушение пространственной структуры (конформации) белка в результате разрушения слабых нековалентных связей, ее стабилизирующих, под действием различных физических или химических факторов. Первичная структура при денатурации белка не разрушается. Влияние pН: при рН = 7, все ионогенные группы белка находятся в ионизированном состоянии. В кислой среде увеличение концентрации протонов приводит к подавлению диссоциации карбоксильных групп и уменьшению отрицательного заряда белков. В щелочной среде связывание избытка ОН с протонами, образующимися при диссоциации NH3+ с образование воды, приводит к уменьшению положительного заряда белков. Факторы устойчивости белковой молекулы в растворе. Денатурация белка: обратимая и необратимая. Использование в науке и медицине. Факторы устойчивости: Гидратная оболочка – это слой молекул воды, определенным образом ориентированный на поверхности белков молекулы (не дает белкам соединяться и выпасть в осадок) Заряд белковой молекулы (определяется аминокислотным составом и pH среды) Молекулярная масса Форма молекулы Денатурация белка – это процесс разрушения слабых нековалентных связей в составе белка под действием различных химических и физических факторов, что ведет к нарушению пространственной структуры и нарушению функций, первичная структура белка не разрушается. Обратимая денатурация – когда структура белка и его функции могут полностью восстановиться при уборке денатурирующего агента. Может быть вызвана слабым нагреванием, высаливанием (действием солей щелочных, щелочно-земельных металлов и аммония), мочевиной, кратковременным действием этилового спирта и т.д. Необратимая денатурация – возвращение к прежнему состоянию белка невозможно, вызвана действием сильных минеральных и органических кислот, тяжелых металлов, кипячением, жестким излучением. Использование в науке и медицине: в медицине денатурирующие агенты часто применяют для стерилизации медицинского инструмента и материалов в автоклавах (высокая температура) и в качестве антисептиков (спирт, фенол, хлорамин) для обработки загрязненных поверхностей, содержащих патогенную микрофлору. Биологический катализ. Термодинамические аспекты действия ферментов (энергетический барьер, энергия активации). Зависимость каталитических свойств ферментов от температуры и реакции среды. Температура и рН среды как факторы неспецифической регуляции активности ферментов. Биологический катализ – это ускорение с помощью ферментов химических реакций, протекающих в живых организмах. Термодинамические аспекты действия ферментов: Для понимания энергетики химической реакции необходимо учитывать изменение энергии субстратов и продуктов реакции, а также роль ферментов в этом процессе. Известно, для того чтобы прошла реакция, субстраты должны получить такое количество дополнительной энергии (называемой энергией активации Еа), которое необходимо для вступления молекул субстрата в реакцию. В случае ферментативной реакции происходит снижение энергии активации, что обеспечивает более эффективное протекание реакции. Фермент понижает энергию активации Еа, т.е. снижает высоту энергетического барьера; в результате возрастает доля реакционноспособных молекул и повышается скорость реакции. Зависимость каталитических свойств от температуры и реакции среды. От температуры. Наибольшую активность тот или иной фермент проявляет при оптимальной температуре. Для Ф живого организма это значение находится в пределах +37,0 - +39,0 С, в зависимости от вида животного. При понижении температуры, замедляется броуновское движение, уменьшается скорость диффузии и, следовательно, замедляется процесс образования комплекса между ферментом и компонентами реакции (субстратами). В случае повышения температуры выше +40 - +50 С молекула фермента, которая является белком, подвергается процессу денатурации. При этом скорость химической реакции заметно падает От pH cреды. Для большинства из них существует определенное оптимальное значение рН, при котором их активность максимальна. Поскольку в клетке содержатся сотни ферментов и для каждого из них существуют свои пределы опт рН. Так, в результате одной хим.реакции при участии определенного фермента рН оптимум которого лежит в пределах 7.0 – 7.2 образуется продукт, который является кислотой. При этом значение рН смещается в область 5,5 – 6.0. Активность фермента резко снижается, скорость образования продукта замедляется, но при этом активизируется другой фермент, для которого эти значения рН оптимальны и продукт первой реакции подвергается дальнейшему химическому превращению. Основные отличия свойств ферментов от неорганических катализаторов. Специфичность действия ферментов. Виды специфичности, ее значение для организма. Принципы количественного определения ферментов. Единицы измерения ферментативной активности. Ферменты — это белковые катализаторы, ускоряющие химические реакции в живых клетках. Они обладают всеми свойствами, характерными для белков, и определенными особенностями строения, обусловливающими их каталитические свойства. Ферменты, кроме того, подчиняются общим законам катализа и обладают свойствами, характерными для небиологических катализаторов: ускоряют энергетически возможные реакции, сохраняют энергию химической системы постоянной, не расходуются в процессе реакции. Специфичность - наиболее важное свойство ферментов, определяющее биологическую значимость ферментов. Различают субстратную и каталитическую специфичности фермента, которые определяются строением активного центра.
Под субстратной специфичностью понимается способность каждого фермента взаимодействовать лишь с одним или несколькими определенными субстратами. Различают: - абсолютную субстратную специфичность, если активный центр фермента комплементарен только одному субстрату; - групповую субстратную специфичность, если фермент катализирует однотипную реакцию с небольшим количеством (группой) структурно похожих субстратов; - стереоспецифичность, если фермент проявляет абсолютную специфичность только к одному из существующих стереоизомеров субстрата. Каталитическая специфичность, или специфичность пути превращения субстрата, обеспечивает преобразование одного и того же субстрата под действием разных ферментов. Это обеспечивается строением каталитических участков активных центров соответствующих ферментов. Например, молекула люкозо-6-фосфата в клетках печени человека является субстратом четырех различных ферментов: фосфоглюкомутазы, глюкозо-6-фосфатфосфатазы, фосфоглюкоизомеразы и глюкозо-6-фосфатдегидрогеназы. Однако за счет особенностей строения каталитических участков этих ферментов происходят различные превращения глюкозо-6-фосфата с образованием четырех различных продуктов. Специфичность пути превращения субстрата обеспечивает возможность преобразования одного и того же субстрата под действием разных ферментов. Молекула глюкозо-6-фосфата является субстратом разных ферментов, что приводит к образованию разных продуктов Активность фермента выражается в скорости накопления продукта или скорости убыли субстрата в пересчете на количество материала, содержащего фермент.
В практике обычно используют: единицы количества вещества – моль (и его производные ммоль, мкмоль), грамм (кг, мг), единицы времени – минута, час, секунда, единицы массы или объема – грамм (кг, мг), литр (мл). Активно используются и другие производные – катал (моль/с), международная единица активности (МЕ, Unit) соответствует мкмоль/мин. Таким образом, активность фермента может выражаться, например, в ммоль/с×л, г/час×л, МЕ/л, кат/мл и т.д. Активный центр фермента, его строение. Образование энзим-субстратного комплекса. Взаимодействие фермента и субстрата по принципу жесткого и индуцированного состояния активного центра (теория Фишера и теория Кошланда). Активный центр ферментов - это определенный участок белковой молекулы, способный комплементарно связываться с субстратом и обеспечивающий его каталитическое превращение. Структура активного центра сформирована радикалами аминокислот, также как и в случае активного центра любого белка. В активном центре фермента имеются аминокислотные остатки, функциональные группы которых обеспечивают комплементарное связывание субстрата (участок связывания), и аминокислотные остатки, функциональные группы которых осуществляют химическое превращение субстрата (каталитический участок) Образование энзим-субстратного комплекса:  1. В ходе катализа субстрат, связанный с активным центром фермента в фермент-субстратный (ES) комплекс, претерпевает химическое превращение в продукт, который затем высвобождается. 1. В ходе катализа субстрат, связанный с активным центром фермента в фермент-субстратный (ES) комплекс, претерпевает химическое превращение в продукт, который затем высвобождается. На этапе I происходит сближение и ориентация субстрата в области активного центра фермента. На этапе II в результате индуцированного соответствия [изменение конформации субстрата (S) и активного центра фермен- та] образуется фермент-субстратный комплекс (ES). На этапе III происходит дестабилизация связей в субстрате и образование нестабильного комплекса фермент-продукт (ЕР). На этапе IV происходит распад комплекса (ЕР) с высвобождением продуктов реакции из активного центра и освобождением фермента. Теория Фишера (модель "жесткой матрицы", "ключ-замок") – активный центр фермента строго соответствует конфигурации субстрата и не изменяется при его присоединении. Эта модель хорошо объясняет абсолютную специфичность, но не групповую. Дениел Кошланд предложил модификацию модели «ключ-замок». Ферменты, в основном, — не жесткие, а гибкие молекулы. Активный центр фермента может изменить конформацию после связывания субстрата. Боковые группы аминокислот активного центра принимают такое положение, которое позволяет ферменту выполнить свою каталитическую функцию. В некоторых случаях молекула субстрата также меняет конформацию после связывания в активном центре. В отличие от модели «ключ-замок», модель индуцированного соответствия объясняет не только специфичность ферментов, но и стабилизацию переходного состояния. Эта модель получила название «рука-перчатка». 14. Ферменты, их молекулярная организация. Апофермент и кофактор (кофермент и простетическая группа). Номенклатура и классификация ферментов. Витамины и ионы металлов как кофакторы ферментов. 15. Основы ферментативной кинетики. Зависимость скорости ферментативной реакции от концентрации субстрата и фермента. Уравнение Михаэлиса-Ментен. Константа Михаэлиса, ее физический смысл. Субстратное ингибирование. 16. Ингибирование ферментов: конкурентное, неконкурентное. Особенности ферментативной кинетики. Привести примеры. 17. Виды торможения активности ферментов: обратимое, необратимое, специфическое, неспецифическое. Действие химических компонентов табачного дыма на активность ферментов полости рта (амилаза, лактатдегидрогеназа, аспартатаминотрансфераза). 18. Регуляция активности ферментов путем химической и структурной модификации. 19. Аллостерическая регуляция олигомерных ферментов. Кинетика их действия. Явление кооперативности. 20. Множественные молекулярные формы ферментов. Изоферменты. Характеристика и их регуляторная роль на примере лактатдегидрогеназы. Клиническое значение их определения. Понятие о мультиферментных комплексах и полифункциональных ферментах. |
