клетки купфера и учение о ретикулоэндотелиальной системе
 Скачать 1.09 Mb. Скачать 1.09 Mb.
|
|
Федеральное государственное бюджетное образовательное учреждение высшего образования «Тюменский государственный медицинский университет» Министерства здравоохранения Российской Федерации (ФГБОУ ВО Тюменский ГМУ Минздрава России) Кафедра гистологии с эмбриологией имени ЗДН РФ проф. Дунаева П. В. РЕФЕРАТ На тему: «КЛЕТКИ КУПФЕРА И УЧЕНИЕ О РЕТИКУЛОЭНДОТЕЛИАЛЬНОЙ СИСТЕМЕ» Выполнила: студентка 129 группы 1-го курса, лечебного факультета Шакирова Шолпан Куандыковна Проверил: кандидат биологических наук, доцент кафедры гистологии, цитологии и эмбриологии Матвиенко Виктор Васильевич Тюмень, 2022 ОГЛАВЛЕНИЕ Введение………………………………………………………………………3 Глава 1. Клетки Купфера……………….……………………………………4 Строение……………………...……………………………………...…4 Развитие………………….…………………………………………..…6 Функции………..…………………………………………….…...........7 Клиническое значение……………………………………………….10 История изучения…………………………………………………….13 Глава 2. Ретикулоэндотелиальная система………….........................…....14 2.1 Учение о ретикулоэндотелиальной системе…………………………14 Заключение………………………………………………………………….18 Список литературы…………………………………………………………19 Приложение……………………………………………...………………….20 Введение Наш организм постоянно подвергается воздействию бактерий, вирусов, грибков и паразитов. Многие из этих инфекционных агентов способны вызывать серьезные нарушения физиологических функций или даже смерть, если они вторгаются в глубокие ткани. Макрофаги представляют собой тип белых кровяных клеток в иммунной системе, которая поглощает и переваривает продукты распада клеток, чужеродных веществ, микробов, раковых клеток, и все остальное, что не имеет белков, характерные для здоровой клетки тела на его поверхности этот процесс называется фагоцитоз. Макрофаги в основном обсуждаются как мобильные клетки, способные блуждать в тканях. Однако большая часть моноцитов после попадания их в ткани и превращения в макрофаги прикрепляется к тканям и остается прикрепленной до тех пор, пока они не понадобятся для выполнения специфических местных защитных функций. При соответствующей стимуляции фиксированные макрофаги могут отрываться от мест их прикрепления и вновь становиться мобильными макрофагами. Таким образом, организм имеет широко распространенную моноцитарно-макрофагальную систему фактически во всех тканевых областях. Еще одним наиболее распространенным путем проникновения бактерий в организм является желудочно-кишечный тракт. Большое число бактерий из проглоченной пищи постоянно проходит через слизистую желудочно-кишечного тракта в кровь воротной вены. Прежде чем эта кровь попадет в общую систему кровообращения, она проходит через синусоиды печени, выстланные тканевыми макрофагами, или клетками Купфера (Приложение 1). Эти клетки формируют такую эффективную систему фильтрации частиц, что практически ни одной бактерии из желудочно-кишечного тракта не удается пройти с кровью воротной вены в системный кровоток. Глава 1. Клетки Купфера 1.1 Строение Клетки Купфера (синонимы: клетки Бровича — Купфера, клетки береговые, клетки синусоидные, клетки эндотелиальные звездчатые) — специализированные клетки, располагающиеся в люмене (внутреннем пространстве) синусоид печени (Приложение 2) и прикрепленные к синусоидальным эндотелиальным клеткам, образующим стенки кровеносных сосудов. Клетки Купфера — наиболее многочисленные резидентные макрофаги в печени человека, они входят в состав системы мононуклеарных макрофагов (ретикуло-эндотелиальной системы). Через воротную вену в печень из пищеварительного тракта поступают кишечные бактерии, бактериальные эндотоксины, которые в печени первым делом сталкиваются с клетками Купфера, образующими первую линию иммунной защиты печени. Нарушения функционирования клеток Купфера сопровождают многие заболевания печени, такие как алкогольная болезнь печени, вирусные гепатиты, внутрипечёночный холестаз, стеатогепатит, цирроз печени, а также при отторжении трансплантата печеночной ткани. Клетки Купфера имеют амёбоидную форму и прикреплены к синусоидальным эндотелиальным клеткам. На поверхности клеток Купфера имеются микроворсинки, псевдоподии и ламеллоподии, расположенные во всех направлениях. Микроворсинки и псевдоподии задействованы в поглощении частиц. В цитоплазме клеток Купфера располагаются рибосомы, аппарат Гольджи, эндоплазматический ретикулум (в особенности, шероховатый), центриоли, микротрубочки и микрофиламенты. Ядро яйцевидное, может быть подразделено на доли. В органеллах клеток Купфера присутствует пероксидазная активность. Клетки Купфера локализованы и в центрилобулярной, и в перипортальной части долек печени, однако их функции в этих регионах различны. Перипортальные клетки Купфера более крупные, содержат больше лизосом и более активны в плане фагоцитоза, а центрилобулярные клетки Купферы специализированы на генерации супероксид-радикала. Внутри клеток Купфера имеются скэвенджер-рецепторы SR-AI/II. Они участвуют в распознавании и связывании липида A в составе молекул липополисахарида и липотейхоевых кислот. Липополисахарид является эндотоксином, входящим в состав клеточных стенок грамотрицательных бактерий, а липотейхоевые кислоты присутствуют в клеточных стенках грамположительных бактерий. 1.2 Развитие клеток Купфера Развитие клеток Купфера начинается в желточном мешке, где они дифференцируются в зародышевые макрофаги. После выхода в кровоток они мигрируют в печень плода, где и оседают и завершают дифференцировку в клетки Купфера. В печени имеется две группы макрофагов: клетки Купфера, происходящие от кроветворных клеток-предшественниц, развивающихся в желточном мешке, и макрофаги, происходящие от моноцитов, которые образуются в красном костном мозге от гемопоэтических стволовых клеток и по кровотоку попадают в печень. Макрофаги второй группы дифференцируются в макрофаги под влиянием микросреды, а клетки Купфера являются полностью самостоятельной дифференцированной популяцией клеток, способных к локальной пролиферации. Для дифференцировки клеток Купфера требуются многие факторы роста, важнейшим из которых являются колониестимулирующие факторы. 1.3 Функции клеток Купфера Среднее время жизни клеток Купфера составляет 3,8 суток. Их главная функция — удаление инородного дебриса и частиц, поступающих в печень по воротной вене. Крупные частицы, возможно, поглощаются клетками Купфера с помощью фагоцитоза, а мелкие — посредством пиноцитоза. Клетки Купфера входят в систему врождённого иммунитета и играют важную роль в защите организма, а также метаболизируют различные вещества липидной природы, расщепляют белковые комплексы и мелкие частицы. Они также удаляют из кровотока апоптотические клетки. Количество клеток Купфера в печени постоянно и поддерживается с помощью апоптоза и фагоцитоза соседними клетками Купфера. Они обладают пролиферативным потенциалом и могут восстанавливать свою численность, в отличие от макрофагов, происходящих от моноцитов, которые неспособны к пролиферации. По функциям клетки Купфера гетерогенны, и клетки из разных локаций могут отличаться функционально. Например, клетки Купфера из зоны 1 дольки печени более активны, чем таковые из зоны 3, вероятно, в связи с тем, что клетки из зоны 1 больше сталкиваются с чужеродными частицами и веществами. Клетки Купфера могут продуцировать провоспалительные цитокины, в частности, фактор некроза опухоли α (TNFα) в M1-состоянии, и противовоспалительные цитокины, например, IL-10, в M2-состоянии, кислородные радикалы и протеазы. Выделение этих соединений может приводить к повреждениям печени. Кроме того, клетки Купфера несут рецепторы комплемента иммуноглобулинового семейства (CRIg), и мыши, на которых проводили опыты, лишённые CRIg, неспособны разрушать патогенные клетки, покрытые компонентами системы комплемента. CRIg консервативны у человека и мышей и играют важную роль в работе врождённого иммунитета. Клетки Купфера играют решающую роль во врожденном иммунном ответе; локализация в печеночном синусоиде позволяет им эффективно фагоцитировать патогены, поступающие с портальным или артериальным кровотоком. Клетки Купфера также служат первой линией защиты от иммунореактивного материала, попадающего с портальной циркуляцией из желудочно-кишечного тракта, и могут считаться конечным компонентом барьерной функции кишечника. Таким образом, клетки Купфера играют основную противовоспалительную роль, предотвращая продвижение иммунореактивных веществ, поступающих из кишечника, через печеночные синусоиды. Клетки Купфера также отлично справляются с функцией устранения частиц, таких как погибшие эритроциты и другие клетки, попадающих в паренхиму печени из системного кровообращения. Таким образом, клетки Купфера представляют собой основную фагоцитарную активность того, что классически называли ретикулярно-эндотелиальной системой, а теперь более правильно называют мононуклеарной фагоцитарной системой. Изменение функциональной активности клеток Купфера связано с различными болезненными состояниями. В то время как клетки Купфера могут быть защитой в ряде ситуаций, включая лекарственное повреждение печени и индуцированный токсинами фиброз; дисрегуляция воспалительных реакций в клетках Купфера может способствовать хроническому воспалению в печени, включая алкогольную и безалкогольную жировую болезнь печени – НЖБП/НАСГ (НЖБП – неалкогольная жировая болезнь печени, НАСГ – неалкогольный стеатогепатит). Близость клеток Купфера к паренхиматозным и непаренхиматозным клеткам печени поддерживает способность клеток Купфера регулировать функцию печени, как в здоровом состоянии, так и в болезни. В здоровой печени клетка Купфера демонстрирует то, что было названо «толерогенным» фенотипом. Эта толерантность необходима для предотвращения нежелательных иммунных реакций в отношении входящих в печеночную синусоиду иммунореактивных веществ, включая материалы, полученные из кишечника, а также антигены, присутствующие в мертвых или умирающих клетках, поскольку в печени они удаляются из кровообращения. Однако при определенных болезненных состояниях клетка Купфера переходит из этого толерогенного фенотипа в патологически активированное состояние, которое характерно для хронических воспалительных заболеваний. Учитывая тесную близость клетки Купфера к паренхиматозным и непаренхиматозным клеткам печени, потеря толерантного состояния может привести к повреждению гепатоцеллюлярной ткани. Таким образом, как и в случае многих других компонентов врожденной иммунной системы, поддержание соответствующей функциональной активности клеток Купфера имеет решающее значение для поддержания организма в здоровом состоянии. Отсутствие или пониженная функциональная активность клеток Купфера может способствовать инвазии патогенов и/или системному воспалению. Напротив, активация клеток Купфера в таких условиях, как НЖБП/НАСГ, приводит к неконтролируемому воспалению печени. Поэтому при создании терапевтических средств, предназначенных для лечения хронических воспалительных заболеваний печени, крайне важно разработать подходы, которые нормализуют или подавляют, но не устраняют полностью функциональную активность клеток Купфера. 1.4 Клиническое значение Клетки Купфера задействованы в патогенезе острой и хронической алкогольной болезни печени, которая может проявляться в виде стеатоза, стеатогепатита, фиброза и цирроза. Активация клеток Купфера при чрезмерном употреблении алкоголя приводит к ранним повреждениям печени, которые часто встречаются при хроническом алкоголизме. В этом случае на клетках Купфера активируются рецепторы TLR4 и CD14, которые предназначены для распознавания и интернализации эндотоксина. Активация этих рецепторов приводит к избыточному поглощению эндотоксина, происходящего от кишечных бактерий, и последующему запуску транскрипции гена, кодирующего TNFα, и продукции супероксида. Продуцируемый клетками Купфера TNFα действует на клетки Ито в печени, что приводит к запуску биосинтеза коллагена и фиброзу, который, в конечном итоге, приводит к развитию цирроза печени. При сепсисе клетки Купфера отвечают за большую часть повреждений печени. Макрофаги печени активируются и продуцируют IL-1 и TNFα, которые, в свою очередь, активируют лейкоциты и синусоидальные эндотелиальные клетки, начинающие экспрессировать ICAM-1. В итоге эндотелий сосудов печени разрушается под действием протеаз, кислородных радикалов и других веществ, продуцируемых лейкоцитами. Активация клеток Купфера необходима для ответа печени на инфекцию или травму; последующий воспалительный ответ защищает от инфекции, а также ограничивает клеточное и органное повреждение организма хозяина. Таким образом, во многих случаях, таких как интоксикация ацетаминофеном, а также при гепатоцеллюлярном восстановлении, клетка Купфера выполняет важную защитную, заживляющую функцию. Однако при других типах повреждений печени клетка Купфера неспособна надлежащим образом контролировать или разрешать свое состояние активации. Контролируемое и адекватное разрешение воспаления является важной особенностью врожденного иммунного ответа. Неспособность клеток Купфера разрешать активацию способствует возникновению ряда хронических воспалительных заболеваний печени. Учитывая двойную защитную и потенциально опасную роль активации клеток Купфера, разработка терапевтических стратегий для модуляции активности клеток Купфера во время болезни печени должна быть критически рассчитана таким образом, чтобы адекватно регулировать функцию клеток Купфера во время динамических стадий повреждения печени. При исследовании роли клеток Купфера в здоровом состоянии и в болезни важно понять, что локализованный ответ врожденной иммунной системы в печени может отличаться от системного врожденного иммунного ответа и/или локализованных реакций других органов. Например, хроническое употребление алкоголя обычно повышает восприимчивость индивидуумов к инфекциям. Предположительно, несмотря на повышенные воспалительные реакции, наблюдаемые в печени в результате хронического употребления этанола, системные иммунные реакции подавляются хроническим воздействием этанола. Даже внутри печени могут быть различными ответы отдельных компонентов иммунного ответа. Одним из примеров является взаимодействие этанола с инфекцией – вирусом гепатита С (HCV). Хроническое злоупотребление алкоголем связано с увеличением заболеваемости HCV -инфекцией. Уменьшенная способность отражать вирусные инфекции контрастирует с повышенным ответом печени на эндотоксин. Такие разные ответы могут быть связаны с высокоспецифическим толерантным статусом клетки Купфера в печени. Понимание локализованных и специфических реакций иммунной системы в печени поможет разработать стратегии вмешательств, специально направленные на звенья иммунной системы, которые способствуют инициированию и поддержанию заболеваний печени. Клетки Купфера способствуют метаболическим заболеваниям печени: алкогольная и неалкогольная болезнь печени Прогрессирование АБП и НЖБП/НАСГ следует характеристикам, общим для всех типов заболеваний печени, независимо от этиологии. Эта прогрессия отмечена появлением жирового гепатоза, некроза гепатоцитов и апоптоза, воспаления, регенерирующих узелков, фиброза и цирроза. Развитие стеатоза, воспаления, фиброза и цирроза представляет собой сложный процесс, включающий как паренхиматозные, так и непаренхиматозные клетки печени, а также другие типы печеночных клеток в ответ на повреждение и воспаление. Многие из событий, связанных с развитием АБП или НЖБП/НАСГ, типичны для других ответных реакций тканей на повреждение, таких как заживление повреждений кожи и мягких тканей. Как и во всех ответах на заживление ран, врожденная иммунная система вносит решающий вклад в своевременное и эффективное восстановление как структуры, так и функции поврежденной ткани или органа. Действительно, в то время как развитие фиброза печени инициируется в ответ на гепатоцеллюлярное повреждение, дисрегуляторные воспалительные процессы способствуют развитию фиброзной болезни. Особенно важную роль в развитии заболевания печени играют печеночные макрофаги. Роль клеток Купфера, резидентных печеночных макрофагов, была впервые определена как ключевой вклад в прогрессию АБП. В то время как ранние исследования ожирения характеризовали критическую роль резидентных макрофагов жировой ткани в развитии метаболического синдрома, более поздние исследования также идентифицировали клетки Купфера как важнейшие медиаторы НЖБП/НАСГ. Например, в модели с высоким содержанием жиров при печеночном стеатозе у мышей истощение клеток Купфера при помощи клодроната приводит к аннулированию стеатоза печени. 1.5 История изучения Клетки Купфера были открыты в 1876 году немецким анатомом Карлом Вильгельмом Купфером (1829—1902) (Приложение 3), в честь которого впоследствии и получили своё название. Сам Купфер назвал их Sternzellen (звёздчатые клетки), однако он посчитал, что они являются частью эндотелия кровеносных сосудов печени и происходят от эндотелиоцитов. В 1898 году Тадеуш Брович (Приложение 4) показал, что клетки Купфера в действительности являются макрофагами. У взрослых животных незрелыми предшественниками тканевых макрофагов считаются моноциты в периферическом кровообращении, происходящие из клеток-предшественников в костном мозге. Моноциты периферической крови могут проникать в печень, а затем созревать в фенотип, характерный для тканевых макрофагов. Дифференциация макрофагов регулируется различными факторами роста, но наиболее важной для развития зрелых клеток Купфера представляется роль макрофагального колониестимулирующего фактора. Контроль количества клеток Купфера в печени тесно поддерживается; однако механизмы этого контроля недостаточно понятны. Ясно, что скорость поступления периферических моноцитов в печень выше, чем в другие ткани, например, в легкие; однако существует противоречие, касающееся периода жизни клеток Купфера в печени. Исследования, проведенные на животных, в ходе которых клетки Купфера истощали либо клодронатом, либо трансплантацией костного мозга, показывают, что их замена происходит через 14-21 день. Однако судьба клеток Купфера в физиологических условиях еще не понята; предполагается, что их оборот может произойти из-за запрограммированной гибели (апоптоза) и/или миграции на другие участки, например, в лимфатические узлы. Недавно полученные данные показывают, что в ответ на Th-2 воспалительные сигналы, такие как увеличение IL-4, может стимулироваться пролиферация резидентных макрофагов, в том числе клеток Купфера. Глава 2. Ретикулоэндотелиальная система 2.1 Учение о ретикулоэндотелиальной системе Ретикулоэндотелиальная система (РЭС) — устаревший термин для обозначения тканевых макрофагов (например: микроглия, клетки Купфера в печени, альвеолярные макрофаги, клетки Лангерганса). Тканевые макрофаги заселяют органы на различных этапах эмбриогенеза (как, например, микроглия или клетки Купфера) или в раннем послеродовом периоде (альвеолярные макрофаги). В нормальных условиях тканевые макрофаги поддерживают свою популяцию за счёт пролиферации на месте, а не за счёт прихода новых клеток (моноцитов) из костного мозга. С 1969 года заменена термином «система мононуклеарных фагоцитов». Общую совокупность моноцитов, мобильных макрофагов, фиксированных тканевых макрофагов и некоторых специализированных эндотелиальных клеток костного мозга, селезенки и лимфатических узлов называют ретикулоэндотелиальной системой. Однако все или почти все эти клетки происходят из моноцитарных стволовых клеток; следовательно, ретикулоэндотелиальная система практически синонимична моноцитарно-макрофагальной системе. Поскольку термин ретикулоэндотелиальная система гораздо более распространен в медицинской литературе, чем термин моноцитарно-макрофагальная система, его следует понимать как генерализованную фагоцитарную систему, локализованную во всех тканях, особенно в тех тканевых областях, где должны разрушаться большие количества частиц, токсинов и других нежелательных веществ. Согласно ранее существовавшим представлениям под РЭС понимали совокупность клеток (ретикулярные, эндотелиальные клетки, макрофаги и др.), имеющих различное происхождение, обладающих способностью к эндоцитозу и выполняющих защитную функцию. Благодаря работам выдающихся русских ученых И. И. Мечникова и А. О. Ковалевского еще в конце 19 в. стало известно, что клетки, захватывающие инородный материал, имеются у многоклеточных животных различных систематических групп. И. И. Мечников назвал эти клетки фагоцитами и отнес их к одной клеточной системе. На основа широких сравнительно-зоологических исследований И. И. Мечников пришел к выводу о защитной функции этих клеток, сыгравшему решающую роль в развитии теории и практики медицины. Кийоно (К. Kiyono) — сотрудник Л. Ашоффа опубликовал свои наблюдения о существовании в различных тканях и органах организма клеток, способных накапливать витальный краситель кармин. Этот критерий и лег в основу учения Л. Ашоффа (Приложение 5) о ретикулоэндотелиальной системе, согласно которому РЭС в широком смысле включает клетки, поглощающие витальные красители в умеренных и больших количествах, а именно: ретикулярные клетки красной пульпы селезенки и лимф, фолликулов периферических лимфоидных органов (селезенки, лимф, узлов, пейеровых бляшек жел.-киш. тракта), ретикулярные и эндотелиальные клетки синусоидных капилляров и лимфатических синусов костного мозга, периферических лимфоидных органов, надпочечников и гипофиза, купферовы клетки печени, гистиоциты соединительной ткани и моноциты крови. В РЭС не были включены эндотелиальные клетки большинства сосудов и фибробласты, т. к. эти клетки обладают очень слабой способностью к накоплению витальных красителей. Представления о РЭС складывались десятилетиями и плодотворно разрабатывались многими учеными разных стран, в т. ч. русскими и советскими учеными, такими как А. А. Максимов, А. А. Богомолец, H. Н. Аничков и др. Постепенно термин РЭС, введенный в научную литературу морфологами, стал обозначать защитную систему организма и, по сути дела, превратился в физиологическое понятие. По мере получения новых экспериментальных данных и развития сведений о происхождении, дифференцировке и функции тканей, составляющих основу РЭС, становилось ясным, что с точки зрения морфологии и особенно гематологии и иммунологии представления о РЭС неконкретны, расплывчаты и требуют основательного пересмотра. Так, ретикулярные клетки, которым отводилась важная роль в РЭС, и приписывалось множество функций (фагоцитоз, опорная функция, способность трансформироваться в различные клетки крови), выполняют опорную функцию и создают так называемое микроокружение для кроветворных и лимфоидных клеток; их относят к клеткам фибробластического типа (механоцитам). Есть все основания считать, что способность к эндоцитозу была ошибочно приписана эндотелиальным клеткам кровеносных и лимф, синусов, поскольку методы световой микроскопии не позволяли отличить их от имевших аналогичную топографию макрофагов (например, в синусоидных капиллярах печени). Как было выяснено с помощью современных методов исследования, эндотелиальные клетки морфологически и функционально резко отличаются как от ретикулярных клеток, так и от макрофагов и представляют независимый ряд дифференцировки. Основная их функция — транспорт веществ через стенки капилляров. Нечетко сформулированные морфологические критерии РЭС послужили основанием для вполне справедливой критики концепции РЭС (даже в период ее расцвета) со стороны таких известных морфологов, как А. А. Максимов (1927), А. А. Заварзин (1945) и Франческини (P. Franceschini, 1952). Последний находил более правильным использование термина «гистиоцитарная система», считая, очевидно, что в систему должны быть объединены родственные типы клеток. А. А. Заварзин (Приложение 6) подчеркивал, что к поглощению витальных красителей способны клетки всех тканей, включая эпителиальные и нервные, поэтому количественный критерий недостаточен для выделения РЭС. Эта дискуссия получила свое завершение в 1969 г. в Лейдене на конференции, посвященной проблемам РЭС, где была выдвинута новая концепция, согласно которой защитная функция, ранее приписываемая РЭС, наряду с другими, общими для них функциями, осуществляется системой клеток (макрофагов), имеющих общее происхождение, а также морфологическое, цитохимическое и функциональное сходство. Для обозначения этой системы был предложен термин «система мононуклеарных фагоцитов». Реже используются термины «макрофагальная система», «моноцитарно-макрофагальная система». В 1973 и 1978 гг. в Лейдене состоялись соответственно вторая и третья конференции по проблемам, касающимся системы мононуклеарных фагоцитов. В 1973 г. в Бюллетене ВОЗ была опубликована классификация, согласно которой макрофаги и их клетки-предшественники (моноциты и др.) включены в систему мононуклеарных фагоцитов. Таким образом, представления о системе мононуклеарных фагоцитов непрерывно совершенствуются, и в настоящее время данная система принята большинством исследователей во всем мире, а концепция РЭС представляет при этом только исторический интерес. Заключение Таким образом, можно подвести итоги из вышеизложенной информации о том, что клетки Купфера являются специализированными макрофагами печени, являющиеся частью ретикулоэндотелиальной системы. Основной функцией клеток Купфера является захват и переработка старых нефункциональных клеток крови. При этом разрушаются молекулы гемоглобина, их глобиновые цепи повторно утилизируются, а гем расщепляется на железо и билирубин. Итак, Макрофаги (клетки Купфера) в синусоидах печени; другой путь проникновения бактерий в организм – через желудочно-кишечный тракт. Большое количество бактерий из проглоченной пищи постоянно проходит через слизистую оболочку желудочно-кишечного тракта в портальную кровь. Прежде чем эта кровь попадает в общий кровоток, она проходит через печеночные синусоиды, которые выстланы тканевыми макрофагами, называемыми клетками Купфера. Эти клетки образуют настолько эффективную систему фильтрации твердых частиц, что почти ни одна из бактерий желудочно-кишечного тракта не переходит из портальной крови в общий системный кровоток. Действительно, видеозаписи фагоцитоза клетками Купффера продемонстрировали фагоцитоз одной бактерии менее чем за 0,01 секунды. Следовательно, ретикулоэндотелиальная система – система клеток, содержащихся в разных системах организма, несущая барьерную и фагоцитарную функции и функцию обмена веществ. Рецептор (от лат. Recipere – получать) – находящаяся на поверхности клетки биологическая макромолекула, которая предназначена для связывания с эндогенными лигандами (нейротрансмиттерами, гормонами, факторами роста). СПИСОК ЛИТЕРАТУРЫ Висмонт Ф.И. О роли клеток Купфера и гепатоцитов в механизмах реализации влияния трийодтиронина на процессы детоксикации и регуляции температуры тела / Ф.И. Висмонт, С.А. Артюшкевич // Белорусский мед. журнал. Минск, 2005. – Т. 13, № 13. – С. 45 - 47. Лаура Дж. Диксон, Марк Барнс, Хуэй Тан, Мишель Т. Притчард и Лаура Э. Наджи. Клетки Купфера, или резидентные макрофаги печени// Пер. с англ. Н.Д. Фирсовой, 2018 Хрущов H. Г., Старостин В. И. Ретикуло-эндотелиальная система // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский. — 3-е изд. — М. : Советская энциклопедия, 1984. — Т. 22 : Растворители — Сахаров. — 544 с. : ил. Хрущов H. Г., Старостин В. И. Система мононуклеарных фагоцитов // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский. — 3-е изд. — М. : Советская энциклопедия, 1984. — Т. 23 : Сахароза — Сосудистый тонус. — 544 с. : ил. Цыркунов В. М., Андреев В.П., Кравчук Р.И., Прокопчик Н.И. Клиническая цитология печени: клетки Купфера// Журнал Гординского государственного медицинского университета, Том 15(4), 2017. – С. 419. ПРИЛОЖЕНИЕ Приложение 1 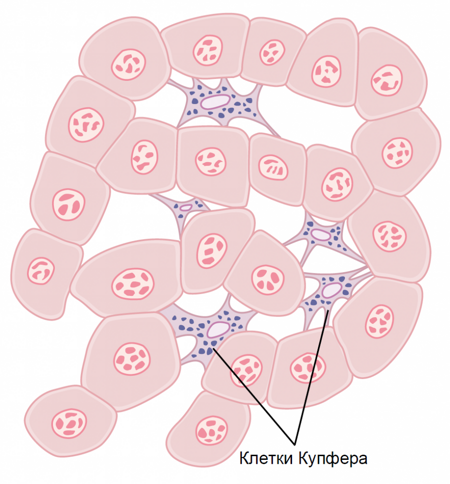 Клетки Купфера, выстилающие синусоиды печени, показаны в виде клеток, которые фагоцитировали в цитоплазму частицы Приложение 2 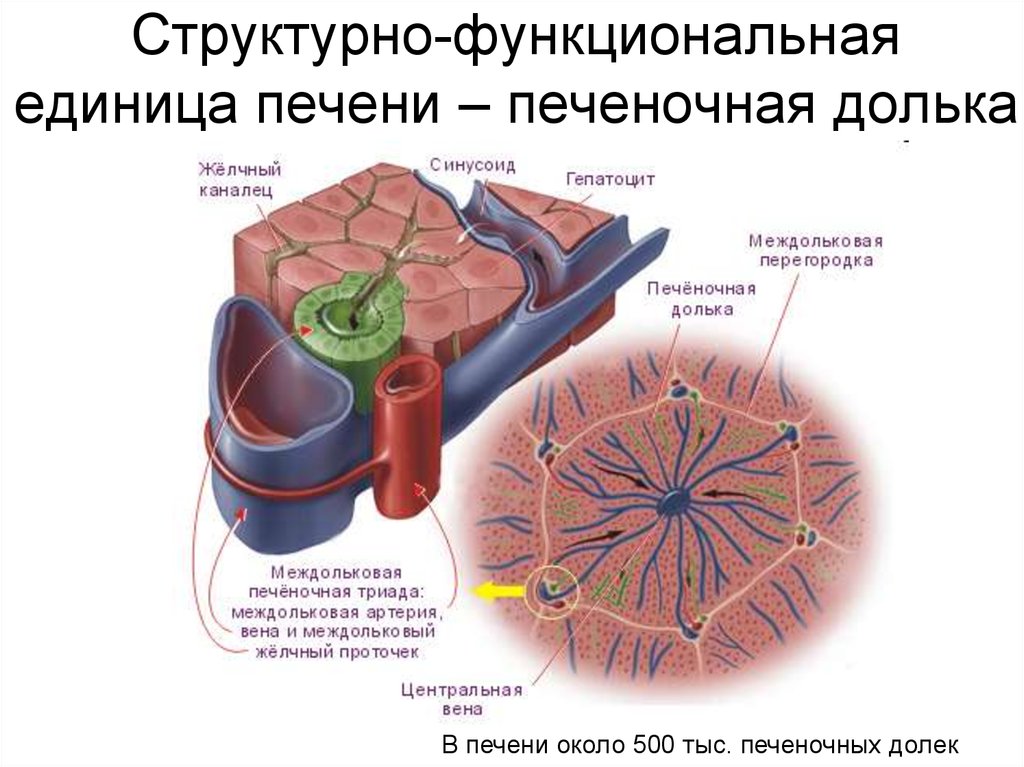 П  риложение 3 риложение 3Карл Вильгельм Купфер (1829—1902) Приложение 4  Тадеуш Брович (1847 — 1928) Приложение 5  Людвиг Ашофф Людвиг Ашофф (1866—1942) Приложение 6  Заварзин Алексей Алексеевич (1886—1945) |
