клеточный иммунный ответ. Клеточный иммунный ответ. Клеточный иммунный ответ
 Скачать 0.74 Mb. Скачать 0.74 Mb.
|
|
Примечание: знак “+” - относительная сила проявления признака. При этом, чтобы наивная T-клетка вышла в процесс своего развития до форм зрелых эффекторов, необходимы два сигнала от клеточной поверхности к геному. Связывание антигенраспознающего T-клеточного рецептора с комплексом антигенный пептид:молекулы I или II класса МНС и включение в комплексообразование корецепторов CD8 или CD4 обеспечивает формирование первого сигнала к пролиферации и дифференцировке T-клеток . Для полноценного развития специфического ответа необходим второй сигнал от клеточной поверхности к геному. Костимулятором в данном случае выступает молекула В7 , экспрессирующаяся на поверхности антигенпрезентирующей клетки . Рецептором для В7 на поверхности наивной Т-клетки является белок CD28 . Взаимодействие CD28:В7 обеспечивает формирование второго сигнала. Помимо CD28 активированные наивные Т-клетки синтезируют и экспрессируют еще один белок с костимулирующей активностью - СTLA-4 , обладающей большей аффинностью в сравнении с В7. Совместное костимулирующее действие этих молекул оказывает больший эффект на развитие Т-клеток. Отсутствие двойного сигнала для созревания T-клеточных эффекторов является препятствием для формирования ответа к собственным антигенам. Биологический смысл подобного явления понятен. Помимо внутритимусной отрицательной селекции аутореактивных клонов существует дополнительный заслон запрещенным клонам, действующий на периферии. Этот заслон создают макрофаги и B-клетки, у которых в условиях нормы отсутствует один из ключевых костимуляторов - B7. Интерлейкин-2: участие в процессе созревания Т-клеток. Встреча организма с антигеном требует быстрого формирования гуморального или клеточного ответа. Одним из основных участников реализации специфического сигнала от антигена и костимулирующего сигнала от В7 антигенпрезентирующих клеток является интерлейкин-2 (ИЛ-2) . В результате двухсигнальной активации клона наивных T-клеток начинаются синтез и секреция этого цитокина и одновременная экспрессия на клеточной поверхности его рецептора. ИЛ-2, взаимодействуя с собственным рецептором, обеспечивает быстрое размножение и последующую дифференцировку наивных Т-клеток до зрелых эффекторов. В процессе инициации синтеза ИЛ-2 ключевая роль принадлежит костимулятору В7. Распознавание антигена Т-клеточным рецептором индуцирует несколько транскрипционных факторов. Один из них - ядерный фактор активации у Т-клеток (англ. сокр. NF-AT ), который, взаимодействуя с промотором ИЛ-2-гена, обеспечивает транскрипцию соответствующего гена. Однако дерепрессия ИЛ-2-гена не приводит к активной продукции этого цитокина, так как цитокиновые мРНК нестабильны. Взаимодействие CD28 с В7 формирует сигнал, который стабилизирует мРНК этого интерлейкина. В результате такой стабилизаци РНК происходит усиление синтеза ИЛ-2 в 20-30 раз. Т-клетки начинают активно пролиферировать и дифференцироваться в зрелые эффекторные клетки. Если распознавание антигена Т-клетками происходит в отсутствие костимулирующего сигнала от В7:CD28, то продукция ИЛ-2 крайне низка, и Т-клетки не могут адекватно ответить на антиген. Важное значение ИЛ-2 в инициации специфического иммунного ответа хорошо иллюстрируется применением лекарственных препаратов, подавляющих отторжение трансплантатов . Хорошо известный в клинике циклоспорин А подавляет продукцию ИЛ-2, нарушая прохождение сигнала от Т-клеточного рецептора , провзаимодействовавшего с антигеном. В итоге формирование антигенспецифического клона Т-клеток подавляется, что обеспечивает длительное выживание трансплантированных органов. Изменение экспрессии поверхностных молекул T-клеток. Взаимодействие наивных Т-клеток с антигенным комплексом и костимулятором В7 на поверхности антигенпрезентирующих клеток инициирует полноценный синтез и секрецию ИЛ-2 . Этот цитокин аутокринным способом стимулирует наивные Т-клетки к пролиферации и дифференцировке. После пролиферативной фазы, длящейся 4-5 дня, эти клетки дифференцируются в зрелые эффекторные Т-лимфоциты , которые способны синтезировать все белки, требуемые для выполнения специализированных функций. Одно из следствий прошедшей дифференцировки Т-клеток состоит в прямом их действии на чужеродные в антигенном отношении клетки без использования каких-либо костимулирующих сигналов. Обеспечивается подобное прямое эффекторное действие количественным и качественным изменением состава поверхностных молекул T-клеток. Это относится ко всем зрелым Т-клеткам независимо от деления на субпопуляции. Завершившие дифференцировку Т-клетки характеризуются, во-первых, усилением экспрессии LFA-1 и CD2 молекул, которые позволяют T-клеткам более эффективно взаимодействовать с клетками-мишенями, экспрессирующими чужеродные антигены. Такое усиление особенно существенно для цитотоксических CD8 T-клеток , так как большинство клеток организма характеризуется незначительным уровнем адгезинов ICAM и LFA-3 , которые хорошо представлены только на антигенпрезентирующих клетках . Второе изменение касается антигенраспознающего Т-клеточного рецепторного комплекса . Тирозинспецифическая фосфатаза ( СD45 ), выполняющая важную функцию в передаче сигнала внутрь клетки с Т-клеточного рецепторного комплекса, представлена на поверхности Т-клеток разными изоформами. Одна из функций этих изоформ - связывание Т-клеточного рецептора с корецепторами CD4 или CD8 , что обеспечивает эффективное прохождение сигнала от антигена внутрь клетки. И, наконец, зрелые эффекторные Т-клетки теряют L-селектин , который был необходим наивным Т-клеткам при заселении лимфоидной ткани, но оказывается не нужным и даже вредным при развитии иммунного ответа, так как мешает миграции в зону проникновения патогена. Экспрессия L-селектина заменяется интегрином VLA-4 . Этот адгезин позволяет Т-клеткам связываться с сосудами в зоне воспаления и выполнять тем самым свою антигеннейтрализующую функцию (рис.12.). Рис. 12. 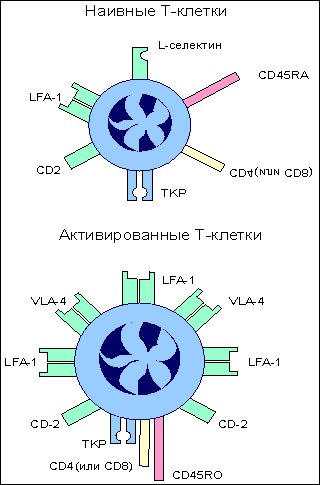 Изменение экспрессии поверхностных молекул при дифференцировке наивных Т-клеток в зрелые эффекторы. При созревании наивных Т-клеток происходит изменение экспрессии поверхностных молекул, обладающих различными функциональными проявлениями в иммунном ответе. ТКР образует комплекс с ко-рецептором CD4 (или CD8) при участии тирозин-специфической фосфатазы клеточной поверхности CD45; усиливается экспрессия адгезинов LFA-1 и CD2 (подобное усилие особенно важно для цитотоксических CD8 Т-клеток); появляется новый адгезин VLA-1, помогающий связыванию Т-клеток с сосудами в зоне проникновения антигена; в то же время подавляется экспрессия L-селектина, который необходим наивным Т-клеткам при заселении лимфоидной ткани, но становится помехой при миграции зрелых Т-клеток в зону проникновения антигена. Наивные CD8 Т-клетки: способы активации. Инициация дифференцировки наивных CD8 T-клеток в зрелые цитотоксические Т-лимфоциты осуществляется несколькими способами. I.Наиболее простой из них связан с дендритными клетками . Этот тип антигенпрезентирующих клеток характеризуется выраженной экспрессией костимулятора В7 , что само по себе является достаточным условием активации синтеза ИЛ-2 . Данный цитокин обеспечивает активную пролиферацию и дифференцировку наивных Т-клеток, используя аутокринный путь стимуляции (рис. 13). Рис. 13. 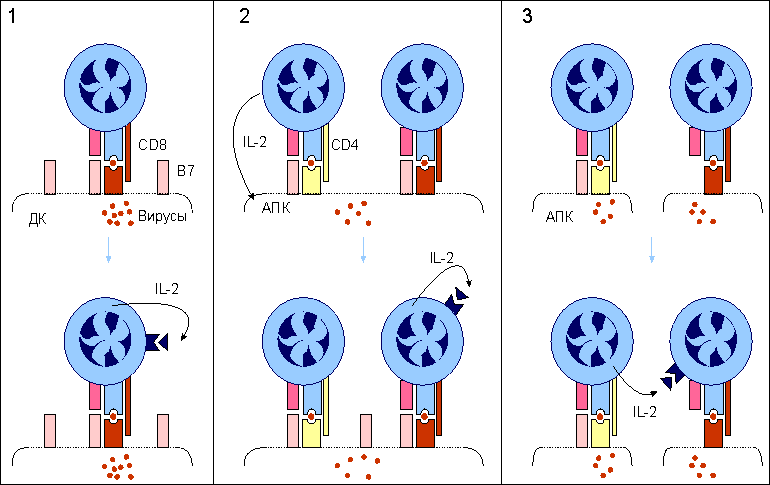 Активация наивных CD8 Т-клеток. 1. Наиболее простой способ активации CD8 Т-клеток наблюдается при распознавании этими клетками иммуногенного комплекса на поверхности дендритных клеток (ДК), обладающих выраженной экспрессией костимулятора В7. Формирование второго сигнала с помощью В7 обеспечивает активную продукцию интерлейкина-2 (IL-2) CD8 Т-клетками. Данный цитокин аутокринным способом активирует наивные CD8 Т-клетки к дифференцировке. 2. В условиях, когда антигенпрезентирующие клетки (АПК) не имеют В7 на своей поверхности, в процесс активации вступают CD4 Т-клетки. Секретируемый CD4 Т-клетками IL-2 после распознавания иммуногенного комплекса на поверхности АПК стимулирует экспрессию В7 этими клетками. Дальнейшее развитие событий неотличимо от первого случая. 3. В условиях, когда CD8 Т-клетки распознают иммуногенный комплекс на клетках, не способных к экспрессии В7 даже при стимуляции, запуск дифференцировки с помощью IL-2 осуществляется по принципу дистанционного управления. II.В то же время цитотоксический ответ к некоторым вирусам и чужеродным трансплантатам требует присутствия CD4 T-клеток . Возможно, это связано с недостаточной иммуногенностью вирусных и трансплантационных антигенов для формирования первого сигнала от Т-клеточного рецептора или слабой экспрессией В7 , формирующего второй сигнал . При включении в ответ CD4 Т-клеток, которые способны стимулировать антигенпрезентирующие клетки к синтезу В7, создаются нормальные условия для двойной стимуляции наивных CD8 Т-клеток. III.Третий способ стимуляции наивных CD8 T-клеток к дифференцировки связан с прямым действием на них ИЛ-2 , секретируемого распознавшими антиген CD4 T-клетками . Этот способ проявляется в условиях отсутствия индуцируемой экспрессии В7 под влиянием CD4 Т-клеток. Какой из этих способов доминирует в организме при формировании цитотоксического ответа, пока неизвестно. Наивные CD4 Т-клетки: дифференцировка в TH1 и TH2 CD4 T-клетки , покинувшие тимус, не могут непосредственно встать на путь созревания до зрелых эффекторов. В отличие от наивных CD8 T-клеток , они должны пройти дополнительный этап развития на периферии , который заканчивается формированием незрелых ТН0 -клеток. Именно от этих коммитированных клеток в зависимости от ситуации формируются зрелые эффекторы: ТН1-клетки воспаления (CD4 Т-клетки воспаления) и хелперные ТН2-клетки (хелперные CD4 Т-клетки) . Они не различаются по фенотипическим маркерам клеточной поверхности, но известны их разные возможности в синтезе цитокинов . ТН0 продуцируют интерлейкин-2 и интерлейкин-4 . ТН1 продуцируют интерлейкин-2 , интерлейкин-3 , гранулоцитарно-макрофагальный колониестимулирующий фактор , интерферон-гамма , фактор некроза опухолей-бета (лимфотоксин) . ТН2 продуцируют интерлейкин-3 , интерлейкин-4 , интерлейкин-5 , интерлейкин-6 , интерлейкин-10 и гранулоцитарно-макрофагальный колониестимулирующий фактор . Интерлейкин-3 и гранулоцитарно-макрофагальный колониестимулирующий фактор являются общими для ТН1 и ТН2. Эти два цитокина принимают участие в качестве факторов гемопоэтической дифференцировки в костном мозге . Остальные цитокины являются характерными только для определенной субпопуляции. Цитокины, свойственные ТН1, активируют в основном макрофаги . Цитокины, свойственные ТН2, активируют В-клетки . Активность именно этих цитокинов определяет разную эффекторную функцию двух субпопуляций. Механизмы, направляющие дифференцировку Т-клеток в зависимости от иммунологической ситуации пока недостаточно понятны. Однако ряд экспериментальных данных позволяет представить следующую картину. Макрофаги, захватившие бактерии или вирусы, начинают продукцию интерлейкина-12 , для которого клеткой-мишенью являются наивные Т-клетки. При этом стимулированные макрофагами нормальные киллеры секретируют интерферон-гамма . Два этих цитокина при совместном действии на наивные Т-клетки определяют их развитие в сторону образования CD4 Т-клеток воспаления . В то же время наивные Т-клетки, стимулированные интерлейкином-4 , дифференцируются в хелперные CD4 T-клетки . Источником интерлейкина-4 могут быть базофилы и тучные клетки . При этом интерлейкин-4 является ингибитором развития Т-клеток воспаления . Эффекторное действие зрелых Т-клеток. Прошедшая постантигенная дифференцировка Т-клеток создает пул функционально активных клеток, действующих на периферии . Основные субпопуляции Т-клеток, призванные эффективно нейтрализовать чужеродный антиген представлены цитотоксическими T-клетками CD8 , CD4 Т-клетками воспаления (ТН1) и хелперными CD4 Т-клетками (ТН2) . Первые две субпопуляции обеспечивают клеточную форму защиты либо непосредственно разрушая инфицированные соматические клетки (CD8 T-клетки), либо активизируя макрофаги к внутриклеточному разрушению паразитов ( ТН1 ). Третья субпопуляция ( ТН2 ), являясь производной Т-системы иммунитета, проявляет свое вспомогательное эффекторное действие не только в клеточном иммунитете , но и при формировании гуморального иммунного ответа . Активность CD8 Т-клеток: общая характеристика. Вирусы не имеют собственного биосинтетического аппарата и для своего воспроизведения используют клетки хозяина. Являясь внутриклеточными патогенами, они защищены от прямого действия нейтрализующих антител , и только выход во внешнюю среду в результате разрушения клетки хозяина делает их доступными для специфических иммуноглобулинов . Основным фактором препятствия активному размножению вирусов и инфицированию пораженного организма являются зрелые цитотоксические T-лимфоциты (CD8 T-клетки) . Очевидным свойством этих клеток является специфичность их действия на клетку-мишень, т.е. уничтожение только тех клеток тканей, которые поражены вирусными частицами. В этой выборочности действия заключен вполне конретный биологический смысл. Не нарушая ткань в целом, цитотоксические T-лимфоциты освобождают организм от вирусной инфекции, уничтожая только пораженные вирусом клетки. Известны две формы гибели клеток: некроз и апоптоз . Некроз клетки. Некроз-это патологическая, форма клеточной смерти. Такая смерть постигает клетку, когда Т-киллер своевременно не распорядился судьбой инфицированной клетки, наставив ее на путь апоптоза. Вирус или иной паразит, размножившись в клетке, разрушает ее: клетка лизируется, ее содержимое изливается наружу, в межклеточное пространство. Некоторые внутриклеточные паразиты, включая простейшее Toxoplasma gondii (возбудитель токсоплазмоза), способны к подавлению апоптоза . Новое поколение паразитов устремляется в соседние клетки, нанося все больший и больший ущерб организму. Начинается воспалительный процесс, исходом которого может быть как выздоровление, так и гибель организма. Некротическую гибель могут вызывать физические или химические повреждения, например обморожение или ожог, органические растворители, гипоксия, отравление, гипотонический шок и др. . Гибель клеток в процессе некроза связана с нарушениями в мембране или цитоплазме клеток и не затрагивает существенно клеточное ядро. К некрозу, в частности, приводит атака клетки антителами и комплементом , что вызывает образование пор в мембране, нарушение осмотического давления в клетке, разрыв мембраны и, в конечном итоге, гибель клетки. Некротическая гибель клеток-мишеней под влиянием зрелых CD8 T-клеток связана, в первую очередь, с перфоринами , выделяемыми из гранул цитотоксических T-клеток после распознавания ими чужеродного антигена на инфицированных вирусом клетках ( рис. 2 и рис.14 ). Рис. 14. 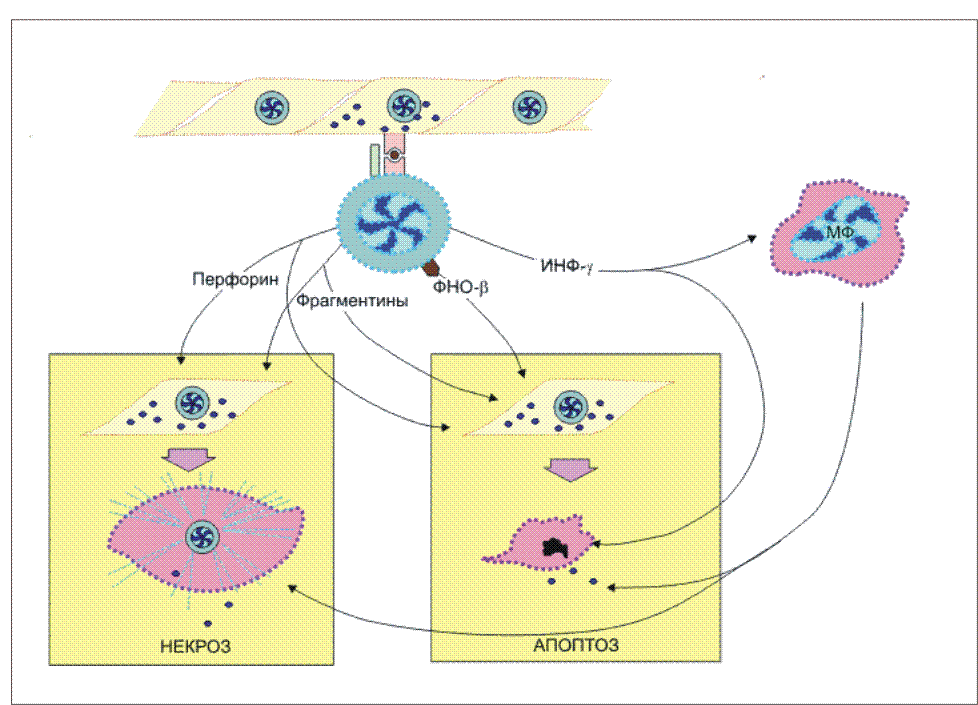 Эффекторное действие зрелых цитотоксических Т-лимфоцитов. Действие цитотоксических Т-лимфоцитов (ЦТЛ; CD8 Т-клеток) на клетки-мишени, зараженных, в частности, вирусом, имеет двойное проявление. После распознавания иммуногенного комплекса на клетке-мишени CD8 T-клетка выделяет целый набор эффекторных молекул, совместное действие которых вызывает либо некроз (лизис), либо апоптоз инфицированных клеток. При некрозе основными эффекторными молекулами являются перфорин и фрагментины. При апоптозе к этим молекулам добавляется фактор некроза опухолей-бета (ФНО-бета; лимфотоксин). Интерферон-гамма (ИФ-гамма) оказывает прямое ингибирующее действие на размножение вирусов. Кроме того, этот цитокин активируем макрофаги (МФ), вызывая их миграцию в зону проникновения вирусных частиц. Там активированные клетки выполняют по крайней мере две функции: эффекторов, поглощающих и разрушающих вирусные частицы, и антигенпрезентирующих клеток, способствуя вступлению в реакцию дополнительных CD8 Т-клетов. Воспаление - зачастую это катастрофа для окружающих клеток в организме животного. Симптомы воспаления сформулированы еще А.К, Цельсом (А.С. Celsus) - это "rubor, calor, tumor et dolor" (покраснение, жар, опухание и боль). Все это в конечном итоге может привести к нарушению функции (functio laesae) и даже к гибели организма . Элементы разрушительного характера являются атрибутами воспалительной реакции. Наличие или отсутствие воспаления у животных используется как признак, позволяющий отличить апоптоз от некроза. Некроз характеризуется разрывом цитоплазматической и внутриклеточных мембран, что приводит к разрушению органелл, высвобождению лизосомальных ферментов и выходу содержимого цитоплазмы в межклеточное пространство (рис. 15.). |
