клеточный иммунный ответ. Клеточный иммунный ответ. Клеточный иммунный ответ
 Скачать 0.74 Mb. Скачать 0.74 Mb.
|
|
Рис 15. Смерть клетки: цитологическая картина 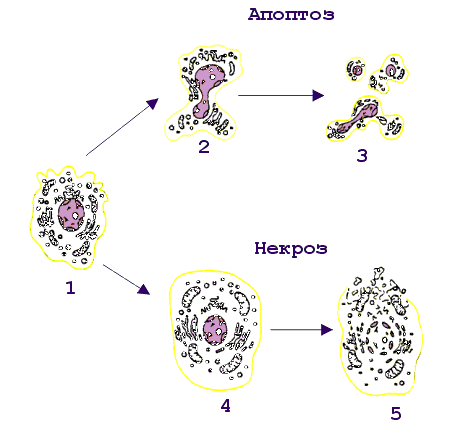 Цитологическая картина некроза и апоптоза Апоптоз клеток. Организмы разных людей имеют более или менее одинаковое число клеток. Как поддерживается такое постоянство? Одна группа механизмов достаточно очевидна. Клетка может разделиться на две дочерние, а может и не делиться. Какая из этих возможностей реализуется, зависит как от генетической программы, так и от внешних сигналов, которые клетка получает от своих соседей или из окружающей среды. Но существует и другой механизм, привлекший внимание ученых лишь в последние годы. Оказывается, есть особая генетическая программа, реализация которой при определенных условиях приводит клетку к гибели. Гибнет клетка не от руки какого-нибудь постороннего убийцы, она сама приносит себя в жертву во имя блага организма. При формировании некоторых органов человека и животных первоначально возникает намного больше клеток, чем потом потребуется. Например, так бывает при развитии нервной системы. Лишние клетки в свое время мирно гибнут. Мирно - значит, без воспаления. Клетка сморщивается и постепенно распадается на обломки, которые обычно поедаются макрофагами, у которых хороший аппетит. Но как узнать, какая клетка лишняя, а какая нет? Самопожертвование осуществляется при участии ряда факторов, многие из которых еще не известны. Схематически смертоносный сценарий можно разбить на несколько этапов. На первом этапе клетка получает “послание” о том, что она должна пожертвовать своей жизнью для благополучия организма. Это известие приходит либо от соседних клеток, либо от межклеточных веществ. Чтобы воспринять такое “послание”, клетки имеют специальные рецепторы (от латинского recipere - получать). Сигнальные молекулы и рецепторы подходят друг к другу, как ключ к замку. Во втором действии драмы внутриклеточные регуляторы - посланники, получив важные инструкции, вносят поправки в работу отдельных генов. В конечном счете появляются или активируются ферменты, способные разрушать клеточные белки и нуклеиновые кислоты. В заключительном акте клетка теряет свою целостность и становится пищей для макрофагов. Морфологические и биохимические изменения в клетках - самоубийцах весьма схожи в разных органах и у разных организмов. Этот комплекс изменений, характерный для программируемой гибели клеток, часто обозначают термином а п о п т о з, что в переводе с греческого означает “опадание листьев” Программа, принимающая крайне ответственное (и иногда неправильное) решение - жить или не жить, - должна быть предельно осмотрительной, поэтому клетка старается сделать все, чтобы не ошибиться. Анализ информации внутри клетки происходит при участии многих белков. В последнее время открыты белки как способствующие, так и препятствующие развитию апоптоза. Эти белки как бы напоминают штат нескольких инстанций судебных коллегий. Они могут либо одобрить смертный приговор, либо его отменить или приостановить исполнение. Мы не знаем, в чем конкретно заключается процесс принятия решения, но характер этого решения часто зависит от относительной концентрации определенных белков - регуляторов. Некоторые из этих белков - “ястребы” - обычно “голосуют” за смертный приговор. Другие - “голуби” - за помилование. В ряде случаев решение принимается простым большинством голосов. Апоптоз как средство профилактики Интересно, что часть генов, контролирующих апоптозную реакцию у людей, являются очень древними. Некоторые белки одновременно “присматривают” и за апоптозом, и за делением клетки. Таким образом, системы регуляции клеточного деления и клеточной смерти оказываются тесно переплетенными между собой. Это обстоятельство имеет очень важные биологические последствия. Одно из них заключается в том, что апоптоз - мощное и важнейшее средство естественной профилактики раковых и других злокачественных новообразований. Нарушение физиологического равновесия между делением и гибелью клеток лежит в основе и некоторых других - неопухолевых - заболеваний. В частности, есть основание считать, что при СПИДе (синдроме приобретенного иммунодефицита) уменьшение содержания в крови определенного класса лейкоцитов, играющих важную роль в иммунитете, обусловлено их апоптозной гибелью. Большую роль играет апоптоз и в защите организма от возбудителей инфекционных заболеваний, в частности, от вирусов. Многие вирусы вызывают такие глубокие нарушения в обмене веществ зараженной клетки, что она воспринимает эти нарушения как сигнал к экстренному включению программы гибели. Биологический смысл такой реакции вполне понятен. Смерть зараженной клетки еще до того, как в ней образуется новое поколение вирусных частиц, предотвратит распространение инфекции по организму. Воздействие на программу клеточной гибели - перспективное направление лекарственного лечения. Так, одна из важных задач противораковой терапии - стимуляция апоптозной системы. В других случаях задача врача, наоборот, предотвратить вредное для организма клеточное самоубийство. Следует признать, что наличие такого смертельного механизма - обстоятельство не только необходимое, но в конечном итоге и крайне благоприятное Активность CD4 Т-клеток воспаления Для некоторых бактерий (возбудителей туберкулеза , лепры , чумы ) макрофаги являются "средой обитания". Оказавшись в результате фагоцитоза в фаголизосомах , возбудители становятся защищенными как от антител , так и от цитотоксических T-лимфоцитов . Подавляя активность лизосомальных ферментов, эти бактерии активно размножаются внутри клетки и становятся таким образом причиной острого инфекционного процесса. Неслучайно упомянутые в качестве примера заболевания относят к категории особо опасных инфекций. В этой достаточно сложной ситуации в организме тем не менее имеются силы, препятствующие распространению возбудителей, и связаны они в первую очередь с CD4 Т-клетками воспаления . Участие данного типа лимфоцитов в организации иммунного ответа реализуется через активацию макрофагов. Активированные макрофаги не только справляются с внутриклеточными патогенами, но и приобретают в ряде случаев дополнительные свойства, не связанные с антибактериальным действием, например, способность разрушать раковые клетки . Для активации макрофагов требуется два сигнала. Первый из них - интерферон-гамма (ИФ-гамма) . Это наиболее характерный цитокин , продуцируемый CD4 Т-клетками воспаления. Хелперные T-клетки не секретируют данный цитокин и не могут активировать макрофаги обычным путем. Вторым сигналом для активации макрофагов служит поверхностный ФНО-альфа , который индуцируется к экспрессии после распознавания Т-клетками воспаления иммуногена на мембране макрофагов. Антитела к ФНО-альфа отменяют действие второго сигнала. Цитотоксические T-клетки становятся активными сразу после распознавания антигена, реализуя потенциальную готовность молекулярного аппарата к уничтожению клеток-мишеней через процесс апоптоза или некроза . Напротив, CD4 Т-клетки воспаления после распознавания антигена на поверхности макрофагов тратят часы на синтез de novo медиаторов, активирующих макрофаги. Вновь синтезированные цитокины , собранные в микровезикулы, проникают в макрофаги в месте контакта с Т-клетками. Такой прямой путь, как и в случае с цитотоксическими Т-лимфоцитами, наиболее экономичен и функционально оправдан, поскольку не затрагивает соседние, неинфицированные клетки. В макрофагах, активированных посредством контакта с Т-клетками воспаления и в результате секреции ИФ-гамма, инициируется ряд биохимических изменений, которые обеспечивают данным клеткам сильные антибактериальные свойства ( рис.16). В условиях взаимодействия макрофагов с Т-клетками воспаления наблюдается более эффективное слияние фагосом , захвативших бактерии, с лизосомами - хранителями протеолитических ферментов, разрушающих внутриклеточные патогены. Процесс фагоцитоза сопровождается так называемым кислородным взрывом - образованием кислородных радикалов и окиси азота, обладающих бактерицидной активностью. В условиях костимуляции ФНО-альфа и ИФ-гамма этот процесс идет гораздо активнее. Кроме того, активированные макрофаги усиливают экспрессию молекул II класса МНС и рецептора ФНО-альфа, что приводит к вовлечению дополнительных наивных Т-клеток . Весь этот комплекс событий обеспечивает достаточно прочный заслон от внутриклеточных патогенов. Взаимодействующие с макрофагами Т-клетки воспаления не только способствуют усилению внутримакрофагальных биохимических процессов, но при этом сами активируются и выступают в роли организаторов многостороннего иммунного ответа на антиген. Рис. 16. 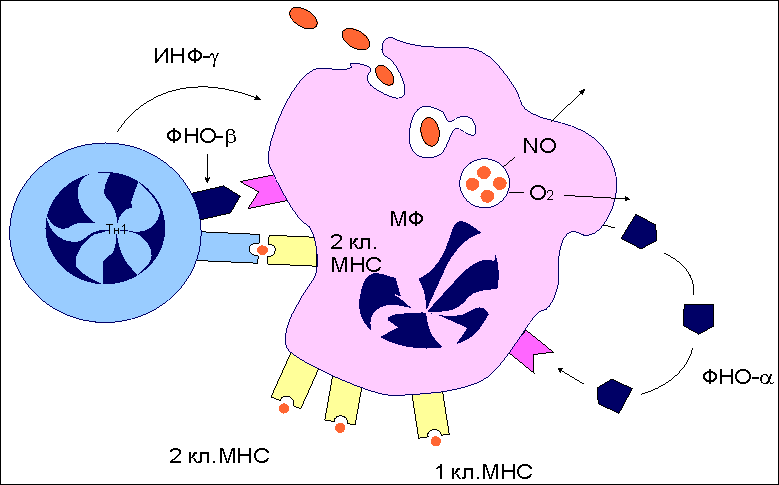 Функциональная активность CD4 Т-клеток воспаления. Основным объектом действия CD4 Т-клеток воспаления являются инфицированные макрофаги. В результате распознавания иммуногенного комплекса на макрофагах CD4 Т-клетки воспаления экспрессируют на своей поверхности фактор некроза опухолей-альфа (ФНО-альфа) и усиливают продукцию интерферона-гамма (ИФ-гамма). Совместное действие цитокинов обеспечивает более эффективное образование фаголизосом, накопление кислородных радикалов и окиси азота, обладающих бактерицидными свойствами, усиление экспрессии молекул II класса МНС, повышение продукции фактора некроза опухолей-альфа. Подобная активизация биохимических процессов в макрофагах не только способствует внутриклеточному уничтожению бактерий, но и определяет дополнительное включение Т-клеток в иммунный ответ. Инфекционный процесс, провоцируемый воспроизводящимися патогенами, отражает борьбу двух сил - собственно возбудителя и иммунной системы хозяина. Например, возбудитель чумы Yersenia pestis обладает способностью к индуцируемому синтезу высокополимеризованного белка I , который начинает экспрессироваться на клеточной стенке при кислом значении рН. Известно, что в месте контакта возбудителя с макрофагом происходит локальное закисление. Это провоцирует синтез и экспрессию белка I. Данный белок, обладая сильными адгезивными свойствами, способствует более эффективному проникновению возбудителя внутрь клетки. Кроме того, это он помогает возбудителю избегать действия лизосомальных ферментов. Кислые условия фаголизосом поддерживают синтез этого защитного для возбудителя белка. Макрофаги , хронически инфицированные внутриклеточными бактериями, могут терять способность активироваться Т-клетками. Массовое включение в процесс новых макрофагов происходит при высвобождении патогенов под влиянием синергического действия на инфицированные клетки ФНО-бета (лимфотоксина) и ИФ-гамма - продуктов активированных CD4 Т-клеток воспаления ( рис.17 ). Рис. 17 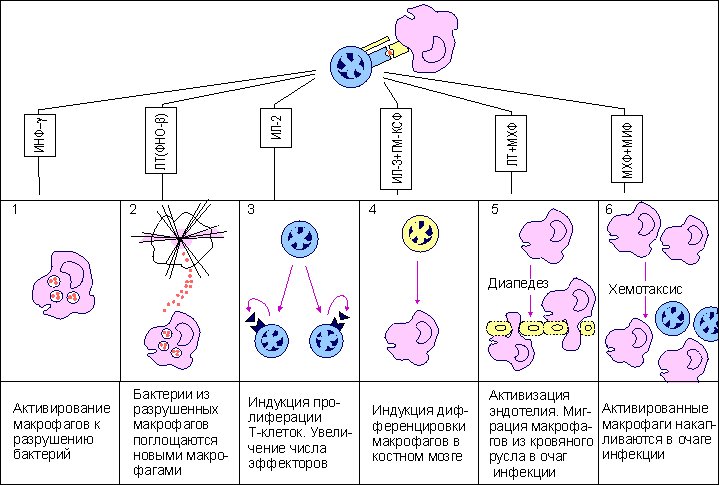 CD4 Т-клетки воспаления, как организаторы комплексного иммунного ответа. CD4 Т-клетки воспаления при взаимодействии с макрофагами не только активируют макрофаги, но и сами активируются. Продуцируя целый набор цитокинов, они тем самым являются организаторами комплексного иммунного процесса. Клетками-мишенями регуляторного действия цитокинов являются макрофаги (1, 2, 5, 6), Т-клетки (3), прекурсоры моноцитарно- макрофагальной линии дифференцировки (4). Сокращения: ИФ-гамма - интерферон-гамма, ЛТ (ФНО-бета) - лимфотоксин (фактор некроза опухолей-бета), ИЛ-2 - интерлейкин-2, ИЛ-3 - интерлейкин-3, ГМ-КСФ - гранулоцитарно-макрофагальный колониестимулирующий фактор, МХФ - макрофагальный хемотаксический фактор (фактор хемотаксиса макрофагов), МИФ - макрофагальный ингибирующий фактор (фактор ингибиции макрофагов). Это сочетание цитокинов также эффективно для гибели фибробластов - основных компонентов соединительной ткани, что обеспечивает проникновение иммунокомпетентных клеток к месту локализации инфекции. Ясно, что в условиях мобилизации иммунного ответа пул эффекторных Т-клеток должен поддерживаться на высоком уровне. Активированные макрофагами Т-клетки воспаления вовлекают дополнительные эффекторы посредством ИЛ-2 , способствующего пролиферации и дифференцировке антигенспецифических Т-клеток. Помимо Т-эффекторов рекрутируются и сами макрофаги. Это реализуется двумя способами: - во-первых, посредством индукции дифференцировки макрофагов в костном мозге под влиянием ИЛ-3 и гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ) ; - во-вторых, вновь образованные макрофаги под влиянием лимфотоксина и макрофагального хемотаксического фактора начинают миграцию из кровяного русла в очаг локализации инфекции, где они и оседают, испытывая на себе действие макрофагингибирующего фактора , снижающего их подвижность. Набор цитокинов , продуцируемых активированными CD4 Т-клетками воспаления после специфического распознавания патогена, обеспечивает многопрофильное развитие клеточного иммунного ответа . Таким образом, клетки рассмотренной субпопуляции выступают в качестве организаторов адекватного иммунного ответа. Заключение. Завершение внутритимусного развития лимфоцитов приводит к созданию двух основных субпопуляций: наивных CD8 T-клеток и CD4 T-клеток . Созданный при этом потенциал клоноспецифических Т-клеток еще не означает их способность моментально вступать в реакцию нейтрализации и уничтожения чужеродного антигена . До проявления эффекторной активности Т-клеток должно произойти главное событие - созревание таких клеток. Только после завершения периода постантигенного развития зрелые Т-клетки реализуют свой первоначальный потенциал. В целом внетимусный период развития клеток включает три этапа: распознавание антигена, созревание наивных Т-клеток до активных эффекторов и собственно "работу" созревших клеток (нейтрализацию и уничтожение антигена). На каждом этапе действуют свои клеточные и молекулярные факторы, при участии которых лимфоциты проходят путь от инертных предшественников до функционально активных эффекторов. Первая встреча наивных Т-клеток с антигеном происходит в лимфоидной ткани, ближайшей к месту его внедрения. Именно здесь происходит отбор Т-клеточных клонов по их способности распознавать чужеродный антиген. Циркулирующие по кровяному руслу лимфоциты, попадая в лимфатические узлы , проходят через высокий эндотелий венул в паренхиму органа. Здесь наивные Т-клетки встречаются с антигеном . В процесс примирования включены три типа антигенпрезентирующих клеток : макрофаги , дендритные клетки , В-лимфоциты . Распознавание антигена на поверхности этих клеток сопровождается включением в процесс дополнительных факторов межклеточных контактных отношений - адгезинов . Функция адгезинов - усиление контакта между наивными Т-лимфоцитами и антигенпрезентирующими клетками. Совместное действие специфического компонента распознавания - Т-клеточного антигенраспознающего рецептора и неспецифического вспомогательного фактора - адгезина LFA-1 Т-клеток определяет отбор антигенспецифического клона. Среди всех лимфоцитов, проникших в определенный лимфоидный орган, только 1 из 105 оказывается способным к специфическому взаимодействию. Все остальные клетки, не выдержавшие отбора на специфичность, покидают лимфоузел через эфферентный лимфатический сосуд с тем, чтобы вступить в процесс рециркуляции в поисках соответствующего по специфичности антигена. Связывание Т-клеточным рецептором комплекса антигенный пептид:молекула I или II класса МНС - обязательное, но недостаточное условие для трансформации наивных Т-клеток в зрелые эффекторы. Необходим второй неспецифический сигнал. Костимуляторами в данном случае выступают экспрессирующиеся на поверхности антигенпрезентирующих клеток молекулы В7 , относящиеся к суперсемейству иммуноглобулинов . Факт происутствия на одной и той же антигенпрезентирующей клетке специфического иммуногена и неспецифического костимулятора имеет вполне конкретный биологический смысл. Отрицательная селекция в тимусе не свободна, очевидно, от ошибок. Какая-то часть запрещенных клонов может выйти в циркуляцию и стать потенциальной причиной аутоиммунной агрессии. Как правило, этого не наблюдается. Наивные Т-лимфоциты, распознавшие аутоантигены, остаются инертными, так как не получают второго сигнала от тканеспецифических клеток. Такие лимфоциты оказываются в состоянии анергии или гибнут через процесс апоптоза . Двухсигнальная система активации обеспечивает синтез и секрецию ИЛ-2 , который включается в процесс пролиферации и дифференцировки Т-клеток. Созревшие Т-клетки характеризуются изменением экспрессии рецепторов клеточной поверхности. Во-первых, они теряют L-селектин , который был нужен наивным Т-клеткам для первоначального заселения лимфоидной ткани, но бесполезен или даже вреден при формировании иммунного ответа, так как мешает миграции Т-клеток в зону проникновения патогена. С помощью тирозинспецифических фосфатаз , характерных для зрелых форм, организуется наиболее эффективная передача сигнала от Т-клеточного антигенраспознающего рецептора внутрь клетки. Появляется новый адгезин VLA-4 , который позволяет зрелым Т-клеткам связываться с эпителием сосудов в зоне воспаления , что крайне важно для локального развития иммунного ответа. Наконец, усиливается экспрессия исходных адгезинов LFA-1 и CD2 , обеспечивающих лучший межклеточный контакт. Постантигенное развитие завершается формированием трех функционально активных субпопуляций: - цитотоксических CD8 T-клеток , - CD4 Т-клеток воспаления и - хелперных CD4 T-клеток . Первые две субпопуляции - участники клеточного иммунного реагирования , третья - обеспечивает помощь гуморальному иммунитету . Распознавание антигена зрелыми цитотоксическими CD8 Т-клетками и переход в эффекторную фазу развития иммунного ответа инициирует синтез и секрецию цитотоксических белков, которые обеспечивают либо некроз , либо апоптоз клеток-мишеней. Наиболее активными медиаторами цитотоксического действия являются перфорин , гранзимы (фрагментины) , ФНО-бета . Возбудители некоторых инфекций ( туберкулез , лепра , чума ) используют макрофаги как "среду обитания". Локализуясь в фаголизосомах , они становятся недоступными для антител или цитотоксических T-лимфоцитов. Единственный способ борьбы с этими внутриклеточными патогенами - усиление лизосомальной активности самих макрофагов. Помощь в стимуляции такой активности исходит от CD4 Т-клеток воспаления (ТН1) , которые после взаимодействия с макрофагами начинают усиленную секрецию ИФ-гамма и ФНО-альфа . В результате этого взаимодействия активизируется также процесс слияния фагосом с лизосомами , инициируется кислородный взрыв , продукты которого токсичны для внутриклеточных патогенов, увеличивается экспрессия молекул II класса MHC , что способствует вовлечению в ответ новых Т-клеток воспаления . Т-клетки воспаления не только активируют внутримакрофагальные биохимические процессы, но и сами оказываются активированными со стороны взаимодействующих с ними фагоцитирующих мононуклеаров . В результате Т-клетки секретируют большой набор цитокинов , выступая в роли организаторов иммунного реагирования. В целом весь путь развития и функционирования Т-клеток от первичного знакомства с антигеном до его уничтожения представляет собой многоступенчатое явление с включением в процесс широкого набора клеточных и молекулярных структур. Список использованной литературы А.Ройт. "Основы иммунологии". 1991. Издание 6-ое. (Оригинал 1988г.) Абелев Г.И. Воспаления. - “Соросовский Образовательный журнал”, 1996г., №10 Абелев Г.И. Основы иммунитета. - “Соросовский Образовательный журнал”, 1996г., №5 Агол В.И. Генетически запрограммированная смерть клеток. - “Соросовский Образовательный журнал”, 1996г, №10, С. 28-32. Галактионов В.Г."Иммунология" из-во МГУ, 1998. Галактионов В.Г."Иммунология": Учебник. – М.; Нива России, 2000.-488с. Галанкин В.Н., Токмаков A.M. (1991) Проблемы воспаления с позиций теории и практики. М., УДН, 120 с. Фрейдлин И.С. Цитокины и межклеточные контакты в противоинфекционной защите организма. - “Соросовский Образовательный журнал”, 1996г, №7, С. 19-25. |
