биология ярыгин. Книга 1 Издание пятое, исправленное и дополненное
 Скачать 7.35 Mb. Скачать 7.35 Mb.
|
3.6.5. Характеристика генотипа как сбалансированной по дозам системы взаимодействующих генов3.6.5.1. Значение сохранения дозового баланса генов в генотипедля формирования нормального фенотипаУ организмов, размножающихся половым путем, генотип формируется в результате слияния геномов двух родительских половых клеток. Он представляет собой двойной набор генов, заключенных в геноме данного вида. Так как при каждом акте оплодотворения взаимодействующие гаметы несут определенные и часто разные аллели генов, генотип каждого отдельного организма представляет собой оригинальный двойной набор аллелей генов. Таким образом, гены, представленные в геноме уникальными нуклеотидными последовательностями, в генотипе присутствуют в двойной дозе. Однако многие гены, особенно у эукариот, в результате амплификации присутствуют в геноме в виде нескольких копий (гены гистонов, тРНК, рРНК). Они занимают разное место в геноме, но определяют возможность развития одного и того же признака. Такие нуклеотидные последовательности присутствуют в генотипе в виде многих двойных доз. Наконец, так как геномы гамет разного пола отличаются друг от друга по набору генов, заключенных в половых хромосомах, в генотипе встречаются гены, представленные лишь одной дозой. Например, у некоторых видов два пола имеют разное число гетерохромосом — XX или ХО. Следовательно, генотипы особей гетерогаметного пола ХО содержат гены Х-хромосомы не в двойной, а в единственной дозе.. Чаще два пола различаются по набору гетерохромосом XX или XY. Ввиду того что морфология этих хромосом различна и одна из них часто крупнее, многие гены имеются лишь в одной гетерохромосоме и отсутствуют или неактивны в другой. В результате в генотипе особей гетерогаметного пола XY гены, расположенные в негомологичных участках Х- и Y-хромосом, встречаются в одной дозе. 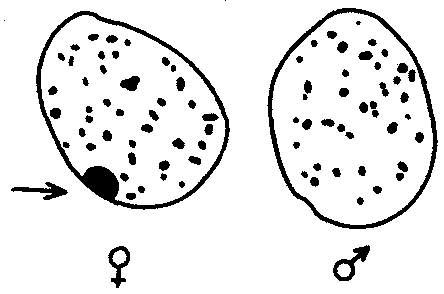 Рис. 3.77. Наличие и отсутствие полового хроматина в ядрах клеток слизистой рта женщины (♀) и мужчины (♂) У женщин половой хроматин (тельце Барра) имеет вид темного тельца (отмечено стрелкой), располагающегося у оболочки ядра Таким образом, сформировавшийся в процессе эволюции геном каждого отдельного вида представляет собой совокупность генетических единиц, представленных в нем в строго определенных дозах. В результате и генотипы особей и их клеток — сбалансированные по дозам генов системы. Значение поддержания определенного дозового соотношения генов в генотипе для формирования видовых характеристик подтверждается возникшим в процессе эволюции механизмом инактивации одной из Х-хромосом у гомогаметного пола XX. Это приводит дозу активно функционирующих Х-генов у данного пола в соответствие с их дозой у гетерогаметного пола ХО или XY. У млекопитающих гомогаметным является женский пол XX, а гетерогаметным —мужской XY. У мышей такая инактивация происходит на 3—6-е сутки эмбрионального развития. У человека на 16-е сутки во всех клетках женского эмбриона одна из Х-хромосом образует тельце полового хроматина (тельце Барра), которое может быть обнаружено вблизи ядерной мембраны интерфазных клеток в виде хорошо окрашивающегося гетерохроматинового образования (рис. 3.77). Ввиду того что гены, расположенные в инактивированной Х-хромосоме, не функционируют, в генотипе каждой клетки организма гомогаметного пола в диплоидном наборе остальных генов экспрессируется лишь одна доза Х-генов. Так как инактивация Х-хромосомы происходит, когда организм уже представляет собой многоклеточное образование и выключаться может любая из двух Х-хромосом, клетки такого организма образуют мозаику, в которой экспрессируются разные аллели Х-генов (рис. 3.78, 3.79). 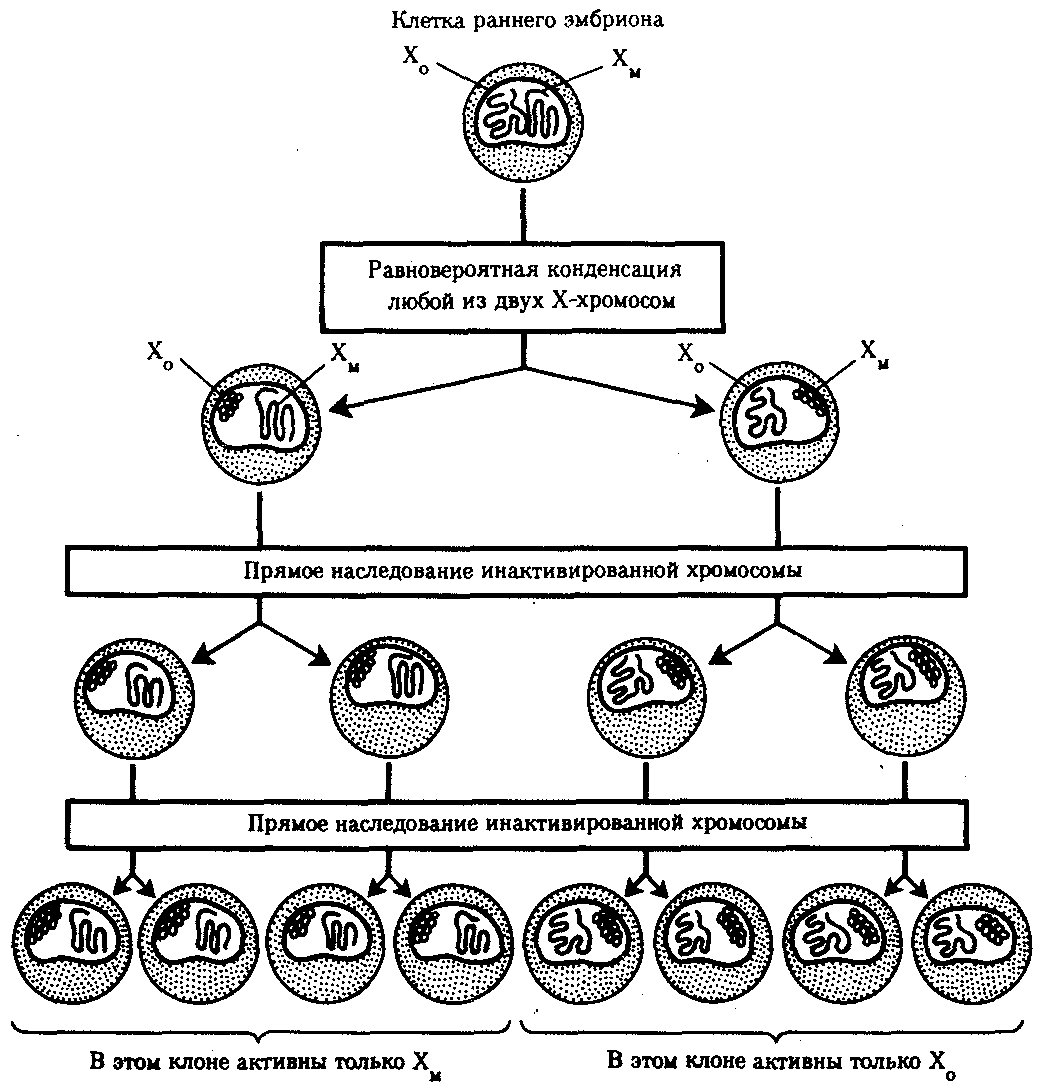 Рис. 3.78. Клональное наследование инакгивированной Х-хромосомы в клетках женского организма: ХМ, ХО — материнская и отцовская Х-хромосомы Феномен инактивации хромосомы Х в клетках женского организма на самом деде является более тонким фактором регуляции соотношения доз определенных генов, требуемого для воспроизведения нормального фенотипа. Так, процесс сперматогенеза блокируется, если на известной его стадии в клетках гаметогенной линии не инактивируется единственная (!) в мужском кариотипе хромосома X. Об этом свидетельствует бесплодие лиц мужского пола с синдромом Дауна (трисомия по хромосоме 21). В данном случае, как предполагают, требуемой инактивации препятствует конъюгация «лишней» хромосомы 21 с комплексом X-Y в пахитене профазы I мейоза. С другой стороны, при синдроме Шерешевского—Тернера (кариотип 46, Х0, фенотип женского типа) больные бесплодны вследствие дегенерации тканей яичников. Считают, что нормальное развитие яйцеклеток требует на определенной стадии овогенеза активности генов обеих хромосом X. Нарушение дозовой сбалансированности генотипа организма (клетки) сопровождается, как правило, различными отклонениями в развитии. Примером служат нарушения развития организма при хромосомных перестройках, когда доза генов изменяется в результате отрыва и утраты или перемещения фрагмента хромосомы, а также при изменении количества хромосом в кариотипе (анэуплоидия или полиплоидия) (см. 4.2.2.). Таким образом, неблагоприятные последствия хромосомных и геномных мутаций обусловлены в первую очередь нарушением дозовой сбалансированности генов в генотипе. 3.6.5.2. Взаимодействия между генами в генотипеОтрицательные последствия нарушения дозового баланса связаны с тем, что генотип представляет собой не простую сумму отдельных генов. Гены в генотипе объединены в систему благодаря сложным и разнообразным взаимодействиям между ними, которые играют немаловажную роль в реализации информации, заключенной в каждом отдельном гене. Взаимодействие аллельных генов. Постоянно возникающие разнообразные изменения структуры генов обусловливают явление множественного аллелизма (см. разд. 3.4.2.4), поэтому взаимодействующие при оплодотворении гаметы часто несут в своих геномах разные аллели одного и того же гена. В связи с этим генотип нового организма является гетерозиготным по многим локусам, т.е. его аллельные гены, расположенные в соответствующих участках гомологичных хромосом и пришедшие от обоих родителей, представлены разными аллелями — А и А', В и В' С и С' и т.д. Если аллельные гены представлены одинаковыми аллелями, т.е. находятся в гомозиготном состоянии (АА или A'A', BB или B'B', CC или С'С'), то развивается соответствующий данному аллелю вариант признака. В случае гетерозиготности (АА', BB', CC') развитие данного признака (А, В или С) будет зависеть от взаимодействия аллельных генов. Доминирование — это такое взаимодействие аллельных генов, при котором проявление одного из аллелей (А) не зависит от присутствия в генотипе другого аллеля (А') и гетерозиготы АА' фенотипически не отличаются от гомозигот по этому аллелю (АА). Такая ситуация наблюдается, например, когда один из аллелей гена А («дикий») способен обеспечить формирование определенного варианта признака (синтез пептида с определенными свойствами), а другой А'—не обладает такой способностью. Наличие в генотипе АА' единственного нормального аллеля А приводит к формированию нормального признака. Этот аллель выступает как доминантный в данном гетерозиготном генотипе. Присутствие другого аллеля (А') фенотипически не проявляется, поэтому его называют рецессивным. Примером доминирования одного из алледей в гетерозиготном генотипе может служить определение групповой принадлежности крови у человека по системе АВ0. Генотипы, содержащие аллель IA либо в гомозиготном состоянии, либо в сочетании с аллелем I0 (IAIA или IAI0), определяют развитие у человека второй группы крови (группа крови А). Такая же ситуация наблюдается и в отношении аллеля IB, обусловливающего формирование третьей, или В-группы крови. Следовательно, аллели IA и IB выступают как доминантные по отношению к аллелю I0, формирующему в гомозиготном состоянии I0I0 первую, или 0-группу крови. Неполное доминирование наблюдается, когда фенотип гетерозигот BB' отличается от фенотипа гомозигот по обоим аллелям (BB или B'B') промежуточным проявлением признака. Это объясняется тем, что аллель, способный сформировать нормальный признак, находясь в двойной дозе у гомозиготы BB, проявляется сильнее, чем в единственной дозе у гетерозиготы BB'. Указанные генотипы отличаются экспрессивностью, т.е. степенью выраженности признака. Демонстрацией такого типа взаимодействия генов могут быть многочисленные наследственные заболевания у человека, проявляющиеся клинически у гетерозигот по мутантным аллелям, а у гомозигот заканчивающиеся смертью. Иногда гетерозиготы имеют почти нормальный фенотип, а гомозиготы характеризуются пониженной жизнеспособностью. Так, гомозиготы по аллелю серповидноклеточности эритроцитов в связи с развитием у них тяжелой формы анемии и других фенотипических проявлений (см. рис. 3.21) обычно не переживают детский возраст. Напротив, гетерозиготы — это как правило нормальные люди. Вместе с тем, они все-таки испытывают кислородную недостаточность в большей степени в сравнении с гомозиготами по аллелю дикого типа, в частности при подъеме на высоту (см. 4.1). Кодоминирование представляет собой такой тип взаимодействия аллельных генов, при котором каждый из аллелей проявляет свое действие. В результате этого формируется некий промежуточный вариант признака, новый по сравнению с вариантами, определяемыми каждым аллелем самостоятельно. Примером может служить формирование IV, или АВ-группы, крови у человека, гетерозиготного по аллелям IA и IB, которые по отдельности детерминируют образование II и III групп крови. Межаллельная комплементация относится к достаточно редко встречаемым способам взаимодействия аллельных генов. В этом случае возможно формирование нормального признака D у организма, гетерозиготного по двум мутантным аллелям гена D(D'D"). Допустим, что ген D отвечает за синтез какого-то белка, который имеет четвертичную структуру, состоящую из нескольких одинаковых пептидных цепей. Мутантный аллель D' определяет синтез измененного пептида D', a мутантный аллель D" приводит к синтезу другой, но тоже измененной структуры пептида D". Можно представить ситуацию, когда взаимодействие таких измененных пептидов (D' и D") при формировании четвертичной структуры, как бы взаимно компенсируя эти изменения, обеспечивает образование белка с нормальными свойствами. В то же время отдельно взаимодействующие пептиды D' или D" формируют аномальные белки. Таким образом, с определенной вероятностью у гетерозигот D'D" в результате межаллельной комплементации может образовываться нормальный признак в виде белка с нормальными свойствами. Аллельное исключение—такой вид взаимодействия аллельных генов в генотипе организма, который можно понять на примере рассмотренного выше механизма инактивации одной из Х-хромосом у особей гомогаметного пола, приводящего в соответствие дозы Х-генов у всех представителей вида. Инактива-ция одного из аллелей в составе Х-хромосомы способствует тому, что в разных клетках организма, мозаичных по функционирующей хромосоме, фенотипически проявляются разные аллели (рис. 3.79). Аллельное исключение наблюдается также в В-лимфоцитах, синтезирующих специфичные антитела к определенным антигенам. Моноспецифичность таких иммуноглобулинов требует выбора, который должна осуществить каждая клетка между экспрессией отцовского или материнского аллеля. 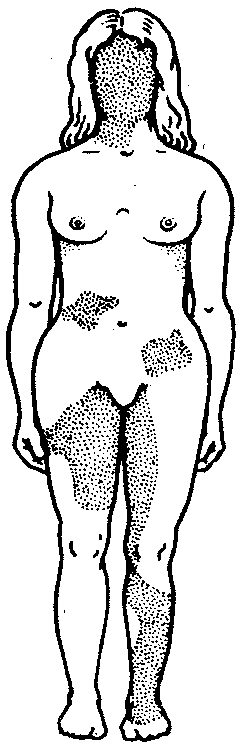 Рис. 3.79. Мозаицизм женского организма по наличию или отсутствию нормальных потовых желез в коже, обусловленный экспрессией нормального или мутантного аллелей гена Х-хромосомы Затемнены участки кожи, лишенные потовых желез, в клетках которых экспрессируется мутантный аллель Таким образом, даже процесс формирования элементарного признака — синтез полипептида с определенной последовательностью аминокислот — зависит, как правило, от взаимодействия по меньшей мере двух аллельных генов, и конечный результат определяется конкретным сочетанием их в генотипе. Формирование сложных признаков предполагает необходимость взаимодействия неаллельных генов, занимающих разное положение в геноме данного вида. Взаимодействие неаллельных генов. Большинство признаков и свойств организма, по которым он отличается от других представителей вида, являются результатом действия не одной пары аллельных генов, а нескольких неаллельных генов или их продуктов. Поэтому эти признаки называют сложными. Сложным признаком может быть четвертичная структура белка, образуемая разными пептидными цепями, которые детерминируются разными (неаллельными) генами. Например, молекула гемоглобина, содержит две о,- и две (3-цепи, гены которых расположены у человека в 16-й и 11-й хромосомах (см. разд. 3.6.4.3). Сложный признак может быть обусловлен совместным однозначным действием нескольких генов или являться конечным результатом цепи биохимических преобразований, в которых принимают участие продукты многих генов. Наконец, на формирование как простых, так и сложных признаков определенные регуляторные воздействия оказывают другие локусы. В зависимости от характера участия неаллельных генов в формировании того или иного признака различают несколько видов их взаимодействия. Большинство количественных признаков организмов определяется полигенами, т.е. системой неаллельных генов, одинаково влияющих на формирование данного признака. Взаимодействие таких генов в процессе формирования признака называют полимерным. Оно сводится чаще всего к суммированию действия сходных аллелей этих генов, определяющих формирование одинакового варианта признака. Совместное действие полигенов обусловливает различную экспрессивность — степень выраженности признака, зависящую от дозы соответствующих аллелей. В основе появления в геноме таких генов, очевидно, лежит их дупликация или амплификация (см. разд. 3.6.4.3). Это позволяет увеличить синтез соответствующего продукта в клетках организма. По полимерному типу взаимодействия у человека определяется интенсивность окраски кожных покровов, зависящая от уровня отложения в клетках пигмента меланина. В геноме человека имеется четыре гена, отвечающих за этот признак. В генотипе все они представлены в двойной дозе. В связи с тем что эти гены отвечают за развитие одного и того же признака, их обозначают одной и той же буквой, но с разными символами, чтобы подчеркнуть их неаллельность — P1P2P3P4. Наличие в генотипе восьми доминантных аллелей в системе полигенов, определяющих цвет кожи, обусловливает максимальную ее пигментацию, наблюдаемую у африканских негров (P1P1P2P2P3P3P4P4). Полное отсутствие доминантных аллелей у. рецессивных гомозигот (р1р2р2р3р3р4р4) проявляется в виде минимальной пигментации у европеоидов. Большее или меньшее количество доминантных аллелей, колеблющееся от 8 до 0, обеспечивает разную интенсивность окраски кожи (рис. 3.80). Полимерное взаимодействие генов лежит в основе определения главным образом количественных признаков (рост, масса организма, возможно, интеллект). 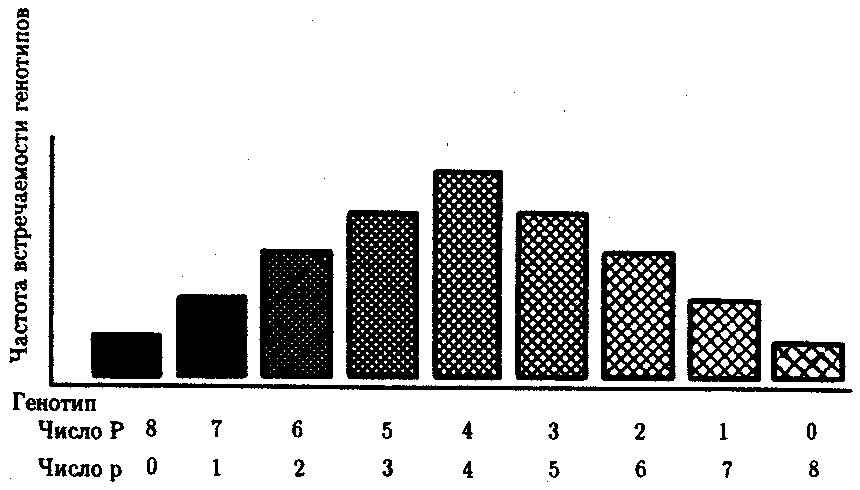 Рис. 3.80. Зависимость интенсивности пигментации кожи у человека от количества доминантных аллелей в системе полигенов (Р) в генотипе Остальные пояснения см. в тексте Большинство сложных признаков, являясь результатом целой цепи биохимических и структурных преобразований, требует участия многих генов, влияющих на разные звенья этого процесса. Отсутствие нормального первичного продукта, хотя бы одного из них, не позволяет сформировать нормальный сложный признак. Так как часто нормальный первичный продукт гена является результатом экспрессии его доминантного аллеля, сложный признак формируется при наличии в генотипе доминантных аллелей всех взаимодействующих генов. Такое взаимодействие неаллельных генов, при котором они взаимно дополняют друг друга, называют комплементарным взаимодействием. В качестве примера комплементарного взаимодействия неаллельных генов можно рассмотреть процесс формирования половой принадлежности организма у человека. Развитие признаков пола у человека, так же как у большинства животных, определяется в первую очередь сочетанием гетерохромосом в его кариотипе. Наличие Х- и Y-хромосом обусловливает возможность формирования мужского пола, а двух Х-хромосом —женского. Однако установлено, что для развития организма мужского пола не достаточно присутствия одного лишь Y-сцепленного гена, который определяет дифференцировку половых желез по мужскому типу и синтез ими гормона тестостерона. Для этого необходим также продукт другого гена — белок-рецептор, обеспечивающий проникновение гормона в клетки тканей-мишеней. За синтез такого белка отвечает особый ген, расположенный в Х-хромосоме. Его мутация, нарушающая образование нормального белка-рецептора, делает ткани-мишени невосприимчивыми к гормону, направляющему их развитие по мужскому типу. Не использовав такую возможность на определенном этапе онтогенеза, организм осуществляет развитие по женскому типу. В результате появляется особь с кариотипом XY, но внешне более сходная с женщиной. Такие субъекты не способны иметь потомство, так как их половые железы (семенники) недоразвиты, а их выводные протоки часто формируются по женскому типу (недоразвитая матка, влагалище). Вторичные половые признаки также характерны для женского пола. Описанная картина известна у человека как тестикулярная феминизация, или синдром Морриса (рис. 3.81). 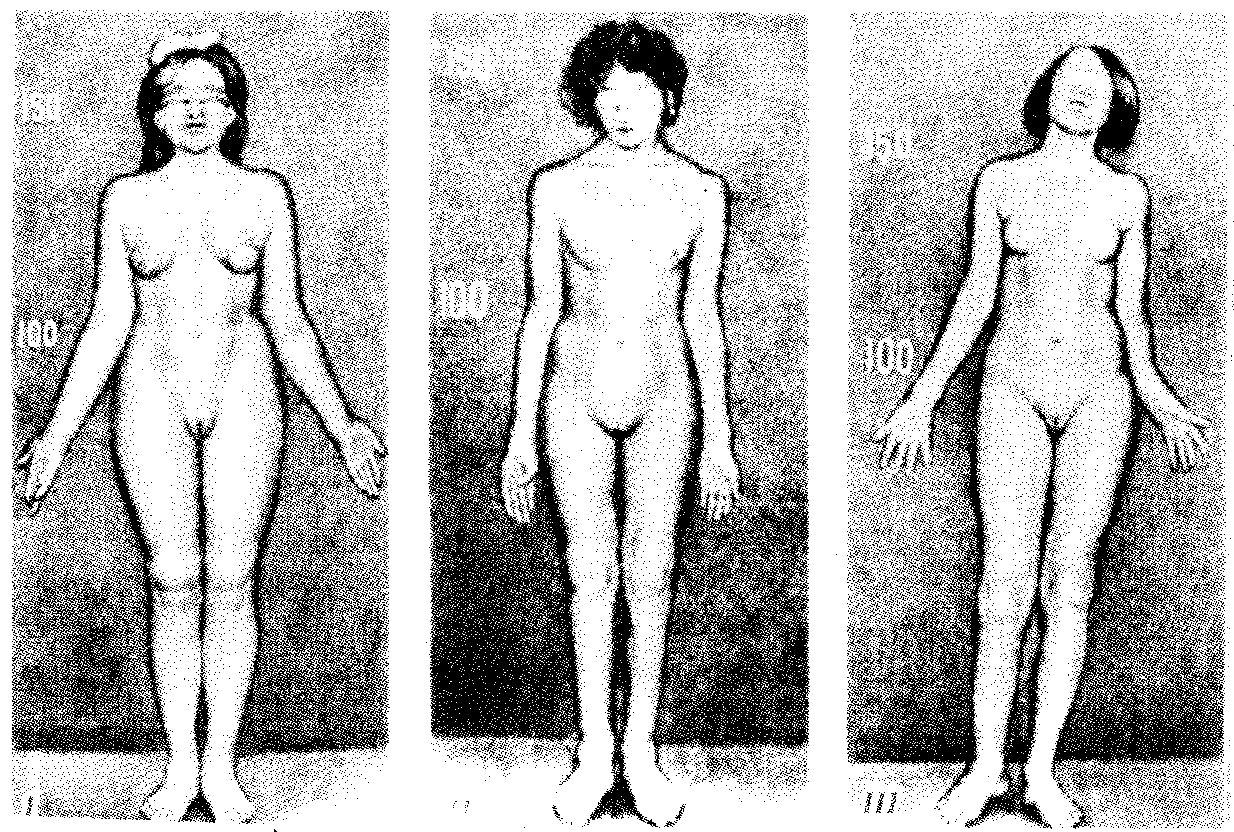 Рис. 3.81. Тестикулярная феминизация —синдром Морриса: I — кариотип XY (удаление семенников в детском возрасте); II — евнухоидная форма, кариотип XY (отсутствие молочных желез, вторичного оволосения, естественного влагалища); III — кариотип XY Таким образом, достижение конечного результата при формировании у человека признаков мужского пола является следствием взаимодополняющего действия нескольких (по меньшей мере двух) генов, определяющих возможность синтеза мужского полового гормона и белка-рецептора. Другим примером взаимодействия неаллельных генов служит формирование у человека групповой принадлежности крови по системе АВО. Выше этот признак рассматривался с точки зрения взаимодействия аллельных генов. Отвечающий за формирование данного признака ген I обеспечивает синтез антигенов А и В, фиксирующихся на поверхности эритроцитов. Однако для синтеза антигенов А и В необходимо образование неспецифического вещества-предшественника, которое детерминируется геном Н, находящимся в доминантном состоянии. У гомозигот по рецессивному аллелю hh даже при наличии в генотипе доминантных аллелей гена ^ или Iй антигены А и В не синтезируются и фенотипически эти люди имеют I группу крови. 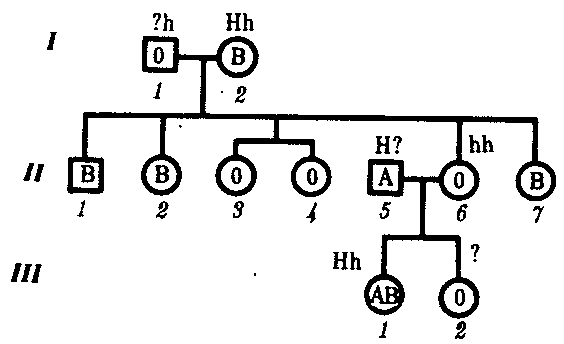 Рис. 3.82. Родословная, иллюстрирующая наследование группы крови по системе АВО при бомбейском феномене Женщина II.6 с группой крови 0(1) имеет ребенка III.1 с группой крови АВ (ГУ); вероятно, в ее геноме имеется аллель Iе, полученный ею от матери (1.2), но не проявившийся в связи с ее гомозиготностыо по рецессивному аллелю hh. Бомбейский фенотип встречается с частотой 1:13000 среди индусов, живущих в окрестностях Бомбея Такая ситуация характерна для бомбейского феномена, описанного впервые в семье, где у женщины I группы крови родился ребенок с IV группой крови. Очевидно, ее фенотип был обусловлен непроявлением имеющегося в генотипе аллеля IВ, что связано с гомозиготностью матери по рецессивному аллелю hh (рис. 3.82). Вероятно с этих же позиций можно рассматривать и случаи альбинизма у человека, когда даже у африканских негров, которые обладают максимумом доминантных аллелей в системе полигенов, определяющих пигментацию кожи, появляются альбиносы с полным отсутствием пигмента в клетках кожи, радужке глаз, волосах (рис. 3.83). Альбинизм связывают с гомозиготностыо генотипа по рецессивному аллелю гена, не относящегося к полигенам пигментации. Возможно, его доминантный аллель определяет синтез продукта, принимающего участие в процессах, предшествующих синтезу пигмента. В таком случае здесь также имеет место взаимодополняющее действие соответствующих аллелей разных генов. В некоторых случаях при взаимодействии неаллельных генов для развития сложного признака необходимо обязательное присутствие одного из генов (А) в гомозиготном рецессивном состоянии (аа), тогда другой ген (В) обеспечивает формирование признака. Наличие в генотипе доминантного аллеля гена А каким-то образом препятствует проявлению гена В(b), и признак не формируется. Такое взаимодействие неаллельных генов принято называть эпистатическим,  Рис. 3.83. Пример рождения альбиноса у негритянки (отсутствие пигментации кожи у ребенка может быть результатом рецессивного эпистаза) Примером эпистатического взаимодействия генов может быть подавление у многих видов развития окраски покровов, определяемое одним из генов, при наличии в генотипе другого гена в доминантном состоянии. Так, у тыквы развитие окраски плодов определяется геном В. Доминантный его аллель детерминирует желтую, а рецессивный — зеленую окраску. Однако окраска не развивается вообще, если в генотипе имеется неаллельный ген А в доминантном состоянии. У кур породы леггорн белое оперение является результатом эпистатического воздействия доминантного аллеля одного гена на проявление неаллельного ему гена, отвечающего за пигментацию оперения. Отсутствие необходимых данных о роли первичных продуктов многих генов в формировании сложных признаков часто не позволяет точно установить характер взаимодействия неаллельных локусов, участвующих в биохимических процессах и составляющих основу образования этих признаков. В одних случаях развитие признака при наличии двух неаллельных генов в доминантном состоянии рассматривают как комплементарное взаимодействие, в других — неразвитие признака, определяемого одним из генов при отсутствии другого гена в доминантном состоянии, расценивают как рецессивный эпистаз; если же признак развивается при отсутствии доминантного аллеля неаллельного гена, а в его присутствии не развивается, говорят о доминантном эпистазе. Вероятно, само разделение взаимодействия генов на комплементарное и эпистатическое несколько искусственно, ибо во всех этих случаях сложный признак является результатом сочетания в генотипе определенных аллелей соответствующих генов, которые обеспечивают синтез продуктов, участвующих в цепи биохимических преобразований на разных уровнях формирования сложного признака. Так как при определенных сочетаниях аллелей неаллельных генов становится невозможным фенотипическое проявление доминантных аллелей некоторых из них, нередко наблюдается неполная пенетрантность доминантных аллелей — они проявляются не у всех носителей. Так, аллели IA и IB, определяющие групповую принадлежность крови по системе АВО, не проявляются фенотипически в отсутствие доминантного аллеля гена Н (бомбейский феномен). У альбиносов (аа) не проявляются доминантные аллели полигенов пигментации кожных покровов (Р1Р2Р3Р4). У тыквы не развивается окраска плодов, а у кур породы леггорн — пестрая окраска оперения, контролируемые доминантными аллелями соответствующих генов, при наличии в их генотипе определенных неаллельных генов в доминантном состоянии. Особый вид представляет взаимодействие, обусловленное местом положения гена в системе генотипа,— эффект положения. Непосредственное окружение, в котором находится ген, может сказываться на характере его экспрессии. Изменение активности гена, наблюдаемое при хромосомных перестройках, нередко связано с перемещением его в другую группу сцепления при транслокациях или изменением его положения в своей хромосоме при инверсиях. Особый случай, очевидно, представляет изменение экспрессии генов в результате деятельности подвижных генетических элементов, активирующих или угнетающих проявление генов, вблизи которых они встраиваются. Наконец, большое значение в объединении генов в единую систему генотипа имеют регуляторные взаимодействия, обеспечивающие регуляцию генной активности. Продукты генов-регуляторов — белки-регуляторы — обладают способностью узнавать определенные последовательности ДНК, соединяться с ними, обеспечивая, таким образом, транскрибирование информации со структурных генов или препятствуя транскрипции (см. разд. 3.6.6). 3.6.6. Регуляция экспрессии генов на геномном уровне организации наследственного материалаРеализация наследственной информации, заключенной в генотипе организма,— это сложный процесс, который требует тонкой регуляции для того, чтобы в клетках разной тканевой принадлежности в определенное время в процессе развития организма обеспечить синтез специфических белков в необходимом количестве. Все клетки многоклеточного организма, возникая из зиготы путем митоза, получают полноценный набор генетической информации. Несмотря на это, они отличаются друг от друга по морфологии, биохимическим и функциональным свойствам. В основе этих различий лежит активное функционирование в разных клетках неодинаковых частей генома. Большая часть генома находится в клетках организма в неактивном, репрессированном, состоянии, и только 7—10% генов дерепрессированы, т.е. активно транскрибируются. Спектр функционирующих генов зависит от тканевой принадлежности клетки, от периода ее жизненного цикла и стадии индивидуального развития организма. Основная масса генов, активно функционирующих в большинстве клеток организма на протяжении онтогенеза, — это гены, которые обеспечивают синтез белков общего назначения (белки рибосом, гистоны, тубулины и т.д.), тРНК и рРНК. Транскрибирование этих генов обеспечивается соединением РНК-полимеразы с их промоторами и, видимо, не подчиняется каким-либо другим регулирующим воздействиям. Такие гены называют конститутивными. Другая группа генов, детерминирующих синтез специфических продуктов, в своем функционировании зависит от различных регулирующих факторов, ее называют регулируемыми генами (рис. 3.84). Их активное функционирование, скорость и продолжительность транскрипции регулируются путем стимуляции или запрещения соединения РНК-полимеразы с промоторной областью гена. 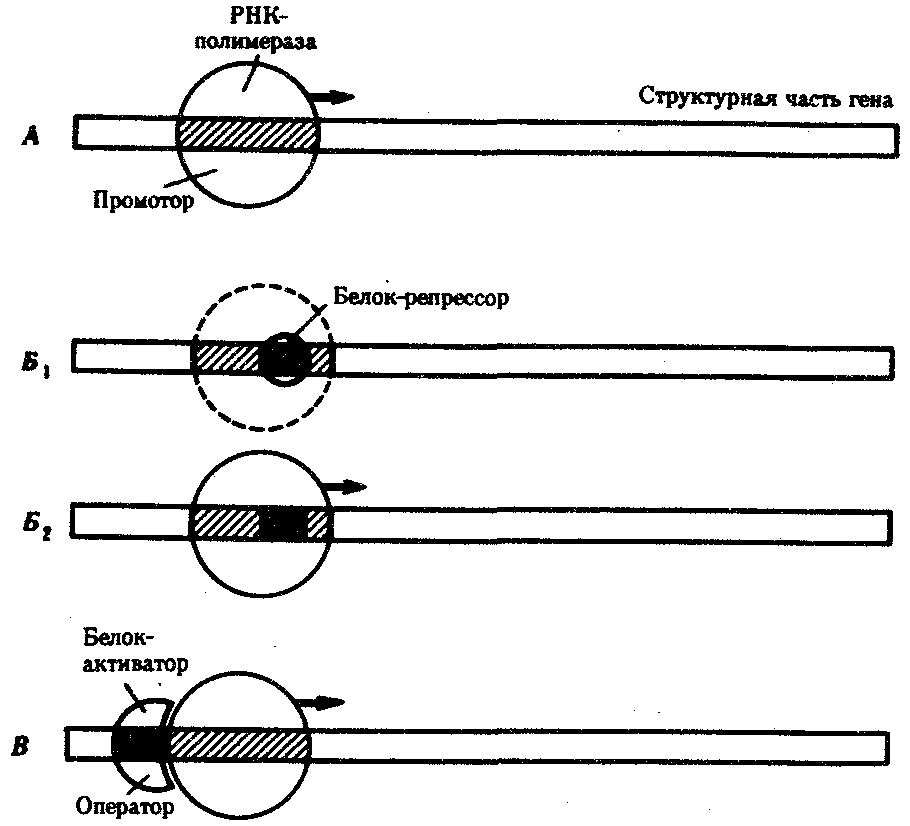 Рис. 3.84. Схема конститутивных и регулируемых генов: А — конститутивный ген; Б, В — регулируемые гены; Б1Б2 —связывание РНК-полимеразы с промотором возможно лишь в отсутствие белка-репрессора, который специфически соединяется с оператором, частично или полностью перекрывающим промоторную последовательность; В — связывание РНК-полимеразы с промотором облегчается белком-активатором (апоиндуктором), который специфически узнает область оператора, расположенную перед промотором; стрелкой обозначено направление транскрипции 3.6.6.1. Общие принципы генетического контроля экспрессии геновВажнейшим фактором регуляции генной активности являются элементы генома, отвечающие за синтез регуляторных белков,— гены-регуляторы. Соединяясь с определенными нуклеотидными последовательностями ДНК, предшествующими структурной части регулируемого гена,—операторами, белки-регуляторы способствуют или препятствуют соединению РНК-полимеразы с промотором. Если белок-регулятор взаимодействует с оператором, занимающим часть промотора или расположенным между ним и структурной частью гена, то это не дает возможности РНК-полимеразе соединиться с промоторной последовательностью и осуществить транскрипцию. Такой белок называют репрессором, и в этом случае осуществляется негативный контроль экспрессии гена со стороны гена-регулятора (рис. 3.85). Если промотор обладает слабой способностью соединяться с РНК-полимеразой, а ему предшествует область, узнаваемая белком-регулятором, присоединение последнего непосредственно перед промотором к молекуле ДНК облегчает связывание РНК-полимеразы с промотором, вслед за чем следует транскрипция. Такие белки называют активаторами (или апоиндукторами), а контроль экспрессии гена со стороны гена-регулятора — позитивным (рис. 3.85). 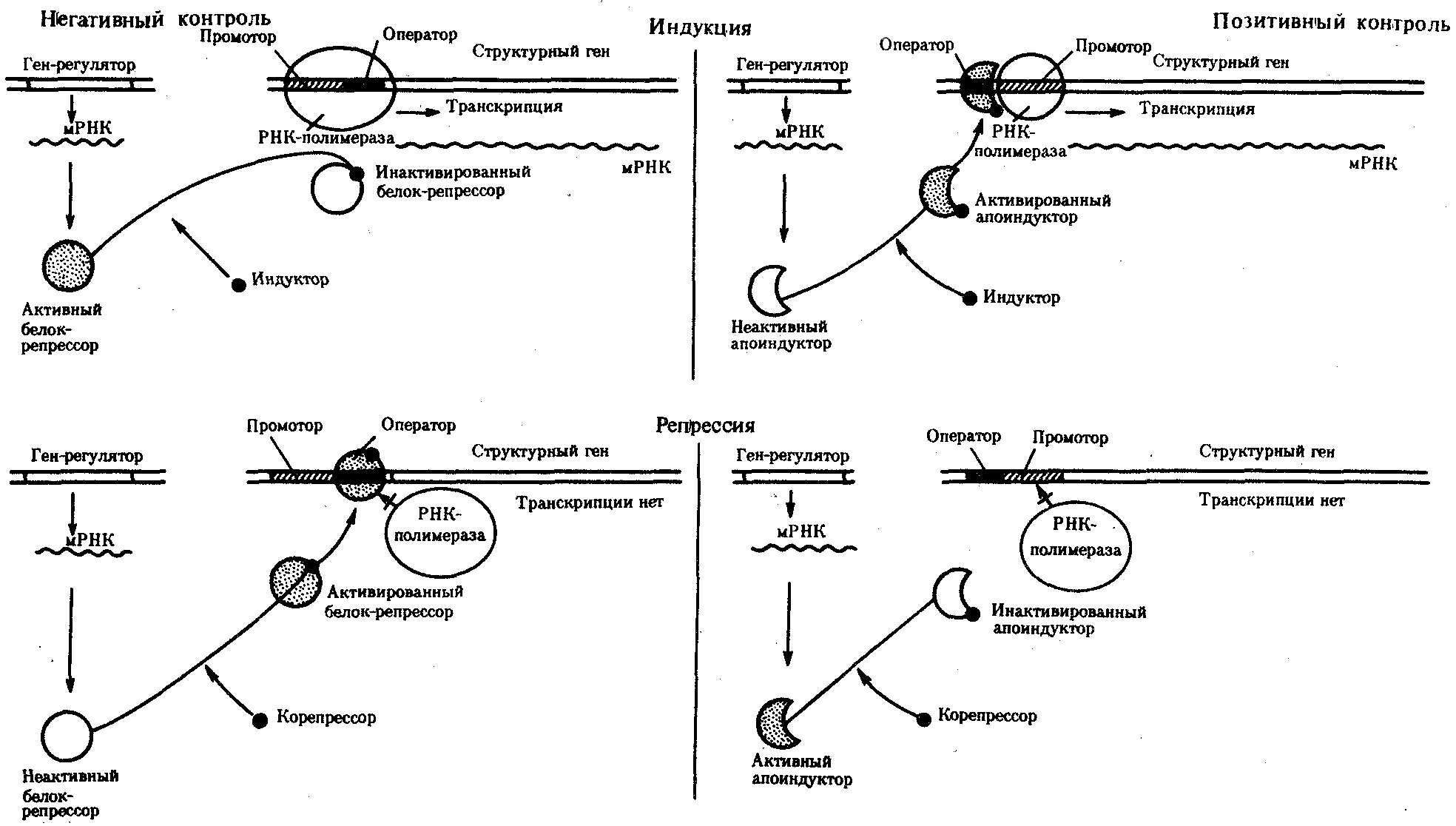 Рис. 3.85. Негативный и позитивный контроль экспрессии генов и участие эффекторов в регуляции генной активности 3.6.6.2. Роль негенетических факторовв регуляции генной активностиНаряду с генетическими факторами в регуляции экспрессии генов на стадии транскрипции принимают участие негенетические факторы — эффекторы. К ним относят вещества небелковой природы, взаимодействующие с белками-регуляторами и изменяющие их способность соединяться с нуклеотидными последовательностями операторов. В зависимости от результатов такого взаимодействия среди эффекторов различают индукторы, запускающие транскрипцию, и корепрессоры, препятствующие ей. Индукторы могут инактивировать белки-репрессоры, которые перестают соединяться с операторами, или повышать способность белков-активаторов (апоиндукторов) к связыванию с ними, что облегчает соединение РНК-полимеразы с промотором. В результате такого воздействия на регуляторные белки регулируемые гены активно транскрибируются. Корепрессоры могут модифицировать апоиндукторы, теряющие при этом способность соединяться с операторами, или активировать репрессоры, находящиеся в неактивном состоянии. Следствием такого взаимодействия эффектора с белками-регуляторами является невозможность соединения РНК-полимеразы с промотором и отсутствие транскрипции. 3.6.6.3. Регуляция экспрессии генов у прокариотИзучение регуляции генной активности у прокариот привело французских микробиологов Ф. Жакоба и Ж. Моно к созданию (1961) оперонной модели регуляции транскрипции. Оперон — это тесно связанная последовательность структурных генов, определяющих синтез группы белков, которые участвуют в одной цепи биохимических преобразований. Например, это могут быть гены, которые детерминируют синтез ферментов, участвующих в метаболизме какого-либо вещества или в синтезе какого-то компонента клетки. Оперонная модель регуляции экспрессии генов предполагает наличие единой системы регуляции у таких объединенных в один оперон структурных генов, имеющих общий промотор и оператор. Особенностью прокариот является транскрибирование мРНК со всех структурных генов оперона в виде одного полицистронного транскрипта, с которого в дальнейшем синтезируются отдельные пептиды. Примером участия генетических и негенетических факторов в регуляции экспрессии генов у прокариот может служить функционирование лактозного оперона у кишечной палочки Е. colt (рис. 3.86). При отсутствии в среде, на которой выращиваются бактерии, сахара лактозы активный белок-репрессор, синтезируемый геном-регулятором (I), взаимодействует с оператором (О), препятствуя соединению РНК-полимеразы с промотором (Р) и транскрипции структурных генов Z, Y, А. Появление в среде лактозы инактивирует репрессор, он не соединяется с оператором, РНК-полимераза взаимодействует с промотором и осуществляет транскрипцию полицистронной мРНК. Последняя обеспечивает синтез сразу всех ферментов, участвующих в метаболизме лактозы. Уменьшение содержания лактозы в результате ее ферментативного расщепления приводит к восстановлению способности репрессора соединяться с оператором и прекращению транскрипции генов Z, Y, А. Таким образом, регуляция экспрессии генов, организованных у прокариот в опероны, является координированной. Синтез полицистронной мРНК обеспечивает одинаковый уровень синтеза всех ферментов, участвующих в биохимическом процессе.  Рис. 3.86. Лактозный оперон Е. Соli Включение loc-оперона с помощью индуктора — лактозы; объяснение см. в тексте 3.6.6.4. Регуляция экспрессии генов у эукариотВ связи с особенностями организации отдельных генов эукариот и генома в целом регуляция генной активности у них характеризуется некоторыми отличиями по сравнению с прокариотами. У эукариот не установлено оперонной организации генов. Гены, определяющие синтез ферментов одной цепи биохимических реакций, могут быть рассеяны в геноме и, очевидно, не имеют, как у прокариот, единой регулирующей системы (ген-регулятор, оператор, промотор). В связи с этим синтезируемые мРНК у эукариот моноцистронны, т.е. являются матрицами для отдельных пептидных цепей. В настоящее время механизмы регуляции и координации активности эукариотических генов интенсивно изучаются. Установлено, что их функционирование несомненно подчиняется регуляторным воздействиям, однако регуляция транскрипции у эукариот является комбинационной, т.е. активность каждого гена регулируется большим спектром генов-регуляторов (рис. 3.87). 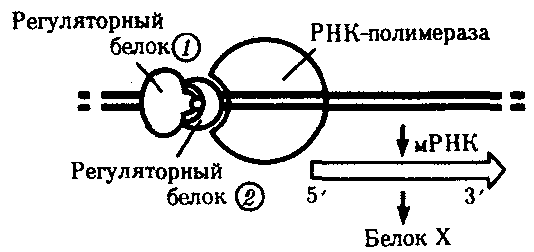 Рис. 3.87. Регуляция экспрессии гена, кодирующего белок Х у эукариот, двумя регуляторными белками У многих эукариотических генов, кодирующих белки и транскрибируемых РНК-полимеразой II, в ДНК имеется несколько областей, которые узнаются разными белками-регуляторами. Одной из них является область, расположенная вблизи промотора. Она включает около 100 пар нуклеотидов, в том числе ТАТА-блок, располагающийся на расстоянии 25 пар нуклеотидов от точки начала транскрипции. Установлено, что для успешного присоединения РНК-полимеразы II к промотору необходимо предварительное соединение с ТАТА-блоком особого белка — фактора транскрипции — с образованием стабильного транскрипционного комплекса. Именно этот комплекс ДНК с белком узнается РНК-полимеразой II. Последовательности нуклеотидов, примыкающие к ТАТА-блоку, формируют требуемый для транскрипции элемент, расположенный перед промотором. Другая область, играющая важную роль в регуляции активности эукариотических генов, располагается на большом расстоянии от промотора (до нескольких тысяч пар нуклеотидов) и называется энхансером (от англ. enhance —усиливать). И энхансер, и препромоторный элемент эукариотических генов содержат серию коротких нуклеотидных последовательностей, которые связываются с соответствующими регуляторными белками. В результате взаимодействия этих белков происходит включение или выключение генов. Особенностью регуляции экспрессии эукариотических генов является также существование белков-регуляторов, которые способны контролировать транскрипцию многих генов, кодирующих, возможно, другие белки-регуляторы. В связи с этим некоторые (главные) белки-регуляторы обладают координирующим влиянием на активность многих генов и их действие характеризуется плейотропным эффектом (рис. 3.88). Примером может служить существование белка, который активирует транскрипцию нескольких специфических генов, определяющих дифференцировку предшественников жировых клеток. 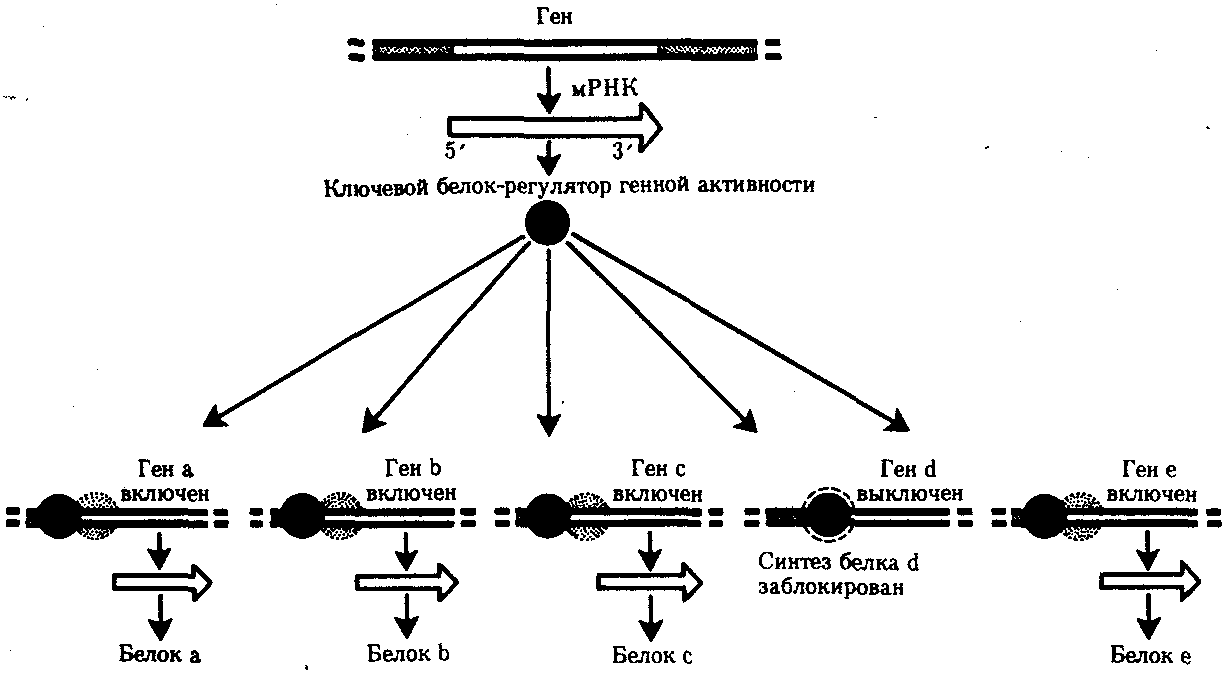 Рис. 3.88. Регуляция экспрессии многих генов эукариот одним белком-регулятором Ввиду того что в геноме эукариот имеется много избыточной ДНК, а в каждой клетке организма транскрибируется всего 7—10% генов, логично предположение о том, что у них преобладает позитивный генетический контроль, при котором активация небольшой части генома оказывается более экономичной, нежели репрессия основной массы генов. Несомненной особенностью регуляции транскрипции у эукариот является подчиненность этих процессов регулирующим влияниям со стороны гормонов организма. Последние часто играют роль индукторов транскрипции. Так, некоторые стероидные гормоны обратимо связываются особыми белками-рецепторами, образуя с ними комплексы. Активированный гормоном рецептор приобретает способность соединяться со специфическими участками хроматина, ответственными за регуляцию активности генов, в которых рецепторы узнают определенные последовательности ДНК. Специфичность регулирующего воздействия гормона на транскрипцию обусловлена не только природой самого гормона, но и природой клетки-мишени, синтезирующей специфический белок-рецептор, который влияет на транскрипцию определенного для данной клетки набора генов. Примером участия гормонов в регуляции активности определенных генов может служить влияние тестостерона на развитие тканей организма по мужскому типу при наличии специфического белка-рецептора. Отсутствие последнего при мутации соответствующего гена не дает возможности гормону проникнуть в ядра клеток-мишеней и обеспечить включение определенного набора генов: развивается синдром тестикулярной феминизации, или синдром Морриса (см. разд. 3.6.5.2). Следующая особенность регуляции генной активности у эукариот связана с образованием стойкого комплекса ДНК с белками — хроматина (см. разд. 3.5.2.2). Ведущая роль в компактизации ДНК принадлежит гистонам, поэтому они, несомненно, участвуют и в процессах регуляции генной активности (см. разд. 3.5.4). Непременным условием для осуществления транскрипции у эукариот является предварительная декомпактизация хроматина на соответствующем участке, где временно утрачивается связь с Hi-гистонами и несколько ослабляется связь с нуклеосомными гистонами. Правда, нуклеосомная организация хроматина не утрачивается даже в ходе транскрипции, однако контакт ДНК и негистоновых белков становится возможным и происходит дерепрессия гена. Отличительной особенностью регуляции экспрессии генов у эукариот является возможность ее осуществления не только на стадии транскрипции, но и на других этапах растянутого во времени процесса реализации наследственной информации. Регуляция на стадии транскрипции является наиболее экономичной, но недостаточно быстро реагирующей на изменение ситуации. Так, возникшая в клетке потребность в каком-либо белке не может быть быстро удовлетворена путем включения транскрипции соответствующего гена. Синтезированный транскрипт должен подвергнуться процессингу, затем зрелая мРНК должна выйти из ядра в цитоплазму и, образуя комплекс с рибосомами, осуществить трансляцию информации, синтезировав пептид, который, лишь пройдя посттрансляционное изменение, формирует активный белок, необходимый клетке. В том случае, когда клетке нужно прекратить синтез какого-то продукта, после выключения транскрипции соответствующего гена в цитоплазму некоторое время будут продолжать поступать созревающие молекулы мРНК, осуществляющие там синтез пептидных цепей, пока они не деградируют под действием ферментов. Таким образом, для эффективной регуляции экспрессии генов у эукариот должны существовать механизмы, работающие не только на стадии транскрипции, но и на других этапах этого процесса. Связанная с экзон-интронной организацией генов необходимость процессичга, в том числе сплайсинга, делает возможным регуляцию этих процессов в ядре. В настоящее время обсуждается роль интронных участков ДНК в изменении схемы сплайсинга при синтезе антител (см. разд. 3.4.3.2) или цитохрома b (см. разд. 3.4.3.3). Это создает возможность, используя один и тот же первичный транскрипт, обеспечивать образование матриц для разных пептидов, вырезая из них разные последовательности или изменяя последовательности на 5'- и 3'-концах мРНК. Очевидно, и транспорт зрелых мРНК из ядра в цитоплазму также регулируется определенным образом, так как установлено, что лишь небольшая часть РНК, транскрибируемой с генов, после сплайсинга покидает ядро. Значительное количество ее деградирует. Возможно, это является результатом процессинга, приводящего к появлению «неправильных» матриц. Существуют механизмы, обеспечивающие регуляцию процессов синтеза пептидных цепей. Они менее экономичны, но отличаются быстротой реагирования на изменения потребностей клетки в данном белке. Регуляция трансляции осуществляется на стадии инициации путем воздействия на один из факторов инициации, катализирующий присоединение к малой субъединице рибосомы тРНК, несущей метионин (формилметионин) (см. разд. 3.4.3). В результате при наличии в цитоплазме мРНК трансляции на ней не происходит. Такая ситуация наблюдается, например, при отсутствии в цитоплазме гема, что ведет к выключению трансляции глобиновых цепей гемоглобина. Наконец, регуляция процесса реализации наследственной информации может осуществляться и на стадии посттрансляционных изменений. Прекращение этих процессов обусловливает задержку в формировании активных молекул белка при наличии необходимых для этого пептидных цепей. Например, для формирования активной формы белкового гормона — инсулина — из проинсулина должны вырезаться две субъединицы. Торможение этих процессов уменьшает выход конечного активного продукта. Таким образом, рассмотренный выше пример регуляции экспрессии генов демонстрирует сложнейшие взаимосвязи, которые существуют между ними в геноме. Формирование любого признака поэтому нельзя рассматривать как результат действия одной пары аллельных генов в генотипе. В любом случае регуляция экспрессии ответственного за этот признак гена осуществляется при участии других генов. 3.6.7. Биологическое значение геномного уровня организации наследственного материалаГеномный уровень организации наследственного материала, объединяющий всю совокупность хромосомных генов, является эволюционно сложившейся структурой, характеризующейся относительно большей стабильностью, нежели генный и хромосомный уровни. На геномном уровне система сбалансированных по дозам и объединенных сложнейшими функциональными взаимосвязями генов представляет собой нечто большее, нежели простую совокупность отдельных единиц. Поэтому результатом функционирования генома является формирование фенотипа целостного организма. В связи с этим фенотип организма нельзя представлять как простую совокупность признаков и свойств, это организм во всем многообразии его характеристик на всем протяжении индивидуального развития. Таким образом, поддержание постоянства организации наследственного материала на геномном уровне имеет первостепенное значение для обеспечения нормального развития, организма и воспроизведения у особи в первую очередь видовых характеристик. В то же время допустимость рекомбинации единиц наследственности в генотипах особей обусловливает генетическое разнообразие их, что имеет важное эволюционное значение. Мутационные изменения, реализующиеся на геномном уровне организации наследственного материала,— мутации регуляторных генов, обладающих широким плейотропным действием, количественные изменения доз генов, транслокации и транспозиции генетических единиц, влияющие на характер экспрессии генов, наконец, возможность включения в геном чужеродной информации при горизонтальном переносе нуклеотидных последовательностей между организмами разных видов, — оказываясь иногда эволюционно перспективными, вероятно, являются основной причиной ускорения темпов эволюционного процесса на отдельных этапах исторического развития живых форм на Земле. |
