онх. Коллигативные свойства разбавленных растворов неэлектролитов. Понижение давления насыщенного пара раствора
 Скачать 80.03 Kb. Скачать 80.03 Kb.
|
|
11.Коллигативные свойства разбавленных растворов неэлектролитов. Понижение давления насыщенного пара раствора (закон Рауля), повышение температуры кипения и понижение температуры замерзания (кристаллизации) растворов. Коллигативные свойства – это свойства растворов, зависящие от числа частиц растворенного вещества. К коллигативным свойствам растворов относят: 1) понижение давления насыщенного пара растворителя над раствором, 2) понижение температуры замерзания и повышение температуры кипения растворов по сравнению с температурами замерзания и кипения чистых растворителей. 3) осмотическое давление. 1 закон Рауля. Давление насыщенного пара растворителя над раствором пропорционально мольной доле растворителя. ,  где Р – давления насыщенного пара растворителя над раствором, Па; Р0 – давления насыщенного пара над растворителем, Па; c(р-ля) – мольная доля растворителя; n(раств. в-ва) – количество растворенного вещества, моль; n(р-ля) – количество вещества растворителя, моль. Иногда закон Рауля определяют следующим образом. Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества. или , где c(раств. в-ва) – мольная доля растворенного вещества. где Р – давления насыщенного пара растворителя над раствором, Па; Р0 – давления насыщенного пара над растворителем, Па; c(р-ля) – мольная доля растворителя; n(раств. в-ва) – количество растворенного вещества, моль; n(р-ля) – количество вещества растворителя, моль. Иногда закон Рауля определяют следующим образом. Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества. или , где c(раств. в-ва) – мольная доля растворенного вещества.2 закон Рауля. Понижение температуры замерзания и повышение температуры кипения растворов по сравнению с таковыми для чистого растворителя пропорциональны моляльной концентрации растворенного вещества: , 12. Коллигативные свойства разбавленных растворов слабых и сильных электролитов. ИзотонИзотонический коэффициент Вант-ГоффаДля растворов электролитов данное уравнение приобретает несколько иной вид, в его состав входит изотонический коэффициент i: p0 – p = Δр Δp = i · p0 · χв-ва, где Δp — изменение давления паров раствора по сравнению с чистым растворителем; χв-ва — мольная доля вещества в растворе i – изотонический коэффициент. Изотонический коэффициент (или фактор Вант-Гоффа) — это параметр, не имеющий размерности, который характеризует поведение какого – либо вещества в растворе. То есть, изотонический коэффициент показывает, разницу содержания частиц в растворе электролита по сравнению с раствором неэлектролита такой же концентрации. Он тесно связан связан с процессом диссоциации, точнее, со степенью диссоциации и выражается следующим выражением: i = 1+α(n-1), где n – количество ионов, на которые диссоциирует вещество. α – степень диссоциации. Коллигативные свойства растворов - такие свойства растворов, которые зависят в основном от концентрации растворенных частиц и в значительно меньшей степени от их размера, молярной массы и других свойств. Проникновение воды через животную мембрану из конц. раствора, т.е. то, что мы называем осмосом, впервые описал Ноле. Блегден установил, что понижение температуры замерзания растворителя зависит от массы растворенного вещества. Оба явления - понижение температуры замерзания растворителя и осмос – следствия проявления общего закона, в соответствие с которым давление насыщенного пара растворителя над раствором нелетучего вещества меньше давления насыщенного пара над чистым растворителем при той же температуре. 13. Осмос и осмотическое давление, закон Вант-Гоффа. Гипо-, изо- и гипертонические растворы. Роль осмоса и осмотического давления в биосистемах. Плазмолиз, гемолиз, тургор. Осмос- это одностороннее проникновение молекул растворителя через полупроницаемую мембрану из растворителя в раствор, или из раствора с меньшей концентрацией в раствор с большей концентрацией. Осмотические свойства растворов количественно характеризуются величиной осмотического давления. Осмотическое давление – сила, обуславливающая осмос. Оно равно внешнему давлению, при котором осмос видимо прекращается. Явление осмоса играет важную роль во многих химических и биологических системах. Благодаря осмосу регулируется поступление воды в клетки и межклеточные структуры. Упругость клеток (тургор), обеспечивающая эластичность тканей и сохранение определенной формы органов, обусловлена осмотическим давлением. Животные и растительные клетки имеют оболочки или поверхностный слой протоплазмы, обладающие свойствами полупроницаемых мембран. При помещении этих клеток в растворы с различной концентрацией наблюдается осмос. Вант-Гофф сформулировал закон для осмотического давления. “Осмотическое давление раствора равно тому давлению, которое производило бы растворенное вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало объем, равный объему раствора”. Вант-Гофф также предложил эмпирическое уравнение для расчета осмотического давления разбавленных растворов неэлектролитов: Росм. = СRТ, (1) где Т – абсолютнаяРосм. – осмотическое давление, кПа; С – молярная концентрация, моль/л; К, если температура, К; R – универсальная газовая постоянная, равная 8,31 Дж/моль осмотическое давление выражается в килопаскалях. Если же осмотическое давление выражается в атмосферах, то R = 0,082 л Указанный законы справедлив для разбавленных раствороватм./Кмоль неэлектролитов. Их можно применять и к растворам электролитов, но в этом случае необходимо вводить изотонический коэффициент Вант-Гоффа (i). Это поправочный коэффициент, который учитывает увеличение числа частиц в растворе электролита из-за диссоциации на ионы Изотонические растворы — растворы, имеющие одинаковое осмотическое давление. Если два раствора не изотоничны, то раствор с большим осмотическим давлением называют гипертоническим, а раствор с меньшим осмотическим давлением — гипотоническим. Растворы, имеющие одинаковое осмотическое давление, называются изотоническими. Если два раствора имеют различное осмотическое давление, то раствор с большим осмотическим давлением является гипертоническим по отношению ко второму, а второй – гипотоническим по отношению к первому. При помещении клеток в изотонический раствор они сохраняют свой размер и нормально функционируют. При помещении клеток в гипотонический раствор во–да из менее концентрированного внешнего раствора переходит внутрь клеток, что приводит к их набуханию, а затем к разрыву оболочек и вытеканию клеточного содержимого. Такое разрушение клеток называется лизисом, в случае эритроцитов этот процесс называется гемолизом. Кровь с клеточным содержимым, выходящим наружу при гемолизе, за свой цвет называется лаковой кровью. При помещении клеток в гипертонический раствор во–да из клеток уходит в более концентрированный раствор, и наблюдается сморщивание (высушивание) клеток. Это явление называется плазмолизом. 14. Растворы слабых электролитов. Теория электролитической диссоциации. Применение закона действия масс к ионизации слабых электролитов. Константа ионизации (Ка). Ступенчатый характер ионизации. Закон разбавления Оствальда. Смещение равновесия в растворах слабых электролитов. Электролиты, которые не полностью диссоциируют на ионы( ионизируются ) называются слабыми электролитами. К ним принадлежит большинство органических кислот, а также некоторые неорганические соединения: H2S, HCN, H2CO3, H2SO3, HCLO, H2O, H3BO3, Hg2CL2, Fe(SCN)3 и др. Слабые электролиты не могут дать большой концентрации ионов в растворе. Они плохо (или почти не проводят) электрический ток. На степень диссоциации слабых электролитов влияет добавление одноименных ионов. Так, введение в равновесную систему СН3СООН → Н+ + СН3СООˉ сильного электролита СН3СООNa увеличивает концентрацию ионов СН3СООˉ , что в соответствии с принципом Ле Шателье приводит к значительному сдвигу равновесия диссоциации влево, т.е. к уменьшению степени диссоциации. Таким образом, добавление к раствору слабого электролита одноименных ионов уменьшает степень его диссоциации. Количественно электролитическую диссоциацию как равновесный обратимый процесс можно охарактеризовать константой диссоциации(ионизации), определяемой законом действующих масс. Зако́н де́йствующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ.Закон действующих масс, строго говоря, применим к обратимым реакциям, т.е. к растворам слабых электролитов. Так например, диссоциацию электролита АaВbможно представить в виде равновесного процесса: АaВb <––> aАx- + bВy+ ( х и у в степени) Согласно закону действующих масс константу равновесия записывают следующим образом: где числитель- молярные равновесные концентрации ионов электролита, а знаменатель- молярная равновесная концентрация недиссоциированных молекул электролита, К-константа равновесия, называемая константой диссоциации. Многоосновные кислоты и многокислотные основания диссоциируют ступенчато. Например, диссоциация фосфорной кислоты происходит в три ступени: Н3РО4 = Н+ + Н2РО4 - ( 1 ступень ) Н2РО4 - = Н+ + НРО4 2- ( 2 ступень ) НРО4 2- = Н+ + РО4 3- ( 3 ступень ) Диссоциация по ступеням характеризуется константами: К1 = [H+]*[H2PO4 -] [H3PO4] К2 = [H+]*[HPO4 2-] [H2PO4 -] К3 = [H+]*[PO4 3-] [HPO4 2-] Суммарное уравнение и общая константа диссоциации: Н3РО4 = 3Н+ + РО4 3- К = К1*К2*К3 = [H+]^3 * [PO4 3-] [H3PO4] Аналогично для многокислотных оснований, например Са(ОН)2 диссоциация проходит в две ступени. Степенчатая диссоциация характеризуется тем, что распад электролита по каждой последующей ступени происходит в меньшей степени, чем по предыдущей 15. Теория растворов сильных электролитов. Ионная сила растворов, коэффициент активности и активность ионов. ри растворении в воде электролиты распадаются (диссоциируют) на положительно и отрицательно заряженные ионы. Положительно заряженные ионы называются катионами; например, ионы водорода и металлов. Отрицательно заряженные ионы называются анионами; к ним принадлежат ионы кислотных остатков, гидроксид-ионы. Диссоциация НС1 и NaCl выразится уравнением: HCl = H+ + Cl+ NaCl =Na++ Cl+ Процесс диссоциации. В зависимости от структуры растворяющегося вещества в безводном состоянии ( ионная или полярная связь) его диссоциация протекает по-разному. Когда кристалл соли, например, хлорида калия, попадает в воду, то расположенные на его поверхности ионы притягивают к себе полярные молекулы воды (ион-дипольное взаимодействие). К ионам калия молекулы воды притягиваются своими отрицательными полюсами, а к хлорид-ионам — положительными. Чаще всего в растворе лишь часть электролита диссоциирует на ионы, поэтому существует понятие степени диссоциации. Степенью диссоциации электролита называется отношение числа его молекул, распавшихся в данном растворе на ионы, к общему числу его молекул в растворе. В связи с этим электролиты можно разделить на две группы - сильные и слабые электролиты. Сильные электролиты в водных растворах диссоциированы практически полностью. Понятие степени диссоциации к ним не применимо. Слабые электролиты в водных растворах диссоциируют только частично, и в растворе устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. К сильным электролитам принадлежат почти все соли; из кислот и оснований к ним относятся HNO3, HCIO4, НСI, HBr, HI, КОН, NaOH, Ba(OH)2 и Са(ОН)2. В водных растворах сильные электролиты обычно полностью диссоциированы. Поэтому число ионов в них больше, чем в растворах слабых электролитов той же концентрации. И если в растворах слабых электролитов концентрация ионов мала, расстояния между ними велики и взаимодействие ионов друг с другом незначительно, то в не очень разбавленных растворах сильных электролитов среднее расстояние между ионами вследствие значительной концентрации сравнительно мало. Например, в насыщенном растворе хлорида натрия среднее расстояние между ионами всего только в 2 раза больше, чем в кристаллах NaCl. При этом силы межионного притяжения и отталкивания довольно велики. В таких растворах ионы не вполне свободны, движение их стеснено взаимным притяжением друг к другу. Благодаря этому притяжению каждый ион как бы окружен шарообразным роем противоположно заряженных ионов, получившим название «В отсутствие внешнего электрического поля ионная атмосфера симметрична и силы, действующие на центральный ион, взаимно уравновешиваются. Если же приложить к раствору постоянное электрическое поле, то разноименно заряженные ионы будут перемещаться в противоположных направлениях. При этом каждый ион стремится двигаться в одну сторону, а окружающая его ионная атмосфера — в противоположную, вследствие чего направленное перемещение иона замедляется, а следовательно, уменьшается число ионов, проходящих через раствор в единицу времени, т. е, сила тока. Чем больше концентрация раствора, тем сильнее проявляется тормозящее действие ионной атмосферы на электропроводность раствора. Однако падение степени диссоциации объясняется не образованием молекул, а увеличением тормозящего действия ионной атмосферы. В связи с этим, определяемое по электропроводности (или другими методами) значение степени диссоциации сильных электролитов называется кажущейся степенью диссоциации. Следовательно, все свойства раствора электролита, зависящие от концентрации ионов, проявляются так, как если бы число ионов в растворе было меньше, чем это соответствует полной диссоциации электролита. ионной атмосферы». 16. Равновесие между раствором и осадком малорастворимого электролита. Константа растворимости К (произведение растворимости). Условия растворения и образования осадков. случае, когда мы имеем дело с малорастворимым химическим соединением, образующим при растворении электролит, в системе быстро устанавливается равновесие между раствором и осадком, причем растворенная часть малорастворимого соединения практически полностью диссоциирует на ионы. Это понятно, если принять во внимание редкость столкновений частиц, образующихся из растворенного соединения в разбавленных растворах. Поэтому малорастворимые электролиты являются сильными. Равновесие, устанавливающееся между осадком малорастворимого вещества и его насыщенным раствором, описывается уравнением: АаВв(т) Получившееся в правой части произведение равновесных концентраций ионов, на которые диссоциирует в растворе малорастворимый сильный электролит (в степенях, равных стехиометрическим коэффициентам уравнения диссоциации), называется произведением растворимости (ПР) малорастворимого сильного электролита: Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная. В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m катионов An+ и n анионов Bm-, рассчитывается по уравнению: К обменным реакциям, протекающим в растворе электролитов, относятся реакции осаждения и растворения. Реакции осаждения сопровождаются выпадением осадков. Реакции, сопровождающиеся растворением осадков, называются реакциями растворения. Широко используют системы, состоящие из осадка труднорастворимого электролита и насыщенного раствора над ним. В таких системах между насыщенным раствором и осадком устанавливается динамическое равновесие. Вследствие низкой растворимости концентрация труднорастворимого электролита в растворе очень мала, поэтому можно считать, что в растворе он полностью диссоциирован. Иначе говоря, динамическое равновесие в насыщенном растворе устанавливается между твердой фазой вещества и перешедшими в раствор ионами. Например, в насыщенном растворе AgCl имеет место равновесие: AgCl(T) > Ag+(p) + Cl-(р). Концентрация твердой фазы AgCl как величина постоянная из выражения для константы равновесия исключается. Вследствие этого константа равновесия определяется только произведением концентраций ионов в растворе и называется константой или произведением растворимости. В общем случае для электролита Ktn Anm константа растворимости определяется стехиометрическим произведением концентраций ионов: Кпр= [Ktm+ ]n[Ann–]m Эта величина характеризует растворимость электролита при постоянной температуре в отсутствие посторонних веществ. Постоянство Кпр не означает постоянства концентраций отдельных ионов в растворе. Так, можно увеличить концентрацию ионов Ag в насыщенном растворе AgCl, добавив, например, AgNO3 , при этом равновесие по принципу Ле Шателье сместится влево, что приведет к увеличению скорости осаждения ионов. Через некоторое время скорости растворения AgCl и осаждения ионов Ag и Cl сравняются. Вновь установившееся равновесие будет, как и прежде, характеризоваться величиной Кпр(AgCl), но равновесные концентрации ионов Ag и Cl изменятся. Таким образом, на основе Кпр можно прогнозировать образование и растворение осадков электролитов на основе двух правил. 1. Электролит выпадает в осадок, когда стехиометрическое произведение концентраций его ионов в растворе больше константы растворимости. 2. Осадок электролита растворяется, когда стехиометрическое произведение концентраций составляющих его ионов в растворе становится меньше константы растворимости. Реакции осаждения лежат в основе метода осаждения, который применяется в количественном анализе фармацевтических препаратов. Метод осаждения используется в клиническом анализе хлоридов в моче, желудочном соке, крови, в санитарно-гигиенической практике – при анализе питьевой воды. Ученые считают, что различная растворимость природных соединений элементов в воде оказала большое влияние на их содержание в живых организмах. Между растворимостью соединений в воде и токсическим действием ионов ряда элементов имеется тесная взаимосвязь. Например, введение Al3 + в организм вследствие образования малорастворимого фосфата алюминия AlPO4. 17. Ионизация воды. Ионное произведение воды. Водородный показатель - рН; расчет рН растворов слабых и сильных кислот и оснований. Вода – очень слабый электролит. Запишем уравнение ионизации воды: Н2О + Н2О ↔ Н3О+ + ОН- Или упрощенно: Н2О ↔ Н+ + ОН- [H ][OH ] Кион. [H2O] . Известно, что при температуре 22-25оС в 1 л на ионы распадается 10-7 моль молекул Н2О. Следовательно, [H+] = [OH-] = 10-7 моль/л. Концентрацию молекул воды можно считать величиной постоянной, равной: [H2O] = 1000/18 = 55,56моль/л. Следовательно, константа ионизации воды при 2225оС будет равна Ки= 1,82·10-16. Произведение равновесных концентраций ионов Н+ и ОН- называется ионным произведением воды: КW = [H+][OH-] КW = 10-7∙10-7 = 10-14 . КW = 10-14 при Т = 22-25оС. Характер среды в водном растворе любого вещества определяется тем ионом Н+ или ОН-, концентрация которого преобладает.
60 + [H+] < [OH-], т.е [H+] < 10-7 моль/л - среда щелочная. Важно отметить, что в любом водном растворе – нейтральном, кислотном, щелочном имеются водородные и гидроксильные ионы. При этом произведение концентрации этих ионов величина постоянная, равная ионному произведению воды. . Водородный показатель На практике принято оценивать ионное равновесие в водных растворах значением водородного показателя рН. Водородным показателем рН называют отрицательный десятичный логарифм концентрации ионов водорода в водном
18. Гидролиз солей. Гидролитическое равновесие и его смещение. Степень и константа гидролиза. Константа химического равновесия для гетерогенных процессов. Произведение растворимости. Осаждение и растворение труднорастворимых солей как процесс смещения ионного равновесия в растворах. Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»). Различают обратимый и необратимый гидролиз солей: § 1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону): CO32− + H2O = HCO3− + OH− Na2CO3 + Н2О = NaHCO3 + NaOH (раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени) § 2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону): Cu2+ + Н2О = CuOH+ + Н+ CuCl2 + Н2О = CuOHCl + HCl (раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени) § 3. Гидролиз соли слабой кислоты и слабого основания: 2Al3+ + 3S2− + 6Н2О = 2Al(OH)3(осадок) + ЗН2S(газ) Al2S3 + 6H2O = 2Al(OH)3 + 3H2S (равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа). Степень гидролиза Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр); α = (cгидр/cобщ)·100 % где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли. Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие. Является количественной характеристикой гидролиза. Константа гидролиза — константа равновесия гидролитической реакции. Выведем уравнение константы гидролиза соли, образованной слабой кислотой и сильным основанием: Уравнение константы равновесия для данной реакции будет иметь вид: Так как концентрация молекул воды в растворе постоянна, то произведение двух постоянных Численное значение константы гидролиза получим, используя ионное произведение воды подставим в уравнение константы гидролиза равна: В общем случае для соли, образованной слабой кислотой и сильным основанием: для соли, образованной сильной кислотой и слабым основанием: для соли, образованной слабой кислотой и слабым основанием: 19. Роль реакций гидролиза в биохимических процессах. Применение реакций нейтрализации в фармакотерапии: лекарственные средства с кислотными и основными свойствами (гидрокарбонат натрия, оксид и пероксид магния). 1. Гидролиз – это начальная стадия пищеварения. Высокомолекулярные вещества (белки, жиры, полисахариды и др.) подвергаются ферментативному гидролизу с образованием низкомолекулярных соединений (соответственно, аминокислот, жирных кислот и глицерина, глюкозы и др.), так как высасываться в кишечнике способны только относительно небольшие молекулы. 2. Гидролиз фосфоорганических веществ (АТФ) – источник энергии в организме. Применение реакции нейтрализации в фармакотерапии. Для проведения коррекции кислотно-основного состояния необходимо выявить, какое звено в его регулировке нарушено. Для этого необходимо определить значения рН биологических жидкостей и содержание буферных оснований. В основе фармакологических действий лежит реакция нейтрализации. Например, в качестве экстренной меры при ацидозе применяется внутривенное вливание раствора гидрокарбоната натрия 4,5%, а в острых случаях – 8,4%. Для устранения явления алкалоза в некоторых случаях используют раствор аскорбиновой кислоты 5%. В гастроэнтерологии применяют средства, нормализующие секреторную функцию желудка. При пониженной кислотности желудочного сока назначают разбавленную соляную кислоту, при повышенной кислотности – различные антацидные препараты: оксид магния, основной карбонат магния, карбонат кальция, гидрокарбонат натрия. 20. Электронная теория окислительно-восстановительных (ОВ) реакций (Л.В.Писаржевский). Окислительно-восстановительные свойства элементов и их соединений в зависимости от положения элемента в ПСЭ и степени окисления элементов в соединениях. Сопряженные пары окислитель-восстановитель. Окислительно - восстановительная двойственность. Роль окислительно – восстановительных процессов в метаболизме. Окислительно-восстановительные реакции Окислительно-восстановительные реакции имеют очень широкое распространение и являются чрезвычайно важными для обмена веществ в живых организмах, для многих промышленных процессов, связанных с получением химических веществ. Они имеют огромное значение в теории и практике. Окисли́тельно-восстанови́тельные реа́кции, ОВР, редокс (от англ. redox ← reduction-oxidation — окисление-восстановление) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путем перераспределения электронов между атомом-окислителем и атомом-восстановителем. Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ называются окислительно-восстановительными. Реакции, связанные с передачей электронов, в результате этого изменяется степень окисления одного или нескольких участвующих в реакции элементов, называются окислительно-восстановительными. Состояние атома в молекуле характеризуется с помощью понятия «степени окис-ления». Степень окисления ― понятие условное, так как большинство соединений не являются ионами, чаще встречаются соединения с ковалентной связью. +Число электронов, смещенных от атома данного элемента к другим атомам или от других атомов к атомам данного элемента, называется степенью окисления (окислительное число, о.ч.). Электрический заряд данного атома, вызванный смещением валентных электронов к более электроотрицательному атому, называется степенью окисления (окислительное число, о.ч.). Степень окисления ― величина переменная. Вычисление степени окисления производится на основании того, что молекула любого вещества в целом электронейтральна. Степень окисления элемента в соединении вычисляется: степень окисления элементов в простых веществах принимается равной нулю (Znо, Feо, Cdо, О2о, N2о); алгебраическая сумма степеней окисления всех атомов, входящих в состав молекулы равна нулю +1+6-2 +1 +6 -2 +4 -2 -4+1 +1 -2 H2SO4 K2CrO4 CO2 CH4 H2O; +2+6-8=0 +2+6-8=0 +4-4=0 -4+4=0 +2-2=0 ; постоянную степень окисления в соединениях проявляют щелочные металлы (+1), металлы главной подгруппы II (+2), цинк и кадмий (+2), алюминий (+3); водород проявляет степень окисления (+1) во всех соединениях, кроме гидридов металлов (МеНх), где степень окисления его равна (-1); степень окисления кислорода в соединениях равна (-2), за исключением пероксидов (Н2Э2) (-1) и фторида кислорода (ОF2) (+2); фтор во всех соединения (–1); 7) все металлы имеют положительную степень окисления. Понятие о степени окисления является условным и не всегда характеризует настоящее состояние атомов в соединениях, но оно весьма удобно и полезно при классификации различных соединений, рассмотрении окислительно-восстановительных процессов, предсказания направления течения и продуктов химических реакций и т.д. Для объяснения окислительно-восстановительных реакций в настоящее время применяют электронную теорию Я.И. Михайленко и Л.В. Писаржевского(1904 г.). Её основные положения: - процесс отдачи электронов атомом, молекулой или ионом, называется окислением.При окисле́нии атома, молекулы или иона в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов. В некоторых случаях при окислении мо-лекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части. При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле. При окислении степень окисления повышается 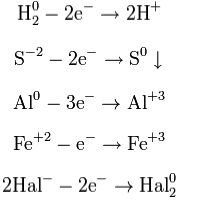 - процесс присоединения электронов атомом, молекулой или ионом, называется восста-новлением. При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента 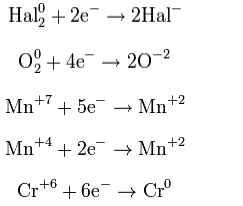 - частицы (атом, молекула или ион), принимающие электроны, называются окислителями, Окислителями могут быть: 1. Нейтральные молекулы неметаллов (кислород ,хлор…); 2.Положительно заряженные ионы металлов в высшей степени окисления (железо медь…); 3.Сложные кислородосодержащие ионы в высшей степени окисления кислородообразующего элемента (хлораты ,манганаты …); 4. Анод. В качестве окислителей на практике используют: O2, Cl2, Br2, J2, O3, KMnO4, K2CrO4, K2Cr2O7, HNO3, H2SO4(к), CuO, Ag2O, PbO2, (NH4)2S2O8. Вещества, в которых элемент имеет промежуточную степень окисления, могут проявлять как окислительные, так и восстановительные свойства (оксид марганца,…). | |||||||||||||||
