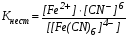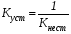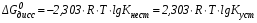М 3. Тема 3.Теория. Комплексные соединения. Комплексные соединения
 Скачать 177.97 Kb. Скачать 177.97 Kb.
|
|
Изомерия комплексных соединений Изомерией называют такое явление, когда вещества, имеющие одинаковый состав и молекулярную массу, обладают различным строением и, следовательно, различными свойствами. Изомерия широко распространена среди комплексных соединений и является одной из причин их многообразия. Различают геометрическую, оптическую, гидратную, ионизационную и другие виды изомерии. 1. Геометрическая изомерия. Этот вид изомерии обусловлен различным расположением лигандов относительно друг друга и распространен у комплексных соединений, имеющих геометрию плоского квадрата, октаэдра или квадратной пирамиды. Линейные и тетраэдрические комплексы геометрических изомеров не имеют. Смешанные комплексы состава [MeA2B2], имеющие конфигу-рацию плоского квадрата, могут иметь два изомера. Если одинаковые лиганды находятся по одну сторону от комплексообразователя, то образуется цис-изомер (от лат. cis по эту сторону), а если по разные стороны, образуется транс-изомер (от лат. trans по ту сторону). Геометрические изомеры могут проявлять различные свойства. Так, цис-изомер [Pt(NH3)2Cl2] оказывает лечебное действие при раковых заболеваниях, тогда как транс-изомер противоопухолевым действием не обладает: 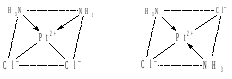 цис-изомер транс-изомер Октаэдрические комплексы состава [MeA4B2] и [MeA3B3] также имеют по два геометрических изомера. С увеличением числа различных лигандов возрастает и число геометрических изомеров. Так, у октаэдрического комплекса с шестью различными лигандами существует 15 геометрических изомеров. 2. Оптическая изомерия. Оптическая изомерия возникает у комплексных соединений, структуры внутренних сфер которых не совмещаются в трехмерном пространстве и являются как бы зеркальным отображением друг друга. Оптическая изомерия комплексных соединений возможна только тогда, когда внутренняя сфера не имеет ни одной плоскости симметрии, т.е. плоскости, которая разделила бы ее на две одинаковые части. Комплексные соединения с координационным числом 4 могут иметь оптические изомеры только в том случае, если они построены тетраэдрически, и во внутренней сфере нет одинаковых лигандов: 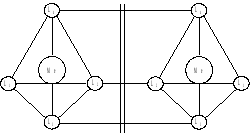 К таким соединениям относятся, например, ионы тетраалкил-аммония [NR1R2R3R4]+, где R1, R2, R3, R4 различные органические радикалы. Важнейшим физическим свойством оптических изомеров является способность вращать плоскость поляризации света. В целом, на макроуровне, по своим физическим и химическим свойствам оптические изомеры практически не отличаются друг от друга, но их физиологическое воздействие в ряде случаев может быть различным. 3. Сольватная изомерия. Причиной возникновения сольватной изомерии является неодинаковое распределение молекул растворителя между внутренней и внешней сферами. Например, для хлорида гексааквахрома (III) известны 3 изомера: [Cr(H2O)6]Cl3 (кристаллы серо-сиреневого цвета); [Cr(H2O)5Cl]Cl2H2O (кристаллы светло-зеленого цвета); [Cr(H2O)4Cl2]Cl2H2O (кристаллы изумрудно-зеленого цвета). Доказательством существования этих форм является то, что раствор нитрата серебра в первом случае осаждает все ионы хлора, во втором ⅔, а в третьем ⅓ часть хлора. При высушивании гидраты теряют только ту воду, которая находится во внешней сфере. 4. Ионизационная изомерия. Этот вид изомерии связан с различным распределением ионов различного типа между внутренней и внешней сферами комплекса. Ионизационные изомеры могут быть, например, у соединения состава CoBrSO4∙(NH3)5: [Co(NH3)5Br]SO4 и [Co(NH3)5SO4]Br. Кристаллы ионизационных изомеров имеют различную окраску, а их растворы могут отличаются и по химическим свойствам: в первом случае из раствора не удается осадить ионы брома нитратом серебра, а во втором осадить сульфат-ионы хлоридом бария. 5. Координационная изомерия. Координационная изомерия может наблюдаться у комплексных соединений, состоящих из двух внутренних сфер и заключается в различном распределении лигандов между сферами. Например: [Pt(NH3)4][PdCl4] и [Pd(NH3)4][PtCl4]. Номенклатура комплексных соединений При написании названия комплексного соединения следует руководствоваться следующими правилами: 1. Комплексные соединения называют с конца формулы, т. е. справа налево. Иными словами, сначала называют анион, затем катион. 2. Порядок названия комплексного иона: 1) сначала называют лиганды, обозначая их количество при помощи греческих числительных: моно 1, ди 2, три 3, тетра 4, пента 5, гекса 6 и т. д.; 2) в смешанных комплексах сначала называют анионы, прибавляя к латинскому названию окончание «-о», затем нейтральные лиганды, начиная с NH3.
3) в последнюю очередь называют комплексообразователь, указывая его заряд римской цифрой в скобках. Если комплексообразователь входит в состав комплексного катиона, то название дается русское. Если комплексообразователь входит в состав комплексного аниона, то в его латинском названии суффикс «-ум» заменяют на суффикс «-ат».
3. Название катиона внешней сферы дается русское в роди-тельном падеже: K3[Fe(CN)6] – гексацианоферрат (III) калия, [Pd(H2O)(NH3)2Cl]Cl – хлорид хлородиамминмоноаквапалладия (II), NН4[Сr(NH3)2(SСN)4] – тетратиоцианатодиамминхромат (III) аммония, H2[PtCl6] гексахлороплатинат (IV) водорода или гексахлорплати-новая кислота. Названия комплексных соединений без внешней сферы состоят из одного слова, без указания заряда комплексообразователя: [Ni(CO)4] тетракарбонилникель, [Pt(NH3)2Cl2] диамминдихлороплатина. Ионные равновесия в растворах комплексных соединений В водных растворах комплексные соединения диссоциируют ступенчато. Различают первичную и вторичную диссоциацию. Первичная диссоциация это диссоциация комплексного соединения на комплексный ион и внешнюю сферу: K4[Fe(CN)6] Первичная диссоциация протекает полностью, это диссоциация сильного электролита. Вторичная диссоциация протекает в очень малой степени из-за высокой прочности комплексного иона: [Fe(CN)6]4 ⇄ Fe2+ + 6CN Константа химического равновесия для реакции вторичной дис-социации называется константой нестойкости комплексного иона:
Величина, обратная константе нестойкости, называется константой устойчивости комплексного иона:
Величины констант нестойкости и устойчивости могут являться мерой термодинамической прочности комплексного иона. Действи-тельно, оценить возможность самопроизвольного протекания процес-са диссоциации комплексного иона можно по величине изменения энергии Гиббса, которая связана с 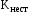 и и 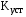 соотношением: соотношением:
Видно, что чем меньше величина 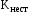 и чем больше величина и чем больше величина 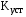 , тем более положительной является изменение энергии Гиббса, и, соответственно, меньшей степень диссоциации комплекса. , тем более положительной является изменение энергии Гиббса, и, соответственно, меньшей степень диссоциации комплекса.Таким образом: Комплексный ион тем прочнее, чем меньше величина константы нестойкости и чем больше величина константы устойчивости. Обе константы являются индивидуальными характеристиками комплексных ионов и приведены в справочниках. Хелаты и внутрикомплексные соединения Циклические комплексные соединения, в образовании которых принимают участие полидентатные лиганды, называются хелатами. Полидентатные лиганды обычно представляют собой многоатомные спирты, амины и их производные. Электронодонорные атомы лиганда (N, O, S и др.) расположенные на некотором расстоянии друг от друга, за счет донорно-акцепторных связей образуют с комплексообразователем циклы (один или несколько). Обычно встречаются пяти- и шестичленные циклы, реже четырехчленные. Например, 1,2-диаминоэтан, в котором два донорных атома разделены двумя СН2-группами H2N – CH2 – CH2 – NH2, с ионами кобальта Со3+ образует хелатный комплекс: 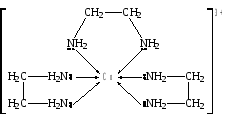 Хелатные комплексы отличаются повышенной прочностью. Это относится как к термической прочности, так и к устойчивости внутренней сферы в водных растворах. О последнем свидетельствует сравнение величин констант нестойкости хелатного комплекса кобальта с 1,2-диаминоэтаном и иона гексамминкобальта (III), которые, соответственно, равны 21049 и 71036. В обоих случаях имеется связь кобальта с азотом. Разница заключается лишь в том, что в первом случае образуется циклическая структура, а во втором нет. Если помимо координационной связи, полидентатный лиганд связан с комплексообразователем еще и ковалентной связью, то образуется дополнительный хелатный цикл. Такие соединения называются внутрикомплексными. Соединения, которые образуют внутрикомплексные соединения с ионами металлов, называются комплексоны. Такими свойствами, например, обладают органи-ческие производные аминополикарбоновых кислот:
На практике чаще используется трилон Б, так как эта динатриевая соль лучше растворима в воде по сравнению с ЭДТА. Трилон Б образует прочные растворимые в воде комплексы с катионами металлов, так как кроме двух ковалентных связей (при замещении ионов водорода в СООН группах) образуются две дополнительные координационные связи с участием неподеленных пар электронов атомов азота: 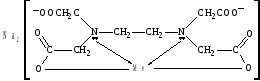 где Me Mg2+, Ca2+, Sr2+, Ba2+, Mn2+ Fe2+, Cu2+, Zn2+, Pb2+ и др. В случае трехвалентных комплексообразователей (Al3+, Ga3+, Ce3+ и др.) комплексы имеют более сложное октаэдрическое строение. Внутрикомплексные соединения четырехвалентных металлов отличаются тем, что не имеют внешней сферы, т.е. не являются электролитами. К внутрикомплексным соединениям относятся многие биологические комплексы, например, хлорофилл (комплексообразователь Mg2+), гемоглобин (Fe2+), витамин В12 (Co3+) и многие другие. Комплексоны используют в медицинской практике. Например, при отравлениях тяжелыми металлами (Pb2+, Hg2+) для их связывания и выведения из организма применяют ЭДТА. Трилон Б применяется при заболеваниях, связанных с избыточным отложением солей кальция в организме (артриты, артрозы, отложение кальция в почках, венах, мышцах). Трилон Б также используют как антикоагулянт при консервировании крови. Биологическая роль комплексных соединений Комплексные соединения, рассмотренные нами выше, содержали лиганды, в основном, неорганической природы. Однако, в биологических системах огромную роль играют комплексные соединения, в которых в качестве лигандов выступают сложные органические молекулы, обладающие полидентатными свойствами (т. е., способны образовывать с комплексообразователем несколько связей). Металлопротеины К металлопротеинам относят биополимеры, которые, помимо белка, содержат простетическую группу (компонент небелкового характера), включающую ионы металлов. Отдельную группу металлопротеинов составляют гемопротеины, содержащие в качестве простетической группы соединения железа. Одним из важнейших гемопротеинов является гемоглобин. Он состоит из белка (глобина) и комплекса железа с порфирином (гема). В геме ион Fe2+ (комплексообразователь), связан с двумя атомами азота, принадлежащими порфириновому кольцу, ковалентной связью, а еще с двумя координационной. Координа-ционное число Fe2+ равно шести: в порфириновом комплексе пятое координационное место занимает гистидиновая группа белка, образуя координационую связь атома азота с Fe2+. В отсутствие кислорода шестым лигандом является вода. В случае, когда вода замещается на кислород, образуется оксигемоглобин. Кроме воды и кислорода ион Fe2+ может связывать и некоторые другие лиганды, например, СО, CN и оксиды азота. Так, с молекулами угарного газа гемоглобин образует карбоксигемоглобин, а с оксидами азота метгемоглобин, содержащий ионы Fe3+. Накопление этих видов гемоглобина в крови приводит к снижению снабжения тканей кровью. 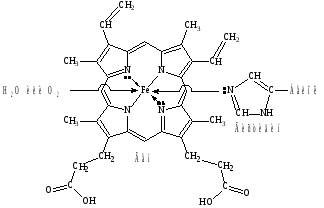 Схема образования связей в гемоглобине Гем в виде гем-порфирина является простетической группой производных гемоглобина: миоглобина, каталазы, пероксидазы и цитохромов. Отличительной особенностью гемоглобина (миоглобина) являет-ся постоянство степени окисления железа Fe2+. Равновесие: О2 + гемоглобин ⇄ оксигемоглобин в легких смещено вправо, а в клетках – влево. Таким образом, гемоглобин (миоглобин) является переносчиком молекул (Н2О, О2). Транспортные функции выполняют и цитохромы, в которых связь между гемом и полипептидной цепью осуществляется при помощи остатков цистеина белковой цепи. Однако, в отличие от гемоглобина и миоглобина, механизм их действия основан на изменении степени окисления железа: Fe2+ 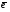 Fe3+ + 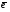 Передавая электроны от цитохрома b к цитохромооксидазе, ионы железа участвуют в процессе окислительного фосфорилирования. С кислородом и СО цитохромы не взаимодействуют. |