М 3. Тема 3.Теория. Комплексные соединения. Комплексные соединения
 Скачать 177.97 Kb. Скачать 177.97 Kb.
|
|
Витамины Единственным витамином, содержащим в своей структуре металл, является витамин В12 (кобаламин). В его состав входит ион Со3+, который находится в центре плос-кой корриновой системы (подобна порфириновой) и связан с атомами азота восстановленных пиррольных колец. Перпендикулярно плос-кости корриновой системы расположен нуклеотидный лиганд, состо-ящий из 5,6-диметилбензимидазола и рибозы с остатком фосфорной кислоты. Наконец, шестым лигандом является цианид-ион. Витамин В12 содержится в ферментных системах в виде В12-ко-ферментов или кобамидных коферментов метилкобаламина, содер-жащего дополнительную метильную группу, и дезоксиаденозин-кобаламина, содержащего 5-дезоксиаденозинкобаламин. Так, метил-кобаламин выполняет функции переносчика метильной группы в реакции синтеза метионина. Кроме того, витамин В12 необходим для образования эритроцитов. Недостаток витамина12 приводит к нарушениям деятельности нервной системы и вызывает резкое снижение кислотности желудоч-ного сока. 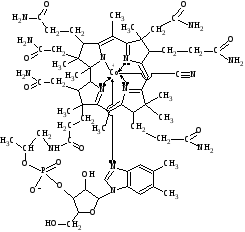 Схема образования связей в витамине B12 (кобаламине) Ферменты Ферментами называют класс веществ белковой природы, катали-зирующих большое число химических реакций. Ферменты обеспечи-вают реализацию генетической информации, а также обмен веществ и энергии. Ферменты отличаются от неорганических катализаторов значительно большей активностью и высокой специфичностью действия: один фермент, как правило, катализирует только одну химическую реакцию. Действующим началом фермента карбоксипептидазы, катализи-рующего процессы гидролиза, является ион Zn2+. Ион цинка оттягивает на себя электроны карбонильной группы С = O в пептиде ( СО NH ), в результате связь С = O еще больше поляризуется, что облегчает гидролиз и разрыв СN связи. Ионы цинка также входят в состав фермента карбоангидразы, который катализирует гидратацию СО2, т. е. образование иона НСО3, и в тоже время участвует в каталитическом разложении НСО3, которое сопровождается выделением СО2. Первая реакция протекает в альвеолах легких, вторая (обратная) в клетках. Некоторые другие комплексные соединения металлов, играющие определенную биологическую роль, приведены в таблице 2. Таблица 2. Биологически важные комплексы металлов.
Токсикологическая роль комплексообразования Токсическое действие большинства тяжелых металлов (ртуть, свинец, таллий и др.) объясняется способностью ионов этих металлов образовывать прочные комплексы с белками, ферментами и амино-кислотами, В результате подавляется активность ферментов и происходит свертывание белков. Например, ионы ртути Hg2+ образуют прочные комплексы с белками, имеющими в своем составе SH-группы. Таким образом, ртуть концентрируется в тканях и органах, богатых этими белками, а именно в почках, головном мозге, слизистой оболочке рта. Свинец удерживается белками эритроцитов, затем поступает в плазму крови в виде комплексов с гамма-глобулином и, наконец, достигает почек, печени и других органов. Свинец также накапливается в костной ткани. Некоторые агенты, способные образовывать прочные комплексы с ионами металлов, используются в качестве антидотов при бытовых и профессиональных отравлениях соединениями тяжелых металлов, а также при хронических интоксикациях, вызванных передозировкой лекарственных препаратов. Так, внутривенное введение ЭДТА позволяет вывести из организма избыточные ионы Ca2+ в виде прочного комплекса, что снижает вероятность образования камней в почках и в желчном пузыре. При отравлениях соединениями ртути, сурьмы и мышьяка внутривенно вводят димеркапрол (2,3-димеркаптопропанол-1), кото-рый не только снижает токсическое действие этих элементов, но и выводит их из организма в виде комплексов: 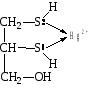 Позднее в употребление была введена 2,3-димеркаптоянтарная кислота, которую вводят перорально: 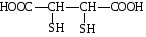 При отравлениях соединениями меди используют пеницилламин: 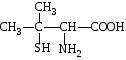 Комплекс меди с пеницилламином выводится вместе с мочой. Эталоны решения задач Пример 1. Для комплексного соединения [Сr(NН3)5С1]С12 определить заряд комплексообразователя, указать координационное число (к.ч.), дать название по международной номенклатуре, написать уравнения первичной и вторичной диссоциации и составить выражение для константы нестойкости комплексного иона. Решение. 1) заряд комплексного иона равен +2, следовательно, алгебраи-ческая сумма зарядов внутренней сферы: x + 0 1 = 2, x = +3; 2) все лиганды монодентатные, следовательно, к.ч. = 6; 3) название: хлорид хлоропентамминхрома (III); 4) уравнения диссоциации: [Сr(NН3)5С1]С12 [Сr(NН3)5С1]2+ ⇄ Сr3+ + 5NН3 + С1 (вторичная). 5) выражение для константы нестойкости: 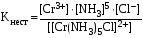 . .Пример 2. Назовите КС: [CrBr(H2O)5]SO4; Na2[FeCl5NO]. Для анионного КС укажите ц.а.; лиганды, донорные атомы лигандов; координационное число ц.а.; внешнюю и внутреннюю сферы КС. Для катионного КС напишите уравнения первичной и вторичной диссоциации и выражение для общей константы нестойкости. Ответ: [CrBr(H2O)5]SO4 – сульфат бромопентааквахрома (III); Na2[FeCl5NO] – пентахлоронитрозилферрат (III) натрия. Na2[FeCl5NO] – анионное КС: Fe 3+ – ц.а.; к.ч. – 6; 5Cl - , NО – лиганды, донорный атом в лиганде Cl - – Cl, в NО – O; 2Na + – внешняя сфера, [FeCl5NO] 2- – внутренняя сфера. [CrBr(H2O)5]SO4 – катионное КС: [CrBr(H2O)5][CrBr(H2O)5]SO4 2+ + SO4 2- [CrBr(H2O)5] 2+ Cr3+ + Br - + 5H2O [Cr3+ ] ∙[ Br - ]∙[ H2O]5 Kн =[ [CrBr(H2O)5] 2+ ] |
