Конспект лекций для студентов всех специальностей дневной и заочной формы обучения
 Скачать 0.71 Mb. Скачать 0.71 Mb.
|
|
Метод валентных связей или локализованных электронных пар. Его основные положения: 1. Химическая связь между двумя атомами возникает в результате перекрывания атомных орбиталей (АО) с образованием электронных пар. 2. Атомы, вступающие в химическую связь, обмениваются между собой электронами, которые образуют связывающие пары. 3. В соответствии с принципом Паули химическая связь образуется лишь при взаимодействии электронов с антипараллельными спинами. 4. Характеристики химической связи (энергия, длина, полярность и др.) определяются типом перекрывания АО. Согласно теории валентных связей, ковалентная связь направлена в сторону максимального перекрывания АО реагирующих атомов. Следует отметить, что электронная структура молекулы существенно отличается от электронной структуры образующих ее атомов. Изменения претерпевает электронная структура внешних оболочек и подоболочек атомов. У атомов в молекуле сохраняются лишь электронные конфигурации внутренних электронных оболочек, не перекрывающихся при образовании связей. Валентность по обменному механизму МВС. Способность атома присоединять или замещать определенное число других атомов с образованием химических связей называется валентностью. Количественной мерой валентности считают число неспаренных электронов у атома в основном или возбужденном состоянии. Это неспаренные электроны внешних оболочек у s- и р-элементов, внешних и предвнешних оболочек у d- элементов, внешних, (n-1) и (n-2) оболочек у f- элементов. При образовании химической связи атом может переходить в возбужденное состояние в результате разъединения пар электронов и переходе одного из них на свободную орбиталь той же оболочки. Пример. Са: ...4s24р°, валентность В = 0. При возбуждении Са+h=Са* Са*: ... 4s14p1, В=2. Таким образом, атом кальция может проявлять валентность равную 0 и 2. Если в соединении кроме ковалентных связей, образованных по обменному механизму, есть связи, образованные по донорно-акцепторному механизму, то суммарная валентность элемента равна числу неспаренных электронов плюс число связей, образованных по донорно-акцепторному механизму. Например, в ионе аммония азот проявляет валентность, равную 4 (cмотри выше). Пространственная структура молекул. Так как АО ориентированы в пространстве, то и ковалентная связь характеризуется направленностью. -связь - это связь, образованная перекрыванием АО по линии, соединяющей ядра взаимодействующих атомов, -связь возникает при перекрывании s-s, s-p, р-р и d-d орбиталей; обычно она охватывает два атома и является локализованной двухцентровой связью. -связь образована перекрыванием АО по обе стороны линии, соединяющей ядра атомов, может образовываться при р-р, р-d, d-d, f-p,f-d и f-f орбиталей. -связь образуется при перекрывании d-орбиталей всеми четырьмя лепестками, то есть при перекрывании d-орбиталей, находящихся в параллельных плоскостях. - и - связи могут налагаться на -связь с образованием кратных связей (двойных и тройных). Например, в молекулах С2Н4, СО2 имеются двойные связи СН2=СН2, О=С=О; в молекулах С2Н2, N2 - тройная связь: СН≡СН, N ≡ N. Гибридизация АО. При образовании молекул происходит изменение формы и энергии АО. Вместо неравноценных, например, s- и р- орбиталей в молекуле метана СН4 образуются равноценные (гибридные, смешанные) орбитали, имеющие одинаковую форму и энергию. При образовании гибридных связей выделяется больше энергии, энергия системы понижается и образованная молекула более устойчива. Гибридизация АО приводит к более симметричному распределению электронной плотности в молекуле. s-р -гибридизация дает две гибридные орбитали, расположенные под углом 180°. Смешение одной s и двух р-орбиталей (sр2-гибридизация) приводит к образованию трех гибридных орбиталей, расположенных друг к другу под углом 120°. sр3 - гибридизация дает четыре связи, расположенные под углом 109°28/, то есть образующие тетраэдр. Полярные и неполярные молекулы. В неполярных молекулах центры тяжести положительных и отрицательных зарядов совпадают, в полярных - нет. Полярные молекулы являются диполями, имеющими заряды + и -, находящимися на расстоянии 1Д. Для оценки полярности молекул используют электрический момент диполя μ= 1д-. Если связь неполярная, то и молекула неполярная. Если связи, образующие молекулу, полярные, то μ равен векторной сумме электрических моментов диполей связи, и молекула может быть как неполярной, так и полярной. Например, молекула СО2 (О=С=О) неполярна, хотя связи С=О полярные, так как при сложении происходит компенсация диполей О← С→О и суммарный электрический диполь молекулы равен нулю. А молекула воды полярна, так как при сложении диполей связей образуется диполь молекулы, не равный нулю: H  O H  Метод молекулярных орбиталей (ММО). Метод валентных связей не может объяснить некоторые явления и факты, например, парамагнитность молекулы О2 (то есть наличие неспаренных электронов). ММО является более универсальным методом, в его рамках эти явления объяснимы. Основные положения метода: электроны в молекулах распределены по молекулярным орбиталям (МО), которые, подобно АО, характеризуются определенной энергией и формой. МО охватывают всю молекулу, то есть являются двух- и более центровыми. В ММО используется линейная комбинация атомных орбиталей (ЛКАО). При этом соблюдаются следующие правила: 1. Число МО равно общему числу АО, из которых комбинируется МО; 2. Энергия МО может быть ниже и выше исходных АО; 3. Электроны МО, как и АО, заполняют в порядке возрастания энергии при соблюдении принципа запрета Паули и правила Гунда; 4. Наиболее эффективно комбинируются АО с сопоставимыми энергиями и симметрией; 5. Прочность связи в методе МО пропорциональна степени перекрывания АО. Связывающие и разрыхляющие орбитали. Если АО атомов А и В обозначить через ΨA и ΨВ, а МО через ΨАВ, то согласно ЛКАО ΨАВ = а ΨA ± в ΨВ, где ΨАВ - волновая функция электрона в молекуле (МО), а и в - коэффициенты, учитывающие долю каждой АО в образовании МО, ΨA и ΨВ - волновые функции электрона (АО) в атомах А и В. При знаке «+» в уравнении получается связывающая МО (, , δ), при знаке «–« - разрыхляющие МО (МО*: *, *, δ* ).    МО * МО *   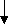 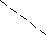  АО АО АО АО 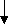 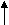 МО Диаграмма энергетических уровней АО и МО молекулы водорода. При заполнении связывающих орбиталей соблюдаются следующие правила: а) число МО равно общему числу АО, из которых комбинируется МО; б) энергия МО может быть выше и ниже исходных АО; в) электроны МО как АО заполняют в порядке возрастания энергии при соблюдении принципа запрета Паули и правила Гунда; г) наиболее эффектно комбинируются АО с сопоставимыми энергиями и симметрией; д) прочность связи в методе МО пропорциональна степени перекрывания АО. При заполнении связывающих орбиталей снижается энергия молекулы и образуется прочная связь. Разрыхляющие МО имеют пониженную электронную плотность, они не связывают атомы в молекулу и называются антисвязывающими МО. Порядок и энергия связи. Порядок связи n = (Nсв–Nр)/2, где Nсв – число электронов на связывающих МО, Nр - на разрыхляющих, 2 – число взаимодействующих атомов. Порядок связи может быть не только целым, но и дробным: n= 1, 3/2, и т.д. Энергия связывающих МО ниже энергии разрыхляющих МО. Энергия связи возрастает при переходе от комбинаций АО первой оболочки к комбинациям АО второй и других оболочек с более высокими главными квантовыми числами. Энергия МО, образуемых из s-АО, ниже энергии МО, образуемых из р-АО или d-АО. 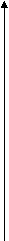  E E      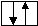  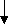 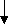 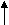 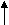 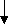 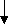         Диаграмма энергетических уровней АО и МО молекулы О2. Порядок связи n = (6-2)/2 = 2. На разрыхляющей р-орбитали имеются два неспаренных электрона, поэтому молекула парамагнитна. Сравнение МВС и ММО Оба метода имеют общие положения: 1) они дают одинаковое распределение электронной плотности в соединениях; 2) связь образуется за счет перекрывания АО, причем прочность связи растет с увеличением электронной плотности в области связи; 3) в зависимости от типа АО образуются -, - и δ- связи. Метод ММО более универсален, может объяснить характер связей у более широкого круга соединений, более приспособлен для машинных расчетов, однако он более сложен, менее нагляден и более формален. 4. Межмолекулярные связи К основным видам межмолекулярного взаимодействия относят вандерваальсовы силы, водородные связи и донорно-акцепторные взаимодействия. Вандерваальсовы силы обуславливают притяжение межу молекулами и включают в себя три составлющие: диполь- дипольное взаимодействия, индукционное и дисперсионное взаимодействия. 1. Диполь- дипольное взаимодействие происходит за счет ориентации диполей: 2   . Индукционное взаимодействие. При воздействии диполей на неполярные молекулы возникают наведенные диполи: . Индукционное взаимодействие. При воздействии диполей на неполярные молекулы возникают наведенные диполи:3       . Дисперсионное притяжение возникает за счет возникновения мгновенных диполей и их суммирования: . Дисперсионное притяжение возникает за счет возникновения мгновенных диполей и их суммирования:    Энергия вандерваальсовых взаимодействий невелика и выражается уравнением: Водородная связь - это химическая связь, образованная положительно поляризованным водородом, химически связанным в одной молекуле, и отрицательно поляризованным атомом фтора, кислорода и азота (реже хлора, серы и др.), принадлежащих другой молекуле. Водородная связь может быть внутримолекулярной, если она образуется между двумя группами одной и той же молекулы, и межмолекулярной, если она образуется между разными молекулами (А-Н + В-К = А-Н...В-К). Энергия и длина водородной связи. Энергия возрастает с увеличением электроотрицательности (ЭО) и уменьшением размеров атомов. Водородная связь более прочная, чем вандерваальсово взаимодействие, но менее прочная, чем ковалентная связь. Аналогичную зависимость имеет и длина связи. Н   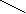  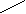 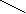 0,036 О Н 0,177 О 0,036 О Н 0,177 ОО 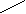  + Н Н = О......Н Н + Н Н = О......Н НН Н F–H + F- = [ F–H…H ]– 0.092 0.126 Водородные связи очень распространены, так как многие соединения содержат ковалентные полярные связи Н-О и Н-N, например, вода, кристаллогидраты, белки. Многие физические свойства веществ с водородной связью выпадают из общего хода их изменения в ряду атомов. Так, летучесть ассоциированных аномальна мала, а вязкость, диэлектрическая постоянная, теплота парообразования, температура кипения аномально повышенные. В ряду H2O – Н2S - Н2Se – H2Te свойства воды резко отличаются от свойств других веществ. Если бы вода не обладала водородными связями, она имела бы температуру плавления не 0°С, а (-100°С), и температуру кипения не 100°С, а -80°С. Водородная связь влияет и на химические свойства веществ. Так, HF - слабая кислота, тогда как НС1 - сильная. Причина в том, что HF образует с помощью водородной связи дифторид-ионы и другие более сложные ассоциаты. 5. Комплексные соединения Комплексные соединения образуются за счет донорно-акцепторных связей (по другому они называются также координационными соединениями). Так, атом азота в аммиаке (донор) отдает на связь пару электронов, а атом бора (акцептор) -вакантную орбиталь. В результате образуется ковалентная связь: H F H F ׀ ׀ ׀ ׀ H-N: + B-F = H-N-B-F ׀ ׀ ׀ ׀ H F H F По координационной теории Вернера комплексные соединения состоят из двух сфер: внешней и внутренней, например: [Сu(NН3)4]SО4; SО42- - внешняя сфера, [Сu(NН3)4]+2 - внутренняя, которая включает центральный ион - комплексообразователь Сu2+ и лиганды NНз. Лигандами могут быть молекулы аммиака или гидроксил-анионы: [Zn(ОН)4]2-. Число лигандов, координируемых комплексообразователем, называется координационным числом, в данных примерах оно равно 4. В зависимости от заряда различают анионные [РF6]- , [Zn(СN)4]2- и катионные [Сu(NН3)4]2+, [Ni(Н2О)4]2+. Заряд комплекса равен алгебраической сумме заряда центрального иона и заряда лигандов. 6. Кристаллическое строение вещества Большинство твердых тел находится в кристаллическом состоянии, которое характеризуется дальним порядком, то есть трехмерной периодичностью структуры по всему объему твердого тела (кристаллической решеткой). Кристаллические вещества имеют определенную температуру плавления, энергию и постоянную кристаллической решетки и координационное число. Координационным числом называется число частиц, непосредственно примыкающих к данной частице в кристалле. Постоянная решетки характеризует расстояние между центрами частиц, занимающих узлы в кристалле. Энергия кристаллической решетки - это энергия, необходимая для разрушения 1 моль кристалла и удаления частиц за пределы их взаимодействия. По природе частиц в узлах кристаллической решетки и природе химических связей между ними все кристаллы делятся на молекулярные, атомно-ковалентные, ионные и металлические. Кроме того, существуют кристаллы со смешанными химическими связями. Молекулярные кристаллы. В узлах решетки находятся молекулы, между которыми действуют вандерваальсовы силы или водородные связи. Энергия кристаллической решетки невысока (5-25 кДж/моль), молекулярные кристаллы имеют низкие температуры плавления и кипения. Основные свойства кристаллов приведены в таблице 1. Атомно-ковалентные кристаллы. В узлах кристаллов располагаются атомы, связанные ковалентными связями. Это обуславливает высокую энергию решетки и физические свойства веществ. Из-за направленности ковалентных связей координационные числа и плотность упаковки в атомно-ковалентных кристаллах обычно невелики. Свойства кристаллов см в табл. 1. Ионные кристаллы. Структурные единицы - ионы, связанные между собой силами электростатического взаимодействия. Энергия кристаллической решетки велика. Свойства кристаллов приведены в таблице 1. Металлические кристаллы и связь. Большинство элементов периодической таблицы Д.И. Менделеева относятся к металлам, которые имеют общие свойства: высокую электропроводность (106 - 108 См), теплопроводность, ковкость, пластичность, металлический блеск, высокую отражательную способность по отношению к свету. Общие свойства металлов можно объяснить особым типом химической связи, называющейся металлической. У большинства металлов на внешней электронной оболочке имеется значительное число вакантных орбиталей и малое число электронов. Поэтому энергетически более выгодно, чтобы электроны были не локализованы, а принадлежали всему металлу. По теории свободных электронов в узлах решетки находятся катионы металла, погруженные в электронный «газ». Между ионами металла и нелокализованными электронами существует электростатическое взаимодействие. Энергия этого взаимодействия является промежуточной между энергиями ковалентных и молекулярных кристаллов. Свойства кристаллов приведены в таблице 1. Кристаллы со смешанными связями. Тот или иной вид химической связи или взаимодействия в чистом виде в кристаллах встречается редко. В некоторых молекулярных кристаллах (Н2О, Н2О2, НF) наряду с вандерваальсовыми возникают водородные связи, которые значительно упрочняют кристаллы. Ионная связь в чистом виде практически не существует, так как в ионных кристаллах также действует ковалентная связь, поэтому можно говорить о той или иной степени ионности. В атомных кристаллах наряду с ковалентной связью могут существовать вандерваальсовы силы, например, у графита. Таблица 1 Типы кристаллов и свойства веществ
Тема: Химическая термодинамика План 1. Общие закономерности протекания химических процессов 2. Первый закон термодинамики. Энтальпия. 3. Законы Гесса и Лавуазье-Лапласа. 4. Второй, третий законы термодинамики. Энтропия. 5. Направленность химических процессов. Свободная энергия Гиббса. При протекании химических реакций изменяется энергетическое состояние системы, в которой идет эта реакция. Химическая система представляет собой частный случай термодинамической. Если между системой и окружающей средой отсутствует массо- и теплообмен, то она называется изолированной. Если отсутствует массообмен, но возможент теплообмен, то система является закрытой. Система может быть также открытой (возможен и массо- и теплообмен). Система, состоящая из нескольких фаз, называется гетерогенной, однофазная система - гомогенной. Состояние системы определяется термодинамическими параметрами (р, С, Т, V и другими). Изменение хотя бы одного из параметров влечет за собой изменение состояния системы. В термодинамике свойства системы рассматривают при ее равновесном состоянии. В настоящее время развивается термодинамика неравновесных процессов, но ее изучение не входит в нашу задачу. Состояние системы называют равновесным, если его термодинамические параметры одинаковы во всех точках системы и не изменяются самопроизвольно во времени. Термодинамика изучает переходы системы из одного состояния в другое, переходы химической энергии в другие виды (тепловую, электрическую и др.), устанавливает количественные законы этих переходов, а также направление и пределы самопроизвольного протекания химических реакций в заданных условиях. Если процессы перехода системы происходят при постоянстве каких-либо параметров, то они называются: 1) изобарными (р=const, либо Δр=0); 2) изохорными (V=const, либо ΔV=0); 3) изотермическими (Т=const, либо ΔT=0); 4) адиабатическими (q-const, либо Δq=0). Состояние системы можно представить в виде уравнения состояния, связывающего все параметры системы: f (р, V, Т)=0. Конкретный вид уравнения состояния известен лишь для ограниченного числа наиболее простых объектов. Например, уравнение Клапейрона-Менделеева описывает состояние идеального газа. Для большинства реальных систем уравнение состояния в явном виде неизвестно, поэтому для термодинамического описания системы используют функции состояния, которые называют также характеристическими функциями: внутреннюю энергию U, энтальпию Н, энтропию S, энергию Гиббса G, энергия Гельмгольца F. Значения этих функций не зависят от характера процессов, приводящих систему к данному состоянию, и определяется только параметрами системы (р, V, Т, С). | |||||||||||||||||||||||||||||||||||||||
