Конспект лекций для студентов всех специальностей дневной и заочной формы обучения
 Скачать 0.71 Mb. Скачать 0.71 Mb.
|
|
Растворимость. При растворении веществ возникает равновесие, при котором скорость растворения фазы равна скорости ее образования. Растворенное вещество (фаза) ↔ раствор При равновесии изменение энергии Гиббса равно нулю. Раствор, в котором устанавливается равновесие между растворением и образованием (осаждением, кристаллизацией, выделением вещества), называется насыщенным, а концентрация такого раствора — растворимостью. Растворимость газов уменьшается с увеличением температуры. Растворимость твердых веществ может как увеличиваться, так и уменьшаться, а также мало зависеть от температуры. Растворимость вещества зависит от свойств растворителя. Вещества с одинаковым характером связей имеют большую тенденцию к взаимной растворимости - подобное растворяется в подобном. Например, полярные и ионные вещества хорошо растворимы в полярных растворителях, неполярные - в неполярных растворителях. Общие свойства растворов - те свойства, которые не зависят от природы растворенных веществ, а только от их концентрации. Они также называются коллигативными. Такие свойства характерны для идеальных растворов. Идеальным называют раствор, в котором не происходит химической реакции между компонентами, а силы межмолекулярного взаимодействия между компонентами одинаковы. Энтальпия образования такого раствора равна нулю, каждый компонент является независимым от других. К идеальным растворам по своим свойствам приближаются лишь очень разбавленные растворы. К общим свойствам растворов относят понижение давления насыщенного пара растворителя над раствором и температуры замерзания, повышение температуры кипения и осмотическое давление. Растворенным веществом в таких растворах является нелетучее вещество, давлением пара которого можно пренебречь. Закон Рауля. Понижение давления насыщенного пара растворителя А над раствором ΔрА пропорционально молярной доле растворенного нелетучего вещества хв: р°А – рА = Δр а = р°А хВ, где р°а, ра - давления насыщенного пара растворителя соответственно над чистым растворителем и раствором. Из уравнения видно, что с увеличением содержания нелетучего растворенного вещества давление пара растворителя над раствором уменьшается, то есть р°а>ра. Из закона Рауля следует: 1. Температура кипения раствора выше температуры кипения растворителя, потому что давление насыщенного пара растворителя над раствором становится равным атмосферному (условие кипения жидкости) при более высокой температуре, чем в случае чистого растворителя. Повышение температуры кипения пропорционально моляльности раствора: ΔТкип=КэСm. Здесь Кэ - эбуллиоскопическая константа растворителя. 2. Температура замерзания (кристаллизации) раствора ниже температуры замерзания чистого растворителя, потому что давление пара растворителя над раствором ниже, чем над растворителем. Понижение температуры замерзания пропорционально моляльности раствора: ΔТ3ам=КкСm. Здесь Кк - криоскопическая константа. Значения эбуллиоскопической и криоскопической констант зависят от природы растворителя; для воды они составляют соответственно 0,52 и 1, 85 кг·К/моль. Используя следствие из закона Рауля, можно определить молярную массу вещества. Для этого экспериментально определяют изменение температуры кипения или замерзания раствора. Зная массу растворенного вещества mв, его молярную массу находят по уравнению: где К - либо эбулио-, либо криоскопическая константы. Закон Вант-Гоффа. Самопроизвольный переход растворителя через полупроницаемую мембрану, разделяющую раствор и растворитель, либо два раствора с различной концентрацией растворенного вещества, называется осмосом. Перегородка пропускает только молекулы растворителя, которые переходят из раствора с меньшей концентрацией в более концентрированный раствор. Концентрированный раствор разбавляется и увеличивается высота его столба. Количественно осмос характеризуют осмотическим давлением, равным силе, приходящейся на единицу площади поверхности и заставляющей молекулы растворителя проникать через полупроницаемую перегородку. Осмотическое давление возрастает с увеличением концентрации растворенного вещества и температуры. Вант-Гофф предложил для осмотического давления применить уравнение состояния идеального газа V=nRТ, или =nRТ/V. Отсюда =СRТ - осмотическое давление. С -молярная концентрация раствора. Осмос играет важную роль в биологических процессах, обеспечивая поступление воды в клетки и другие структуры. Растворы с одинаковым осмотическим давлением называются изотоническими; если осмотическое давление выше внутриклеточного, то оно называется гипертоническим, ниже -гипотоническим. Среднее осмотическое давление крови при 36°С равно 78 кПа. Гипертонические растворы, например, соли и сахара (рассол), широко применяют для консервирования овощей (огурцов), так как они вызывают удаление воды из микроорганизмов. Огурцы в крепком рассоле сморщиваются, в гипотоническом растворе - разбухают. Законы Рауля и Вант-Гоффа соблюдаются лишь в разбавленных растворах неэлектролитов, являющихся моделью идеальных растворов, в реальных растворах вместо концентрации используется активность, о которой подробно будет сказано в следующей лекции. Тема: «Растворы электролитов» План 1. Растворы электролитов. Основные положения теории электролитической диссоциации. 2. Степень электролитической диссоциации. 3. Сильные и слабые электролиты. Константа диссоциации. 4. Активность электролитов. Применение законов Рауля и Вант-Гоффа к растворам электролитов. 5. Диссоциация воды. Ионное произведение воды. Водородный показатель. 6. Ионно-молекулярные реакции в растворах. Произведение растворимости. 7. Реакции нейтрализации и гидролиз солей. Общие свойства растворов электролитов Вещества, растворы или расплавы которых проводят электрический ток, называются электролитами. Свойства электролитов были рассмотрены и обобщены в трудах Аррениуса, развиты в трудах И.А. Каблукова, В.А. Кистяковского, на основе гидратной теории растворения Д.И. Менделеева. Основные положения теории электролитической диссоциации (ионизации): 1. При растворении солей, кислот и оснований в воде происходит диссоциация (ионизация) этих соединений с образованием электрически заряженных частиц -катионов и анионов. 2. Электрическая проводимость растворов солей, кислот и оснований в воде прямо пропорциональна общей концентрации ионов в растворе. Уравнение электролитической диссоциации можно записать, опустив промежуточные стадии, указав лишь начальные и конечные продукты реакции: АВ+(n+m)Н2О ↔ АР+nН2О + Вq–mН2О (1) Коэффициенты n и m меняются с изменением концентрации, температуры и других параметров раствора. Поэтому молекулы растворителя обычно опускают и записывают: АВ ↔Ap+ + Вq–. Растворами электролитов являются растворы щелочей, солей и неорганических кислот в воде и других полярных растворителях (жидком аммиаке, ацетонитриле и др.). Растворы электролитов являются ионными проводниками (проводниками второго рода). В растворах электролитов наблюдаются отклонения от законов Вант-Гоффа и Рауля. По закону Рауля при растворении 0,1 моль неэлектролита (глюкозы) в 1000 г воды температура замерзания снижается на 0,186 К. Поэтому Вант-Гофф ввел в уравнение =СRТ поправочный коэффициент i, который назван изотоническим коэффициентом. Для любых разбавленных растворов Росм=iСRТ. Изотонический коэффициент характеризует отклонение от законов идеальных растворов вследствие электролитической диссоциации. Здесь Степень диссоциации электролитов. Отношение числа молекул, диссоциированных на ионы, к общему числу молекул растворенного электролита называется степенью диссоциации (ионизации) ά: ά = n/nо, где n - число частиц, подвергшихся диссоциации, nо - общее число растворенных частиц. По степени диссоциации электролиты делятся на слабые (ά <3%) и сильные (ά >30%). Степень диссоциации зависит от природы (полярности) растворителя. Чем более полярна молекула растворителя, тем при прочих равных условиях выше степень ионизации растворенного вещества. Поскольку электролитическая диссоциация сопровождается тепловым эффектом, то ά зависит от температуры, причем ее влияние можно оценить по принципу Ле-Шателье: если диссоциация представляет собой эндотермический процесс, то с повышением температуры степень диссоциации растет, с понижением температуры уменьшается. Сильно влияет на степень электролитической диссоциации концентрация раствора. Если рассматривать диссоциацию как равновесный обратимый химический процесс, то в соответствии с принципом смещения равновесия разбавление водой увеличивает количество диссоциированных молекул, то есть степень диссоциации с разбавлением растет. Константа диссоциации Процесс электролитической диссоциации удобнее характеризовать константой диссоциации, применив к нему законы химического равновесия. Так, для реакции КА↔К++А– константа диссоциации величина Это соотношение называется законом разбавления Оствальда. Для слабых электролитов, когда ά много меньше 1, Из уравнения Оствальда следует, что ά уменьшается с увеличением концентрации слабого электролита. Например, при разбавлении раствора в 1 00 раз степень диссоциации возрастает в 10 раз. В растворах слабых электролитов взаимодействие ионов друг с другом относительно невелико, вследствие их незначительной концентрации. Сильные электролиты в растворах диссоциированы практически полностью, поэтому концентрация их ионов велика и свойства таких растворов зависят от степени взаимодействия образующихся ионов друг с другом и с полярными молекулами растворителя. За счет этого взаимодействия создается впечатление, что диссоциация прошла и в растворе имеется некоторое количество недиссоциированных молекул. Поэтому ά, определяемая в растворах сильных электролитов экспериментально, является кажущейся и ее значение менее 100%. Поэтому для растворов сильных электролитов не применимы законы идеальных растворов. Чтобы эти законы использовать для описания реальных растворов, Льюис ввел представление об эффективной концентрации - активности а: а=γС, где С - концентрация, γ - коэффициент активности (величина безразмерная). Активность и концентрация измеряются в одних и тех же единицах. Коэффициент активности характеризует степень отклонения свойств данного раствора от свойств идеального. Для бесконечно разбавленных растворов электролитов, где практически отсутствует взаимодействие ионов, а=С и γ=1. Если вместо С в уравнения Вант-Гоффа, Рауля, Оствальда подставлять экспериментальные значения а, то уравнения остаются справедливыми и для сильных электролитов, и вообще для любых реальных растворов. Вода служит не только наиболее распространенным растворителем, но и сама является идеальным амфолитом. Процесс диссоциации воды называется самоионизацией или автопротолизом, и может быть записан: Н2О+Н2О↔Н3О++ОН–. Часто этот процесс записывают в более простом виде: Н2О↔Н++ОН–. Константа диссоциации этого процесса 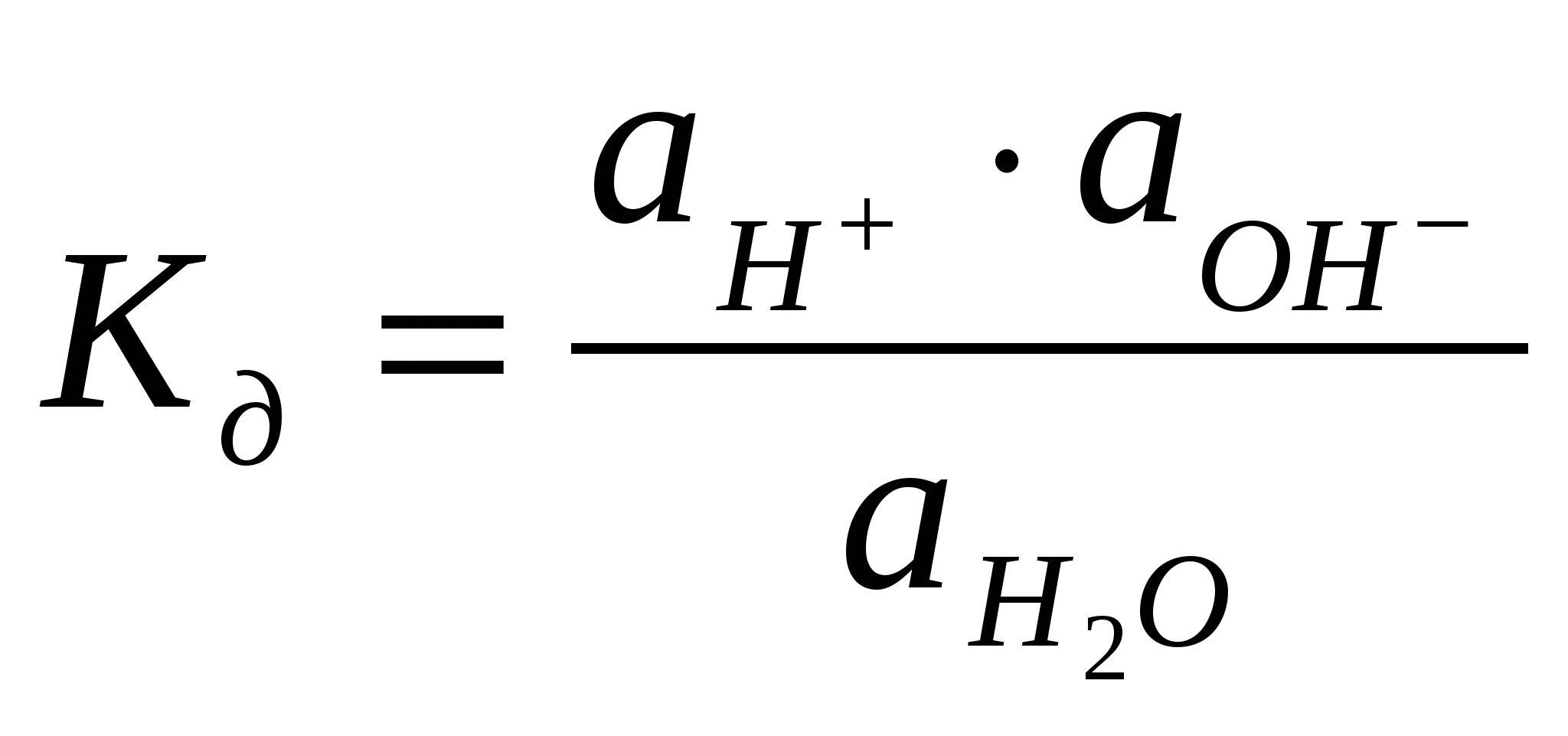 . .Так как вода - слабый электролит, можно использовать данные выражения с учетом того, что концентрация воды постоянна: [Н2О]=55,56 моль/л. Тогда [Н+][ОН-]=55,56 Ионы водорода являются носителями кислотных свойств, гидроксил-анионы - щелочных. Поэтому при равенстве этих ионов раствор будет нейтральным. Для характеристики кислотности (щелочности) среды введен водородный показатель рН=-lg[Н+]. При рН=7 среда нейтральная, для кислых растворов рН меньше 7, для щелочных рН больше 7. Аналогичным образом реакция среды может быть охарактеризована гидроксильным показателем рОН=-lg[ОН–]. Для воды рН=рОН=7, рН+рОН=14. Рассмотрим обменную реакцию КС1+АgNОз=АgС1+КNО3. Равновесие в такой реакции смещено вправо, так как хлорид серебра - малорастворимое соединение. Для насыщенного раствора АgС1, находящегося в равновесии с твердой фазой (осадком), будет характерен следующий процесс: АgCl↔Аg++С1–. Константа равновесия этого гетерогенного процесса Кр=Пр= [Аg+][С1–]. Она не зависит от концентрации твердой фазы (АgС1), является постоянной величиной при данной температуре. Эту величину называют произведением растворимости Пр. Более строго в Пр используют не концентрации, а активности ионов электролита Пр= Реакции нейтрализации и гидролиз солей К обменным реакциям в растворах относят взаимодействие между кислотами и основаниями, в результате которых образуется соль и вода. Такие реакции называются реакциями нейтрализации и доходят до конца только тогда, когда единственным малодиссоциированным веществом в системе является вода, например: НС1 + КОН = КС1 + Н2О. Сокращенное ионное уравнение этого процесса Н++ОН–=Н2О. Оно показывает, что равновесие полностью смещено в сторону образования воды. Взаимная нейтрализация кислот и оснований, отличающихся друг от друга по силе, до конца не протекает. Так, при взаимодействии слабой уксусной кислоты с гидроксидом калия в системе из четырех веществ два слабодиссоциированы: СНзСООН + КОН ↔ Н2О + СНзСООК, или в сокращенном ионном виде СНзСООН + ОН– ↔ Н2О + СНзСОО–. Эта реакция обратима. Обратная реакция - взаимодействие соли и воды - называется реакцией гидролиза. Гидролизу подвергаются соли, образованные: 1) Слабым основанием и сильной кислотой; 2) сильным основанием и слабой кислотой; 3) слабыми основанием и кислотой. Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются. Приведем примеры реакций гидролиза. Гидролиз соли, образованной сильным основанием и слабой кислотой - ацетата натрия. Соль в растворе полностью диссоциирует: СНзСООNa ↔ СНзСОО– + H+. Гидролиз в ионной форме: СН3СОО-+Н2О↔СН3СООН+ОН-. В результате гидролиза реакция среды стала основной (избыток ОН-), рН>7. Показателем глубины протекания гидролиза является степень гидролиза β: β=Сгидр/С, где Сгидр – концентрация гидролизованных молекул, С – исходная концентрация растворенных молекул соли. Гидролиз – процесс эндотермический, поэтому, в соответствии с принципом Ле-Шателье, с повышением температуры степень гидролиза увеличивается. Принимая, что в разбавленных растворах активность ионов мало отличается от их концентрации (С=а), можно записать константу равновесия 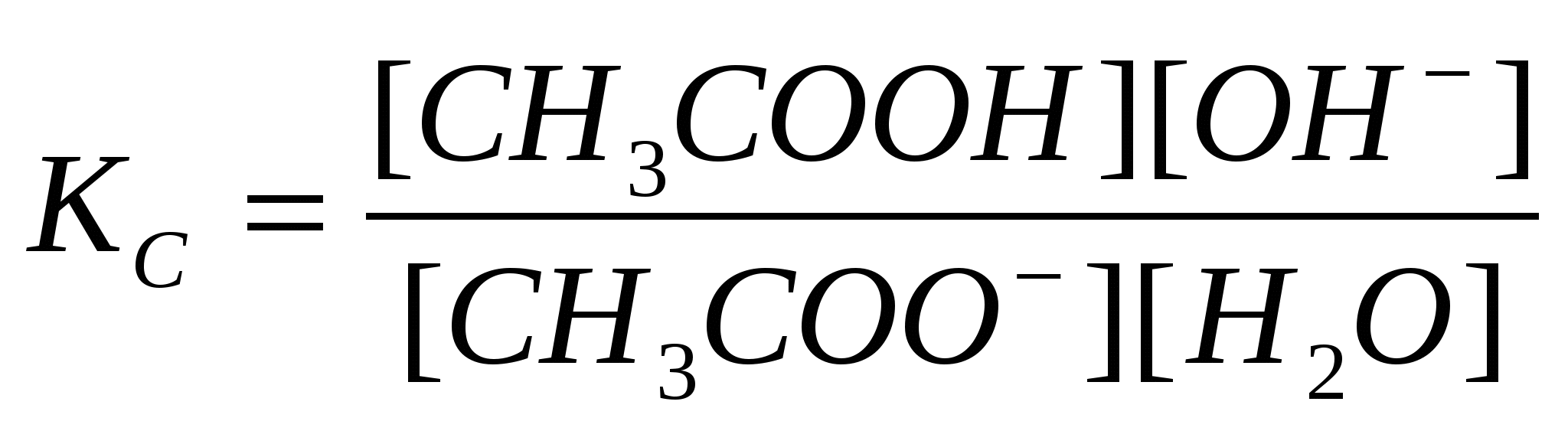 . Так как концентрация воды при гидролизе изменяется мало, принимаем ее постоянной, и, Кс[Н2О]=КГ, получаем константу гидролиза: . Так как концентрация воды при гидролизе изменяется мало, принимаем ее постоянной, и, Кс[Н2О]=КГ, получаем константу гидролиза: 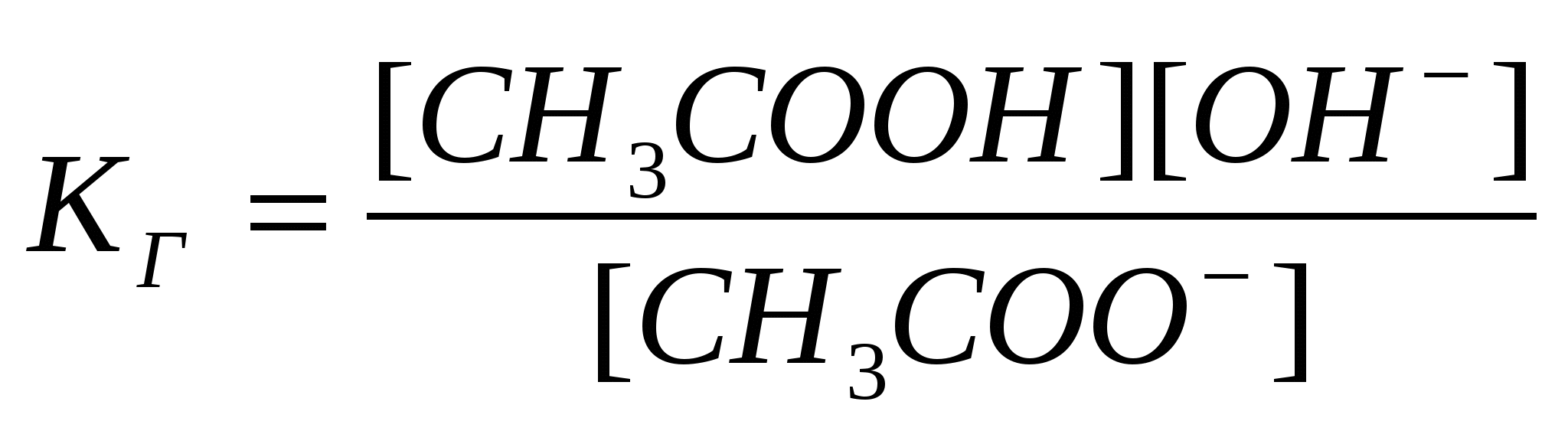 . Подставляя вместо [ОН-]=Kw/[H+], получаем: . Подставляя вместо [ОН-]=Kw/[H+], получаем: Отсюда следует, что гидролиз идет тем глубже, чем ниже константа диссоциации слабого электролита, образующегося при гидролизе. Гидролиз солей, образованных сильной кислотой и слабым основанием, например, хлорида аммония: NH4Cl↔NH4+ + Cl- (диссоциация соли) NH4+ + H2O ↔ NH4OH + H+, среда кислая, рН<7. Степень гидролиза и константа гидролиза для данной реакции описываются аналогично приведенным для реакции гидролиза соли, образованной слабой кислотой и сильным основанием. Гидролиз соли, образованной слабой кислотой и слабым основанием, протекает как по катиону, так и по аниону. Константа гидролиза зависит от констант диссоциации слабых кислоты НА и основания ВОН: Итак, гидролиз изменяет реакцию среды (подкисляет или подщелачивает). Степень гидролиза возрастает с разбавлением раствора и при увеличении температуры. ЛЕКЦИЯ ПО ТЕМЕ: «ДИСПЕРСНЫЕ СИСТЕМЫ»
Все дисперсные системы состоят из сплошной фазы, называемой дисперсионной средой, и прерывистой фазы (частиц), называемой дисперсной фазой. От линейных размеров частиц дисперсной фазы зависит гомогенность или гетерогенность дисперсной системы. Гомогенные дисперсные системы называются истинными растворами, или просто растворами. Истинные растворы содержат молекулы или атомы, размеры которых не превышают 5 нм (5˙10-9 м). Гетерогенные дисперсные системы подразделяют на: а) грубодисперсные системы, у которых частицы имеют размер 1000 нм (10-6 м) и более; б) коллоидные системы, размер частиц которых лежит в пределах от 1 до 500 нм (10-9 до 5˙10-7 м). К грубодисперсным системам относятся суспензии, эмульсии, пены. Суспензии представляют собой системы, состоящие из раздробленного твердого вещества и жидкости, в которой распределена дисперсная фаза. Например, крахмал в холодной воде, шоколад (какао в масле), мутная вода. Примеры концентрированных суспензий – пасты, взвесь глины в воде. Эмульсии – образуются двумя несмешивающимися жидкостями; обычно одной из фаз является вода. Примеры эмульсий: молоко, майонез, маргарин, бензол в воде. Пены – грубодисперсные системы, состоящие из ячеек, заполненных газом, и отделенных друг от друга пленками очень малой толщины. К пенам относятся: мыльная пена, мусс, пелус, пенопласты. Характерным признаком грубодисперсных систем является то, что частицы дисперсной фазы видны в обычный микроскоп или даже невооруженным глазом. Частицы в коллоидных системах уже невозможно различить в обычный микроскоп, так как их размеры меньше длины волны видимого света. Дисперсные системы с частицами коллоидных размеров называют золями. По характеру дисперсионной среды различают: гидрозоли (растворитель – вода), аэрозоли (мельчайшие капельки жидкости, тонкораспыленные в газе, например, туман), мелкие твердые частицы в газе (дым). Помимо классификации дисперсных систем по размерам частиц, существует и другая классификация – по агрегатному состоянию дисперсной фазы и дисперсионной среды.
Коллоидные системы Коллоидные растворы отличаются от истинных рядом свойств: 1. Малой скоростью перемещения ввиду малой скорости диффузии; 2. Повышенной вязкостью; 3. Гетерогенностью. От грубодисперсных систем они отличаются относительной устойчивостью. Для коллоидов характерна очень развитая поверхность, в связи с чем в коллоидных растворах исключительно важную роль играет адсорбция. Существует два основных пути получения коллоидных растворов. 1. Дисперсионный – измельчение частиц грубодисперсных систем до размеров, соответствующих коллоидам. При этом используются обычно физические методы с применением различных диспергаторов и коллоидных мельниц. 2. Конденсационный – укрупнение частиц истинных растворов (ионов, молекул) путем их ассоциации до размеров, соответствующих коллоидам. Применяются обычно химические методы: осаждение, гидролиз, окисления-восстановления, нейтрализации. Например, в результате гидролиза солей железа (III) получают его гидроксид: Fe3+ + 3H2O = Fe(OH)3 + 3H+. Для повышения устойчивости коллоидов в раствор вводят стабилизаторы (ПАВ). Строение и заряд коллоидной частицы. Мицелла Коллоидная частица состоит из ядра, адсорбирующего из окружающей среды ионы одного вида. Эти ионы называют зарядообразующими, их химическая природа близка химической природе ядра коллоидной частицы. Например,
Ядро коллоидной частицы с адсорбированными зарядообразующими ионами притягивает к себе из среды ионы противоположного знака (заряда). Зарядообразующие ионы и противоионы гидратированы. Весь этот комплекс и называют коллоидной частицей. В состав коллоидной частицы входит только часть имеющихся в системе противоионов – их называют связанными. Другая часть противоионов остается в дисперсной среде (жидкой фазе). Эти противоионы называют свободными. Они определяют заряд дисперсионной среды. Все сочетание, состоящее из коллоидной частицы и дисперсионной среды (гидратированных свободных противоионов) называют мицеллой. Мицелла – это структурная единица коллоидного раствора. Примерный состав коллоидных частиц и мицелл золей иодида серебра и гидроксида железа (III)
Мицелла имеет сложное строение. Пример строения мицеллы Fe(OH)3 приведен ниже. [mFe(OH)3nFe3+3(n-x)Cl-yH2O]3x+ + 3xCl- Ядро связанные противоионы свободные противоионы Адсорбционный слой диффузионный слой 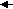  Коллоидная частица Коллоидная частица  Мицелла Мицелла Суммарно заряд частицы равен разности зарядов адсорбированных ионов и противоионов. Вокруг частицы находится диффузионный слой ионов, заряд которых равен заряду коллоидной частицы. Коллоидная частица и диффузионный слой образуют электронейтральную мицеллу. Оптические свойства коллоидных растворов При прохождении через дисперсную систему свет может поглощаться, отражаться или рассеиваться частицами. Поглощение света – явление избирательное. Одни вещества полностью поглощают свет, другие поглощают только лучи определенной части спектра. Отражение света поверхностью частиц возможно только в грубодисперсных системах. Отражение света проявляется в мутности таких дисперсных систем как в проходящем свете, так и при боковом их освещении. Для типичных коллоидных систем наиболее характерным оптическим свойством является рассеивание света по всем направлениям. Размеры коллоидных частиц меньше длины световой волны, и поэтому рассеивание света обусловлено не отражением его от поверхности частиц, а дифракцией. Рассеивание света при освещении коллоидного раствора было исследовано Тиндалем. Путь света виден при наблюдении сбоку в виде светящейся полосы (конус Тиндаля). Это свечение было названо опалесценцией. Электрические свойства коллоидных растворов В 1909 г профессор Московского университета Р. Рейсе наблюдал воздействие постоянного электрического тока на диспергированную в воде глину, и на этом основании описал электрические свойства коллоидных растворов. Частицы дисперсной фазы (глины) перемещались к аноду, где наблюдалось помутнение раствора, а частицы дисперсионной среды (воды) перемещались к катоду, где наблюдалось повышение уровня прозрачной жидкости. Направленное движение частиц к электродам говорило об их заряде. дисперсная фаза несет на себе заряд, противоположный по знаку заряду среды. Движение частиц дисперсной фазы к одному из электродов при пропускании через золь постоянного электрического тока получило название электрофореза, а движение частиц дисперсионной среды – электроосмоса. На границе раздела фаз возникает двойной электрический слой. Между фазами возникает разность потенциалов, называемая электродинамическим потенциалом Ψ. Часть скачка потенциала, обусловленная диффузным слоем, называется электрокинетическим или дзета – потенциалом ξ. Дзета-потенциал определяется толщиной и зарядом диффузионного слоя, которые зависят от концентрации и заряда противоионов и температуры. Чем меньше толщина диффузионного слоя, тем больше противоионов этого слоя перейдет за границу скольжения и тем меньше будет значение дзета-потенциала. Чем больше значение ξ, тем больше агрегатная устойчивость коллоидных систем. Электрические свойства коллоидных растворов объясняют их агрегатную устойчивость, которая проявляется в том, что частицы дисперсной фазы в коллоидном растворе не укрупняются и не слипаются. Коагуляция коллоидных растворов Коагуляцией называют процесс соединения коллоидных частиц в крупные агрегаты с последующей потерей коллоидной системой кинетической устойчивости. Коагуляцию коллоидных растворов можно вызвать нагреванием, охлаждением, интенсивным перемешиванием, а также добавлением различных электролитов. Добавление к коллоидному раствору электролитов приводит к снижению электрокинетического потенциала. Этот процесс характеризуется следующими закономерностями:
Коллоидные растворы в природе и технике В природной воде содержится часть примесей в коллоидном состоянии. Поэтому воду, используемую для коммунальных нужд, электростанций, строительства, подвергают обработке, вызывающей коагуляцию коллоидных частиц. Коагуляцию широко используют при очистке воды для удаления взвешенных веществ. В качестве коагулянтов используют сульфаты алюминия или железа. Дымовые газы электростанций, металлургических заводов представляют собой аэрозоли. Для их коагуляции применяется электрогазоочистка методом электрофореза при очень высоких напряжениях. В коллоидном состоянии находятся многие составные части живых организмов: кровь, лимфа, внутриклеточная жидкость. Наибольшее практическое применение имеют твердые системы с газовой дисперсной фазой, называемые твердыми пенами. На ж/д транспорте применяются такие газонаполненные пластмассы, как минора – для теплоизоляции изотермических, пассажирских и рефрижераторных вагонов, поролон – для изготовления мягких сидений в пассажирских вагонах, стипор - тепло- и звукоизоляционный материал в рефрижераторных вагонах, трубопроводах, стеновых панелях. Тема: «Окислительно-восстановительные процессы» План
Все ионные реакции в растворах можно разделить на два типа. К первому из них относятся ионообменные реакции, протекающие без изменения заряда ионов, входящих в состав реагирующих веществ. Например, 2NaOH+H2SO4 = Na2SO4 + 2H2O. Ко второму типу относят реакции, идущие с передачей электронов от одних атомов другим – окислительно-восстановительные реакции (ОВР): например, 2KJ+Cl2 = 2KCl+J2. К окислительно-восстановительным можно отнести реакции с раздельным протеканием окисления и восстановления (электрохимические). Для характеристики состояния элементов в соединениях введено понятие степени окисления (СО). Под степенью окисления понимают воображаемый (формальный) заряд в соединении, вычисленный, исходя из предположения, что в соединении имеются только ионные связи. СО для большинства соединений имеет условный характер, так как не отражает реальный заряд атома, но, однако, широко используется в химии. В зависимости от электроотрицательности (ЭО) атома СО может быть отрицательной или положительной. Элементы с высоким значением ЭО имеют отрицательную СО, а с малым – положительную. Определяют СО, исходя из следующих правил: 1. Степень окисления атомов в простом веществе равна нулю. Например, О20, О30, S80 и т.д. 2. В соединениях с ковалентными полярными связями более электроотрицательный элемент имеет следующие СО: F-, О-2 (за исключением пероксидов (Н2О2-), надпероксидов (КО2-1/2), озонидов (КО3-1/3) и O+2F2. 3. Элементы с малой ЭО проявляют СО: Н+ (за исключением солеобразных гидридов LiH-), щелочные металлы +1, щелочноземельные металлы +2. 4. Алгебраическая сумма СО элементов в нейтральной молекуле равна нулю, а в сложном ионе – заряду иона. Большинство элементов в соединениях проявляют переменную СО. Примеры. Fe+2O-2, Fe2+3O3-2, K+N+3O2-2, H+N+5O3-2. Максимальная СО имеет периодическую зависимость от порядкового номера в периодической таблице элементов и совпадает с номером группы. Для неметаллов периодическую зависимость имеет также и минимальная СО – это определяется электронным строением атома. Окисление – это процесс отдачи электронов атомом. Степень окисления при этом повышается: Zn – 2e = Zn2+. Вещество, отдающее свои электроны, называется восстановителем (Zn). Zn2+ является окисленной формой цинка. К типичным восстановителям относят простые вещества, атомы которых имеют низкое значение ЭО, например, металлы (особенно активные – щелочные и щелочноземельные), водород, углерод, анионы, атомы которых находятся в низшей СО, например, Cl-, NO2- и т.д. Восстановление – это смещение электронов к веществу. СО при этом понижается. Например, Сu2+ + 2e = Cu. Вещество, принимающее электроны (Сu2+), называется окислителем. В данной реакции Cu является восстановленной формой, а Сu2+ - окисленной. К типичным восстановителям относят простые вещества, атомы которых имеют высокую ЭО (кислород, хлор, фтор), соединения кислорода – пероксиды (Н2О2), катионы и анионы, содержащие атомы с высокой СО (Fe3+, Pb4+, NO-3, CrO42-, ClO4-). В химических реакциях окисление и восстановление – сопряженные процессы. В ходе ОВР восстановитель отдает свои электроны окислителю, сам при этом окисляется. Окислитель, принимая электроны, восстанавливается. Раздельное протекание окисления и восстановления происходит только в электрохимических процессах на электродах. |
