Біологічна хімія. Белей. Контрольна робота 2 Варіант 6 Студентки 3го курсу ф6А групи Фармацевтичного факультету Заочної форми навчання нму ім. О. О. Богомольця
 Скачать 351.36 Kb. Скачать 351.36 Kb.
|
|
Національний медичний університет ім О.О.Богомольця (завідувач кафедрою – проф.,д.м.н. І.В. Ніженковська) Біологічна хімія Контрольна робота № 2 Варіант №6 Студентки 3-го курсу ф-6А групи Фармацевтичного факультету Заочної форми навчання НМУ ім. О.О.Богомольця Белей Валерії Андріївни Спеціалізовані шляхи метаболізму циклічних амінокислот (фенілаланіну, тирозину, триптофану). Обмін фенілаланіну та тирозину та його спадкові порушення. Особливістю метаболізму в тваринних організмах циклічних амінокислот фенілаланіну та тирозину є утворення з них численних фізіологічно активних сполук гормональної та медіаторної дії, а саме: катехоламінів (адреналіну, норадреналіну), тиреоїдних гормонів, меланінів 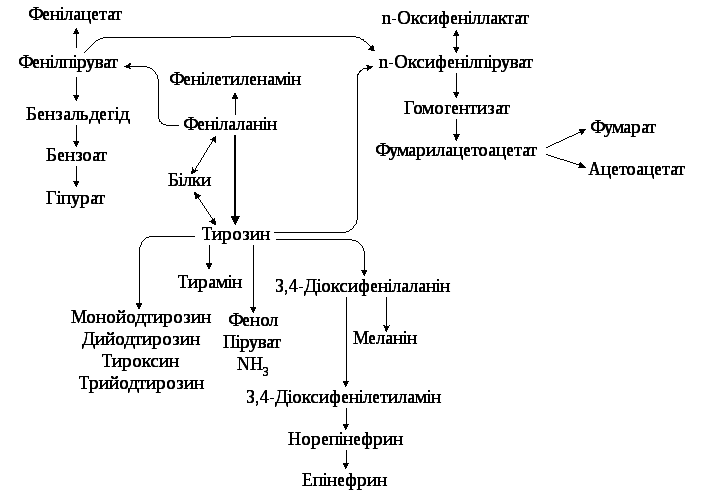 Шляхи метаболізму фенілаланіну: 1. Катаболічний шлях обміну полягає у втраті фенілаланіном аміногрупи (у реакції трансамінування) з утворенням фенілпірувату та кінцевого метаболіту фенілацетату, що екскретується з організму. 2. Шлях синтезу фізіологічно активних сполук починається з перетворення фенілаланіну на тирозин при дії ферменту фенілаланінгідроксилази з подальшим перетворенням тирозину. Шляхи метаболізму тирозину: 1. Катаболічний шлях обміну полягає у трансамінуванні тирозину і перетворенні на -оксифенілпіруват, який окиснюється до гомогентизинової кислоти у складній реакції, з участю аскорбінової кислоти (вітаміну С); подальші перетворення полягають в окисненні гомогентизату до фумарилацетоацетату (фермент оксидаза гомогентизинової кислоти) та його розщепленні гомогентизинової кислоти до фумарату та ацетоацетату. 2. Синтез катехоламінів та меланінів (пігментів шкіри) починається з окиснення тирозину за участю специфічної гідроксилази до 3,4–диоксифенілаланіну (ДОФА), на рівні якого відбувається утворення катехоламінів (через декарбоксилування до дофаміну) та меланінів (через окиснення тирозиназою до дофахінону). 3. Синтез тиреоїдних гормонів проходить в клітинах щитовидної залози і полягає в утворенні йодованих тиронінів. Триптофан належить до незамінних амінокислот для організму людини та вищих тварин у зв'язку з відсутністю ферментних систем синтезу його вуглецевого скелета. Разом з цим, триптофан є попередником у біосинтезі таких фізіологічно активних сполук, як речовина гормональної та медіаторної дії серотонін та нікотинова кислота (вітамін РР), який синтезується в тваринному організмі у формі НАД. Відомо, що нестача триптофану в харчовому раціоні прискорює розвиток захворювання, яке називається пелагрою і пов'язано з дефіцитом вітаміну РР. У цих випадках добавка триптофану в дієту покращує стан хворого і сприяє послабленню авітамінозу. Існують два основні біохімічні шляхи перетворення триптофану (6.21): - серотоніновий шлях, що становить в кількісному відношенні приблизно 1% загальної кількості триптофану в організмі; - кінуреніновий шях, за яким метаболізується понад 95 % ендогенного триптофану. Включення триптофану в серотоніновий шлях починається з гідроксилювання амінокислоти до 5-окситриптофану, який після декарбоксилування перетворюється на серотонін. В організмі людини серотонін підлягає окиснювальному дезамінуванню з утворенням оксііндолацетатної кислоти, яка виділяється з сечею. Екскреція оксііндолацетату значно збільшена при карциноїдному синдромі, коли за серотоніновим шляхом перетворюється до 60 % триптофану. Катаболізм триптофану кінуреніновим шляхом починається з окиснення триптофану при дії гемвмісного ферменту триптофанпіролази до формілкінуреніну, який після відщеплення мурашиної кислоти перетворюється на кінуренін та 3-оксикінуренін. Подальші перетворення 3-оксикінуреніну пов'язані з дією ПАЛФ-залежного ферменту кінуренінази, яка розщеплює його до аланіну та 3-оксіантранілової кислоти. Остання після складних багатоступеневих перетворень призводить до хінолінової кислоти — попередника в синтезі нікотинаміду в формі коферменту НАД. 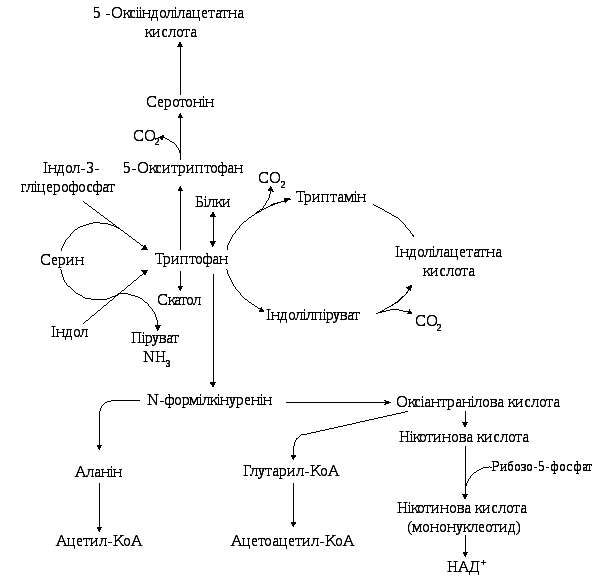 Тиреоїдні гормони: структура та біосинтез, біологічні ефекти Т4 та Т3. Патологія щитовидної залози, особливості порушень метаболічних процесів при гіпер- та гіпотиреозі. Тиреоїдні гормони є істинними гормонами, що синтезуються в спеціалізованих епітеліальних клітинах фолікулів щитовидної залози — тиреоцитах. До цієї групи належать похідні амінокислоти L-тирозину — 3,5,3', 5'-тетрайодтиронін (тироксин) та 3,5,3'-трийодтиронін. Біосинтез тиреоїдних гормонів потребує наявності йодидів, що вибірково накопичуються в щитовидній залозі, яка поглинає їх із крові; із загальних 20-30 мг йоду, що містяться в тілі людини, 10-15 мг акумулюється в колоїді фолікулів щитовидної залози. Біосинтез тиреоїдних гормонів складається з таких етапів: акумуляція щитовидною залозою йодидів крові (І) за допомогою “йодидного насосу” та їх окислення йодидпероксидазою до молекулярного йоду: 2) синтез специфічного білка колоїду щитовидної залози тиреоглобуліну та йодування його тирозинових залишків з утворенням монойодтирозинів (МІТ) та дийодтирозинів (ДІТ). Тиреоглобулін — глікопротеїн з м.м. 660 кД, що має олігомерну структуру (складається з двох субодиниць); у складі білка — 115 залишків тирозину, 15-20 % яких підлягають йодуванню; 3) перетворення йодованих тирозилових залишків на йодовані тироніни (у складі молекули тиреоглобуліну); 4) секреція йодованого тиреоглобуліну в порожнину фолікула, де цей високомолекулярний попередник тиреоїдних гормонів зберігається у складі колоїду; 5) поглинання (за умов фізіологічних потреб та стимуляції тиреотропіном) йодованого білка тиреоцитами, включення його в фаголізосоми, розщеплення молекули йодованого тиреоглобуліну(лізосомальними тиреокатепсинами) з утворенням вільних молекул трийодтироніну (Т3) та тетрайодтироніну (Т4) і вихід їх через базальні мембрани клітин у кров. Із двох йодованих тиронінів більш активним є Т3, специфічна гормональна активність якого перевищує відповідну активність Т4 у 4-5 разів; у периферійних тканинах більша частина Т4перетворюється на Т3, і сумарна біологічна дія тиреоїдних гормонів в організмі на 90-95 % забезпечується саме Т3. Біологічні функції тиреоїдних гормонів — полягають у контролі процесів енергетичного обміну, біосинтезу білка та морфогенезу: 1. Стимуляція біоенергетичних процесів у тканинах при дії гормонів щитовидної залози позначається збільшенням швидкості тканинного дихання (поглинання О2), активності мітохондріальних ферментів елетронотранспортного ланцюга, підвищенням рівня катаболізму вуглеводів, ліпідів, амінокислот. Разом з тим, збільшення поглинання тканинами кисню в умовах дії тиреоїдних гормонів не супроводжується адекватним зростанням фосфорилювання АДФ до АТФ, в результаті чого коефіцієнт окисного фосфорилювання (Рi/О) зменшується, тобто відбувається роз’єднання дихання та окисного фосфорилювання. 2. Тиреоїдні гормони є потужними стимуляторами процесів морфогенезу, нео- натального закладення, формування і розвитку тканинних структур та органів; уроджений гіпотиреоз у людини супроводжується важкою затримкою психічного розвитку новонароджених дітей. В основі позитивного впливу гормонів щитовидної залози на морфогенез та розвиток тканин лежить їх специфічний активуючий вплив на процеси транскрипції генів, що контролюють зазначені процеси. Найважчі патології щитоподібної залози викликані її дисфункцією. При важкій клінічній формі гіпотиреозу (тривала нестача гормонів) у пацієнта розвивається мікседема, яка призводить до порушення білкового обміну та набряку тканин організму. За відсутності лікування хвороба призводить до смертельно небезпечного ускладнення – гіпотиреоїдної коми. Вроджений гіпотиреоз у дітей призводить до розвитку кретинізму. Це захворювання характеризується серйозним відставанням у фізичному і розумовому розвитку. Гіпотиреоїди́зм (лат. hypothyreoidismus), також гіпотирео́з (hypothyreosis) — патологічний стан, клінічний синдром, що виникає у людини при недостатності гормонів щитоподібної залози внаслідок зниження або повного випадіння функції щитоподібної залози, недостатній дозі тироксину при замісній терапії. Цей стан організму протилежний гіпертиреоїдизму. Гіпотиреоїдизм діагностують переважно у жінок 30-60 років, у більшості хворих гіпотиреоз є первинним. Хворі скаржаться на швидку втому, загальну слабкість, набряклість, сухість шкіри, підвищену сонливість, запори, мерзлякуватість, збільшення ваги. Відбуваються зміни в нервово-психічній сфері: психічна загальмованість, млявість психічних функцій, бідність психічного сприйняття, зниження пам'яті та концентрації, апатія, головний біль, запаморочення, зниження слуху. При гіпотеріозі може виникати депресія і невроз. Біль за типом радикуліту, парестезії, корчі, важкість ходи. Відзначають подовження тривалості сухожильних рефлексів. Найбільш тяжким, нерідко смертельним ускладненням гіпотиреоїдизму є гіпотиреоїдна кома. Вона виникає, як правило, у людей похилого віку, з не діагностованим, або не лікованим гіпотиреоїдизмом. Провокуючими факторами є: переохолодження, інфекції, операції тощо. Клінічні прояви цього: блідо-жовта, холодна шкіра інколи з геморагічними висипаннями, брадикардія, артеріальна гіпотонія, олігурія, зниження температури тіла до 34-24 °С, полісерозит, виражені порушення в діяльності серцево-судинної системи. У крові: гіпоглікемія, гіпонатріємія, гіперліпідемія, гіперазотемія, збільшення гематокриту. Гіпертиреоз — підвищення секреції гормонів щитоподібної залози, що перевищує актуальну потребу організму і веде до розвитку характерного симптомокомплексу. Знижений рівень ТТГ вказує на первинну (пов'язану з щитоподібною залозою) причину гіпертиреозу, а підвищений — на вторинну (пов'язану з гіпофізом). Гіпертиреоз, зазвичай, розвивається протягом кількох місяців. Може також виникати раптово (напр., пов'язаний з прийомом аміодарону або впливом йоду, що міститься у радіологічних контрастних речовинах), або розвиватися протягом років (автономний вузол, токсичний вузловий зоб), мати транзиторний характер і проходити самостійно (підгострий або післяпологовий тиреоїдит), чергуватися з періодами ремісії (дифузний токсичний зоб — ДТЗ). Різні причини гіпертиреозу можуть співіснувати; напр., наявність гіперпродукуючого вузла щитоподібної залози у хворого на ДТЗ може бути причиною нетипового перебігу і відсутності ремісії ДТЗ. У літніх осіб симптоми можуть бути виражені слабше та обмежуватися пароксизмальною або постійною фібриляцією передсердь, іноді — загостренням існуючої ішемічної хвороби серця або серцевої недостатності. На початкових стадіях частіше спостерігається субклінічний гіпертиреоз. Ускладнення виникають через надлишок ГЩЗ у результаті опосередкованого впливу (напр., інсульт у пацієнтів з фібриляцією передсердь, індукованою гіпертиреозом) або безпосереднього впливу — як гострого (тиреотоксичний криз — загрозливе для життя ускладнення), так і хронічного (фібриляція передсердь, остеопоротичні переломи). Ризик переходу фібриляції передсердь у постійну форму при гіпертиреозі збільшується в ≈3 рази, а спроби відновлення синусового ритму неефективні до моменту ліквідації тиреотоксикозу. Збільшення захворюваності та смертності від серцево-судинних причин пов'язане з підвищеним ризиком розвитку порушень серцевого ритму, тромбоемболічних ускладнень при фібриляції передсердь, посиленням симптомів ішемічної хвороби серця і загостренням серцевої недостатності. Вітаміни як незамінні компоненти в харчуванні людини. Екзогенні та ендогенні причини вітамінної недостатності. Вітаміни та їх похідні як фармпрепарати. Вітаміни – органічні сполуки, які є необхідною складовою їжі, але присутні в ній в дуже малій кількості в порівнянні з іншими компонентами, та забезпечують нормальний перебіг фізіологічних і біохімічних процесів в організмі. Біохімічна роль мікроелементів обумовлена, в основному, їх взаємозв'язком з ферментами, гормонами та вітамінами, саме цим визначається їх участь у метаболізмі. Надходження хімічних елементів в організм забезпечують продукти харчування та споживана вода. Елементи з подібною будовою атомів мають багато спільного і в біологічній дії. Кількість мінеральних речовин, що надходять в організм людини з їжею, має дорівнювати кількості, яка виводиться з організму. Авітаміноз – відсутність вітамінів. Гіповітаміноз – недостатнє поступлення вітаміна, загальна слабкість, недомагання. Гіпервітамінози – передозування вітаміна. Якщо харчування недостатнє або неповне це є причиною екзогенних авітамінозів. Але є ще ендогенні авітамінози. Причиною їх є: Підвищена потреба у вітамінах при деяких фізіологічних і патологічних станах(вагітність, лактація. Тиреотоксикоз, тахексичне захворювання). Посилений розклад вітамінів в кишківнику внаслідок розвитку в ньому мікрофлори; Порушення процесу всмоктування при захворюванні шлунково-кишкового тракту; Хвороби печінки, підшлункової залози, що викликають закупорку загальної жовчної протоки і супроводжується порушенням всмоктування жирів, продуктів їх розпаду, жирних кислот і жиророзчинних вітамінів. Причини гіпо- та авітамінозів носять екзогенне та ендогенне походження. До екзогенних належить аліментарна форма вітамінної недостатності, обумовлена нераціональним харчуванням, неправильним зберіганням і неправильною кулінарною обробкою продуктів, а також дисбактеріоз, викликаний здебільшого тривалим і неконтрольованим використанням фармпрепаратів (антибіотиків, сульфаніламідів тощо). Ендогенні (вторинні) гіпо- й авітамінози здебільшого розвиваються внаслідок підвищених потреб у вітамінах при деяких фізіологічних і патологічних станах (вагітність, лактація, тиреотоксикоз, кахексія тощо); посиленого розпаду вітамінів у кишках внаслідок дисбактеріозу чи інфекційного ураження травного тракту; порушення процесу всмоктування вітамінів у результаті порушення секреторної та моторної функцій кишок; хвороб печінки, підшлункової залози, що викликають закупорку загальної жовчної протоки та всмоктування жирів, а також порушення внутрішніх перетворень окремих вітамінів у біологічно активні та коензимні форми. Нестача поступлення вітамінів з їжею призводить до зниження фізичної та розумової працездатності; послаблює опірність організму до різних захворювань; посилення негативного впливу на організм ушкоджувальних факторів навколишнього середовища, токсичних факторів виробництва, нервово-емоційного напруження та стресу. У дитячому та юнацькому віці нестача вітамінів негативно впливає на показники фізичного розвитку, успішності навчання, сприяє розвитку обмінних порушень і хронічних захворювань; у вагітних і жінок, що годують є однією з причин недоношування вагітності. При надходженні в організм людини водорозчинні вітаміни практично повністю використовується ним, а надлишок виводиться в складі жовчі та сечі, тому захворювання, пов’язані з їх передозуванням, не описані. Відомі лише два жиророзчинні вітаміни (А і Д), тривале застосування яких у дозах, що перевищують фізіологічну потребу організму в десятки тисяч разів, може викликати гіпервітаміноз (вітамінну інтоксикацію). Деякі вітаміни при передозуванні можуть спричинювати розвиток неспецифічних реакцій (нудоту, блювання, діарею, почервоніння шкіри), які швидко проходять після відміни вітамінних препаратів. Існують також і природжені порушення обміну вітамінів (тіамінзалежна мегалобластна анемія, піридоксинзалежний судомний синдром, природжений вітамін D-залежний рахіт тощо). Вони обумовлені або дефектом структури апофермента, або інших білків, що беруть участь у процесі всмоктування та транспорту вітамінів, їхньому перетворенні в коферменті активні форми. Інколи цю патологію вдається цілком чи частково корегувати шляхом постійного введення відповідного вітаміну в дозах, що перевищують фізіологічну потребу в 100 – 1 000 разів. Подібні випадки одержали назву вітамінозалежних станів. В інших випадках, які носять назву вітамінорезистентних, введення навіть дуже високих доз відповідних вітамінів не усуває явищ їх недостатності та призводить до тяжкого порушення здоров'я та навіть до летального результату. 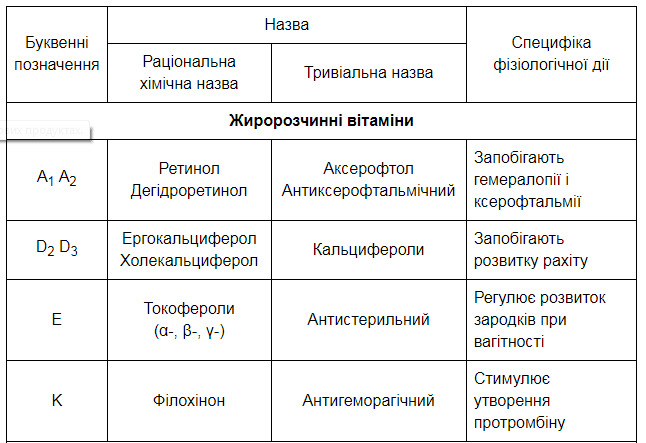 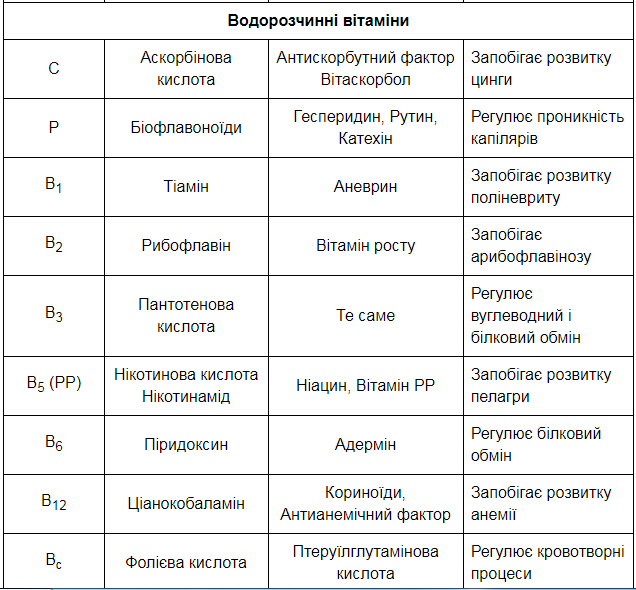  Калікреїн-кінінова система крові та тканин. Антагоністи кініноутворення, як лікарські засоби. Калікреїн-кінінова система — група білків крові, що грають роль у регуляції судинного тонусу, діурезу, запалення, коагуляції і рецепції болю. Біологічно активними її компонентами є поліпептидні гормони — брадикінін і калідин. Це — одна з ключових каскадних протеолітичних систем плазми крові, що разом з ренін-ангіотензиновою системою, комплементом і системою зсідання крові бере участь в регуляції деяких базисних функцій організму, таких, як підтримання артеріального тиску, антигенної сумісності і гемостазу. Плазматична ККС включає т.з. високомолекулярний кініноген (ВМК) і плазматичний прекалікреїн що синтезуються в печінці і секретуються, як решта білків плазми крові. Плазматичний прекалікреїн протеолітично активується ХІІа фактором зсідання крові та іншими протеазами (амінопептидазами) і в такому вигляді активує коагуляцію та вивільняє біологічно активний кінін — брадикінін з ВМК, що діє як прозапальний фактор. Місцеві ККС складаються з місцево синтезованого або печінкового низькомолекулярного кініногену і тканинного калікреїну. Вони взаємодіють за тією ж самою схемою. Локальні ККС знайдені в багатьох внутрішніх органах і тканинах, зокрема, в міокарді, ниркових канальцях, ЦНС, підшлунковій залозі, простаті, слинних залозах та гранулоцитах. На відміну від плазматичної ККС, органоспецифічні тканинні системи можуть безперервно продукувати калікреїн, відповідно і калідин тут утворюється постійно з системного чи місцевого кініногену: деякі локальні системи синтезують «свій», низькомолекулярний кініноген. Особливо це показово в нирках, де велика кількість калікреїну і кініногену синтезуються епітелієм канальців і виділяються з сечею. Високомолекулярний кініноген (ВМК) і низькомолекулярний кініноген (НМК) слугують попередниками активних поліпептидів. Самі вони біологічної активності не мають. ВМК синтезується в печінці поряд з прекалікреїном. НМК синтезується місцево, багатьма тканинами і секретується разом з тканинним калікреїном. ВМК і НМК утворюються в результаті альтернативного сплайсингу одного гена. Власне, кініни — це поліпептидні гормони. Період напіврозпаду їх дуже короткий, близько 30 секунд. Брадикінін (БК) — нонапептид (Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg), що утворюється з ВМК під дією калікреїну, діє на В2 і в меншій мірі на B1 рецептори. Брадикінін, головним чином, складає пул циркулюючих кінінів і справляє системну дію на судинне русло. Калідин (КД) — декапептид, його ще називають — лізил-брадикінін (Lys-БК), вивільняється з НМК за впливу на нього тканинного калікреїну. Він діє переважно аутокринно чи паракринно на В1 і В2 рецептори. Ферменти: Калікреїни (тканинний і плазматичний) — серинові протеази, каталізують утворення кинінів з кініногенів[3]. Прекалікреїн служить попередником плазмового калікреїну. Він може каталізувати утворення кінінів тільки після активації фактором Хагемана. Кініназа І (карбоксипептидаза) присутня у двох формах: циркулюючій N-формі (синтезується печінкою, 90% кініназної активності плазми) і зв'язаній з мембраною M-формі (синтезується ендотелієм місцево, залежно від органу). Відщеплює від молекули кініна кінцевий аргініновий залишок. Таким чином, утворюються активні метаболіти desArg9-брадикінін і desArg10-калідин. Окрім кінінази І, цю роль можуть виконати нейтральні ендопептидази та АПФ. Кініназа ІІ (або Ангіотензинперетворювальний фермент, АПФ) має два активних центри: інактивує брадикінін і каталізує утворення ангіотензину II з ангіотензину I. Нейтральні амінопептидази беруть участь в утворенні активних кінінових метаболітів, послідовно відщеплюючи від N кінця амінокислотні залишки метіоніну і лізину. У зв'язку з участю кінінів у патогенезі запальних процесів, в клінічній практиці широко застосовуються лікарські засоби, які є інгібіторами кініноутворення. Так, гордокс – антиферментний препарат, який отримують із підшлункової залози забійної худоби, інгібує дію калікреїну, трипсину та інших ферментів. Його застосовують при гострому панкреатиті та панкреонекрозі, післяопераційному паротиті, тиреотоксичному кризі, у гострому періоді інфаркту міокарда, у комплексній терапії ішемічної хвороби серця. Для лікування панкреатиту застосовують також пантрипін і контрикал. Згідно сучасних даних при цьому захворюванні процес активування протеолітичних ферментів відбувається в підшлунковій залозі (тоді як за умов норми – в тонкій кишці), що спричинює самоперетравлення тканин залози, появу внутрішньотканинних крововиливів, ділянок некрозу, набряку тощо і, як наслідок, до втрати функціональної активності цього органа, а згодом - порушення метаболічних процесів у організмі. Задача: Які умови і ферменти необхідні для травлення білків у шлунку? Діагностичне значення аналізу шлункового вмісту. Травлення білків відбувається в шлунку і кишечнику. В шлунку розщепленню білків сприяють два чинники: 1) протеолітичні ферменти; 2) кисле середовище. Основним ферментом шлунка е пепсин, оптимальне значення рН якого знаходиться в межах 1,5-2,5. При зростанні рН дія пепсину слабшає, а при рН 5-6 - він просто не діє. Кисле рН у шлунку створюється завдяки соляній кислоті. Вона утворюється в клітинах шлункових залоз і секретується в порожнину шлунка, де її концентрація сягає 0,16 М. За рахунок цього шлунковий вміст має значення рН у межах 1,5- 2,5. Соляна кислота в шлунку стимулює перетворення неактивного пепсиногену в активний пепсин, створює оптимальне рН для його дії, викликає набухання білків. Пепсин виділяється основними клітинами залоз шлунка в неактивній формі, у вигляді проферменту (попередника пепсину) — пепсиногену. Останній під впливом соляної кислоти перетворюється в активний протеолітичний фермент — пепсин. Перетворення пепсиногену в пепсин може відбуватися і під впливом самого пепсину, тобто авто каталітично. Різні білки розщеплюються пепсином з неоднаковою швидкістю. Зовсім не перетравлюються пепсином кератин, колаген. Легко розщеплюються м'язові білки (міоген, міозин), а також альбуміни і глобуліни. Пепсин гідролізує пептидні зв'язки, утворені карбоксильними групами ароматичних амінокислот (фенілаланін, тирозин), а також лейцину і глутамінової кислоти. Білки їжі в шлунку розщеплюються до поліпептидів і коротких пептидів. Шлунковий сік — секрет трубчастих залоз, розташованих у слизовій оболонці шлунка; бере участь у складному процесі травлення; секретується через 5–10 хв після їжі. Поза травленням шлунковий сік не виділяється. Дослідження шлункового соку має важливе значення для оцінки функціонального стану шлунка. Воно включає вивчення фізико-хімічних властивостей і мікроскопічне дослідження. Основним методом функціонального дослідження секреції шлунка є метод фракційного зондування із застосуванням стимулятора шлункової секреції (пробний сніданок). Суть методу полягає в тому, що після введення зонда в шлунок витягається увесь вміст шлунка — порція натщесерце; далі в окремі ємності кожні 15 хв збирають 4 порції шлункового соку. Подразником при цьому є зонд, введений у шлунок (перша фаза секреції, або базальна секреція); потім через зонд у шлунок вводять харчовий подразник (капустяний сік, м’ясний бульйон, «алкогольний» або «кофеїновий» сніданок). Через 10 хв після введення харчового подразника витягають 10 мл шлункового вмісту, а ще через 15 хв відкачують весь вміст шлунка — залишок пробного сніданку. Далі протягом години через кожні 15 хв витягають в окремі скляночки весь шлунковий вміст (друга фаза секреції, або стимульована секреція). У нормі шлунковий сік жовтувато-білого кольору. Домішки крові надають шлунковому соку різні відтінки червоного кольору: при свіжій кровотечі — червоний, при кровотечі, що повільно розвивається, якщо кров знаходиться в шлунку тривалий час, — коричневий. Жовч надає шлунковому соку зеленого кольору, тому що білірубін жовчі переходить у білівердин. 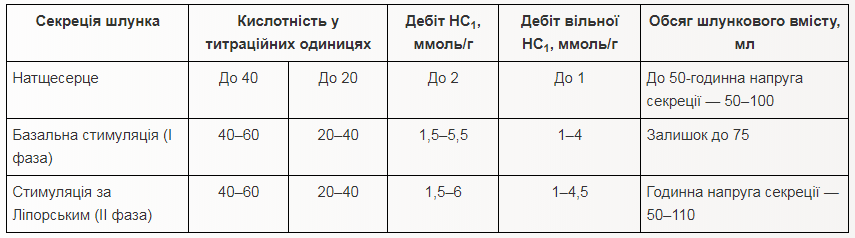 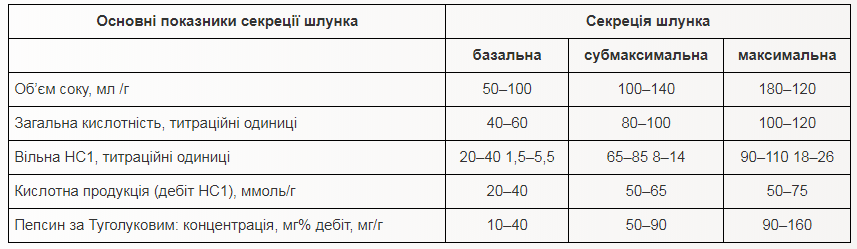 Джерела інформації: Біологічна і біоорганічна хімія (Юрій Губський, Михайло Корда, Ірина Ніженковська) Біологічна і біоорганічна хімія: у 2 книгах. Книга 1. Біоорганічна хімія Біологічна хімія (Скляров О.Я., Фартушок Н.В., Бондарчук Т.І.) |
