контрольная работа. био 10-1. Контрольная работа по дисциплине Биотехнология лекарственных средств
 Скачать 0.66 Mb. Скачать 0.66 Mb.
|
|
Государственное образовательное учреждение высшего профессионального образования Алтайский государственный медицинский университет Министерства здравоохранения и социального развития РФ Фармацевтический факультет Заочное отделение Контрольная работа по дисциплине «Биотехнология лекарственных средств» Номер варианта__10___ Выполнила студентка 063 группы 6 курса Бебих Кристина Александровна Дата сдачи в деканат Проверил(а) Барнаул 2021 г ТЕСТОВЫЕ ЗАДАНИЯ:1 – А 2 – А 3 – 2 4 – 5 5 – 1 6 – 2 7 – 3 8 – 2 9 – 3 10 – Е 11 –3 12 – 2 13 – 2 14 – А 15 – 5 16 – 3 17 – 1 - В, 2 - Д, 3 – С, 4 - А 18 – 3 19 – 4 20 – 4 СИТУАЦИОННЫЕ ЗАДАЧИ 1. Опишите процесс, изображенный на рисунке, по следующей схеме: название представленного процесса; биообъект, цели получения, достоинства и недостатки; определение, технология и условия получения экспланта; определение, назначение, условия получения и культивирования каллуса; определение и назначение транспланта и инокулюма; назначение и условия культивирования биообъекта в суспензионной культуре; компоненты питательных сред, фитогормоны - определение, роль в процессе культивирования, основные представители; варианты культивирования биообъекта в суспензионной культуре. 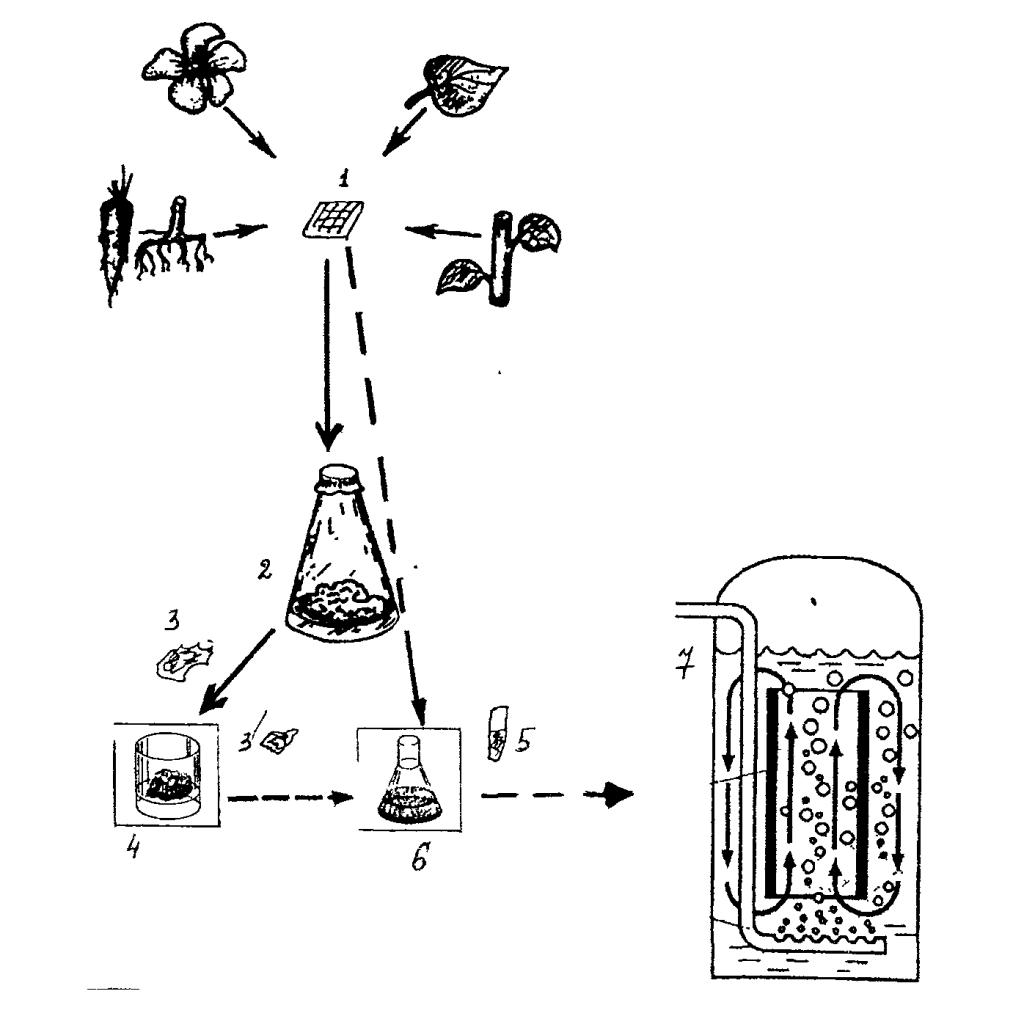 - название представленного процесса Общая схема получения культуры тканей растений (1 - эксплант, 2 - каллус, 3 - трансплант для получения каллусной культуры, 3’ - трансплант для получения первичной суспензии, 4 - каллусная культура, 5 - инокулюм, 6 - первичная суспензия, 7 - суспензионная культура в эрлифном биореакторе). - тотипотентность Способы биотехнологического получения БАВ из биомассы изолированных клеток растений возникли на основе развития метода культуры изолированных клеток и тканей как одного из методов клеточной инженерии. Культура тканей растений получила наибольшее развитие благодаря природному свойству клеток растений -тотипотентности (способности любой растительной клетки образовывать целое растение). Производство лекарственных субстанций из растений может быть осуществлено тремя конкурентоспособными методами: выращивание лекарственных растений на опытном поле (интродукция растений; выращивание плантационных растений); выращивание биомассы изолированных клеток, гибридов и протопластов, а также тканей высших и низших растений; . культивирование микроорганизмов, представляющие собой ассоциативные системы с растительными клетками. Современная биотехнология под термином "культура тканей растений" понимает выращивание в стерильных искусственных условиях изолированных клеток, тканей, органов и их частей на твердых или жидких питательных средах. - биообъект, цели получения, достоинства и недостатки Преимущества культуры тканей растений, заменяющей ЛРС, получаемое от дикорастущих или культивируемых растений: 1) стандартность и экологичность культуры тканей растений; 2) возможность в краткие сроки (месяцы, а не годы) размножать ценные генотипы; 3) возможность круглогодичного получения биомассы клеток и тканей; 4) независимость от климатических и географических факторов, от импорта ЛРС и препаратов; 5) освобождение земельных площадей, вовлеченных в хозяйственную деятельность; 6) возможность автоматизации технологических процессов, снижение доли ручного труда; 7) возможность получения культур тканей, способных синтезировать БАВ в количествах превышающих их содержание в ЛРС. Культура тканей растений в биотехнологии позволяет: - получать ценные для медицины БАВ; - повышать продуктивность целых растений в интрадукции, размножать и оздоравливать посадочный материал от вирусов и патогенов; - проводить селекцию и создавать трансгенные растения с новыми свойствами. Для фармацевтической промышленности на основе культур тканей растений можно: • получать уже известные вещества присущие производящем (интактному) растению, такие как никотин, кодеин, хинин, сапонины и др.; • обеспечить синтез новых продуктов из трудно выращиваемы растений; • получить новые вещества, например рутакультин из Rutа graveolens; • использовать культуры клеток в качестве системы для биотрансформации конечного продукта. - определение, технология и условия получения эксплантанта Каллус - ткань, возникающая путем неорганизованной пролиферации и развивающаяся в местах повреждения органов растения, состоящих из однородных недифференцированных клеток 2-х типов: 1 паренхимных (крупные), 2 меристемных (мелкие). В настоящее время отработана методика вычленения клеток и тканей, получение из них каллусных и суспензионных культур при строгом сохранении стерильности. Независимо от способа выращивания методика получения культуры тканей заключается в следующем: в асептических условиях из любой части растения, которую предварительно моют мыльным раствором и обрабатывают 70% этанолом, выделяют эксплант (кусочек ткани размером 0,5-1,0 см). Стерилизацию экспланта проводят путем выдерживания в стерилизующем растворе в течение 5-20 мин с последующей многократной промывкой экспланта стерильной водой. В качестве стерилизующих растворов используют растворы натрия гипохлорита, водорода пероксида, солей ртути с добавлением поверхностно-активных веществ (ПАВ) для лучшего смачивания. - определение, назначение, условия получения и культивирования каллуса Эксплант помещают на стерильную питательную среду определенного состава. Клетки тканей запасающей паренхимы, корня и стебля, мезофилла листа и других специализированных тканей, эксплантированных на питательную среду, должны дедифференцироваться (потерять структуры, характерные для их специфических функций в растении) и вернуться к состоянию делящейся клетки. В большинстве случаев клетки переходят к специализации из фазы G1, предшествующей S-фазе, в которой происходит главное событие в делении клетки - синтез ДНК. Специализированные клетки в фазе G2 возникают редко, т.к. клетка редко выходит из цикла деления после репликации ДНК. Присутствие в среде ауксина определяет переход специализированной клетки из фазы покоя Gо в S-фазу клеточного цикла. Однако завершение фазы синтеза ДНК, синтеза белков и переход клеток к митозу невозможен без добавления в питательную среду кинетина или другого цитокинина. Через 5-6 дней инкубации при 25-28°С на изолированном кусочке ткани образуется каллус - бесформенная масса ткани белого или желтоватого цвета. Полноценный первичный каллус формируется через 4-6 недель. - определение и назначение транспланта и инокулюма Далее часть образовавшейся каллусной ткани (трансплант) в асептических условиях отделают и переносят на свежую питательную среду для дальнейшего роста. Проводя многократное субкультивирование формируют каллусную культуру тканей растений. Инокулюм (части суспензионной культуры для субкультивирования) - назначение и условия культивирования биообъекта в суспензионной культуре Суспензионную культуру получают, помещая каллусную ткань (трансплант) в колбу с жидкой питательной средой, эта суспензия перемешивается в колбах на качалках или в специальных сосудах с роллерами. Для инициации суспензионной культуры необходимы 2-3 г свежей массы каллуса на 60-100 мл жидкой питательной среды. Первичную суспензию помещают на круговую качалку, скорость 100-120 об\мин. Первичную суспензию перед субкультивированием фильтруют через 1-2 слоя марли или металлические сита, чтобы избавиться от крупных кусков каллусной ткани, остатков экспланта и очень крупных агрегатов. При субкультивировании инокулюма (части суспензионной культуры для субкультивирования) получают суспензионную культуру для получения большого количества биомассы в биореакторе эрлифного типа. Суспензионную культуру можно также получить и из фрагмента органа растения, однако это требует больших усилий и времени. - компоненты питательных сред, фитогормоны - определение, роль в процессе культивирования, основные представители Культура ткани в отличие от производящего растения имеет гетеротрофный тип питания. Для обеспечения роста и синтеза вторичных метаболитов необходим подбор ингредиентов среды культивирования, которые проводят по двум направлениям: • оценивают влияние состава среды на формирование биомассы; • оценивают влияние состава среды на синтез вторичных метаболитов. Компоненты питательной среды для выращивания культур клеток должны включать: основные неорганические вещества (макроэлементы), микроэлементы, источник железа, органические добавки (витамины, регуляторы роста), источники углерода, которые вводятся в состав в готовом для усвоения виде (сахароза или глюкоза). В настоящее время разработано несколько стандартных питательных сред, широко используемых при культивировании, но количество углеводов и регуляторов роста в них варьирует в зависимости от вида растений. Наиболее широко используемыми питательными средами являются среда Мурасиге-Скуга (MS), японская среда для роста клеток воробейника, продукционная среда для синтеза шиконина, среда Уайта, среда А.Г. Воллосовича для раувольфии. Регуляторы роста растений (фитогормоны) являются пусковыми механизмами первичного и вторичного метаболизма, играя важную роль в определении потенциальной продуктивности культур клеток. В качестве стимуляторов клеточного растяжения используют ауксины - производные индола (2,4-дихлорфеноксиуксусная кислота, индолил-3-уксусная кислота, альфа-нафтилуксусная кислота), которые вызывают процесс дедифференцировки клетки, подготавливающий ее к делению. Ингибиторами старения клеток являются цитокинины - производные 6-аминопурина (кинетин, 6-бензиламинопурин, зеатин, аденин), обеспечивающие пролиферацию (деление) дедифференцированных клеток. Без фитогормонов образования каллусной ткани не происходит, т.к. специализир0 ванные клетки не способны к делению. Факторы, влияющие на продуктивность культуры клеток На продуктивность культуры ткани растений наибольшее влияние оказывают следующие факторы: • происхождение ткани; • условия культивирования; • наличие фитопатогенов; • способ культивирования; • температура и рН среды. Происхождение ткани. Для получения кулыуры ткани эксплант чаще всего выделяют из наиболее продуктивного по биологически активным веществам растения. Условия культивирования. На синтез вторичных метаболитов в культуре клеток влияет концентрация источника углерода и внесение в питательную среду предшественников, которые могут стимулировать определенные ферментативные пути метаболизма. Например, внесение фенилаланина в среду культивирования клеток увеличивало выход диосгенина на 100%. Для ряда культур (Catharantusroseus, Lithospermumerythrorhison, Rauwolfiaserpentina) разработаны способы двухэтапного культивирования. Культуру ткани после накопления достаточного количества биомассы переносят в продукционную среду, способствующую максимальному синтезу биологически активных веществ. На синтез флавоноидов существенное влияние оказывает освещенность, поскольку в растении названные БАВ образуются как средства защиты от УФ-лучей. Наличие фитопатогенов. Вторичные метаболиты некоторых растений, преимущественно алкалоиды являются фитоалексинами, т.е. их синтез в растительной клетке происходит в ответ на действие продуктов жизнедеятельности микроорганизмов или грибов с целью защиты от патогенов. При добавлении в культуру ткани элиситоров - гомогената грибного мицеллия или какого-либо продукта жизнедеятельности патогенного микроорганизма, возрастает интенсивность синтеза катараитина клетками Catharantusroseus. - варианты культивирования биообъекта в суспензионной культуре Способ культивирования. Анализ накопленных на настоящий момент данных показывает, что выход продуктов вторичного метаболизма выше в каллусных, чем в суспензионных культурах, однако явление процессами культивирования клеточных популяций и лучение биомассы с большим выходом вторичных продуктов возможно лишь при работе с суспензионными культурами. Существенное влияние на синтез БАВ в культуре тканей растений оказывают также температура и рН среды. При суспензионном культивировании дополнительными факторами, влияющими на синтез метаболитов, являются аэрация, перемешивание и газовый состав. Создавая для каждой культуры клеток растении благоприятные условия на стадии роста и синтеза вторичных метаболитов, можно говорить о гарантированной возможности получения любою продукта метаболизма с фармакологической активностью. Особенности каллусного культивирования Внешне ткань, выращенная каллусным способом- это аморфная масса тонкостенных паренхимных клеток, не имеющих строго определенной анатомической структуры. Цвет может быть белым, желтоватым, зеленым, красным, - пигментированными антецианами полностью или частично. Каллусная клетка имеет свой цикл развития и повторяет развитие любой клетки, включая деление растяжение, дифференцировку, после чего наступает старение и отмирание. Для того, чтобы каллусные клетки не отмирали, первичный каллус через 4-6 недель переносят на свежую питательную среду. Операция носит название пассирование (субкультивированне). При регулярном пассировании способность к делению можно поддерживать в течение десятков лет. Каллусные клетки invitroсохраняют многие физиолого-биохимические свойства нормальных клеток целого растительного организма. Вместе с тем, каллусные клетки обладают отдельными свойствами, отличающими их от клеток целого растения. Химический состав каллусной ткани и органа, из которого она получена, различаются. Сохранение способности к синтезу специфических вторичных метаболитов определяют ценность культуры биомассы Технология получения сырья на основе каллусного культивирования имеет ряд преимуществ: - надежность и стабильность выхода биомассы и продуктов вторичного метаболизма; - возможность получения иммобилизированных клеток; - длительная сохранность в растущем состоянии. Основным недостатком культивирования каллусных культур тканей растений является необходимость ручного труда. Культивирование на плотной питательной среде используется для сохранения коллекции штаммов, линий и мутантов, а также получения суспензионных культур. Особенности суспензионного культивирования При внедрении технологии суспензивного культивирования необходимо учитывать основные свойства растительной клетки: • клетки растений в 50-100 раз больше клеток бактерий; • наличие целлюлозной клеточной оболочки; • интенсивность дыхания = 1 мкмоль кислорода в час на 106 клеток • в результате роста клетки увеличиваются в размере; • суспензионные культуры состоят из клеточных агрегатов. В связи с вышеуказанными факторами суспензионное культивирование проводится в эрлифных биореакторах с высокой интенсивностью газообмена. 2. Установите правильную последовательность стадий и операций технологического процесса, представленных на схеме, заполните недостающие операции стадии «Биологическая очистка отходов». Предложите методы и аппаратурное оснащение биологической очистки сточных вод. Определить понятия: активный ил, рекомбинантные штаммы-деструктаторы. 1. Подготовка и стерилизация оборудования и коммуникаций. 2. Подготовка и стерилизация газового потока 3. Биологическая очистка отработанного воздуха 4. Подготовка и стерилизация субстрата 5. Утилизация мицеллиарных отходов 6. Подготовка биообъекта 7. Выделение целевого продукта 8. Культивирование биообъекта 9. Анализ целевого продукта 10. Сушка целевого продукта 11. Фасовка, упаковка, маркировка лекарственной субстанции 12. Биологическая очистка отходов Правильная последовательность стадий и операций: 6, 1, 4, 2, 8, 7, 10, 9, 11, 12, 5, 3, биоочистка сточных вод. В процессе биотехнологического производства образуются отходы в виде сточных вод, мицеллярной массы и газов. Твердые мицеллярные отходы, получаемые после отделения культуральной жидкости, содержащей целевой продукт, могут в дальнейшем использоваться как субстрат или компонент субстрата для других микроорганизмов, осуществляющих синтез целевых продуктов. Биомасса клеток после соответствующей обработки может быть использована в качестве пеногасителя в биореакторах, как компонент топлива и входить в состав строительных материалов. Отработанный воздух через систему фильтров бактериальной очистки уходит в атмосферу. Сточная вода образуется на стадиях выделения, очистки и сушки (концентрирования) целевого продукта. Биологическая очистка сточных вод является для микробиологического и фармацевтического производства, с одной стороны, выходной (заключительной) стадией, решающей задачу очистки отработанных жидкостных потоков, а с другой стороны — технологической стадией основного производства, решающей задачу создания замкнутой технологической схемы. Биологически очищенная вода (БОВ), отвечающая нормам, может быть вновь использована в технологическом цикле, благодаря чему использование свежей воды сокращается до минимума. Биологическая очистка бытовых и промышленных сточных вод основана на способности микроорганизмов, преимущественно бактерий, к минерализации загрязнений органического происхождения. Механизм биологической очистки заключается в следующем: в результате дезаминирования белков аммонифицирующими бактериями и автолиза клеток образуется аммиак, который бактерии-нитрификаторы окисляют до нитратов и нитритов. В биотехнологических производствах и для очистки бытовых и промышленных сточных вод применяют активный ил, содержащий природный комплекс микроорганизмов. Активный ил получают насыщением природного ила воздухом. Активный ил содержит множество бактерий и простейших, причем бактерии разлагают растворенные вещества, а простейшие удаляют тонкие взвеси и поедают бактерий, в том числе и патогенных. Соотношение отдельных видов микроорганизмов и простейших в активном иле зависит от состава сточных вод, нагрузки по органическому субстрату, обеспечения кислородом. В условиях достаточной аэрации при наличии высоких концентраций загрязнений и биогенных элементов (С, Р, К и др.) создаются наиболее благоприятные условия для развития бактерий, которые играют основную роль в процессе биоочистки. Однако при более глубокой очистке увеличивается количество простейших. Качество очистки сточных вод определяется также седиментационными свойствами ила, которые характеризуются показателем «иловый индекс». Чем хуже оседает ил, тем более высокий индекс он имеет и тем больше свободноплавающих бактерий содержится в очищенной воде. При благоприятных условиях развития бактерии и простейшие ила образуют хлопья размером до 150 мкм, интенсивно идет процесс флокуляции и отделения активного ила от очищенной воды. Для разложения и детоксикации негниющих синтетических веществ, находящихся в промышленных стоках, используют специальные штаммы-деструктаторы. Это генно-инженерные штаммы микроорганизмов, обладающие повышенной способностью к деструкции и неустойчивые в естественных природных условиях. Генно-инженерные штаммы-деструктаторы используют также в часы «пиковой нагрузки» на систему очистки жидких отходов. 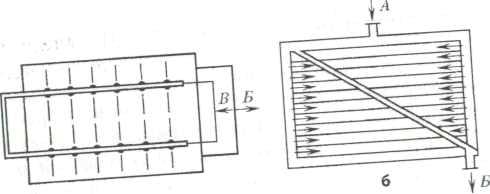 а Рис. 1. Схемы работы усреднителей сточных вод: а - с барботажной аэрацией; б — коридорного типа; А — поток поступающих сточных вод; Б — поток с усреднителя на биоочистку; В — воздух на барботаж 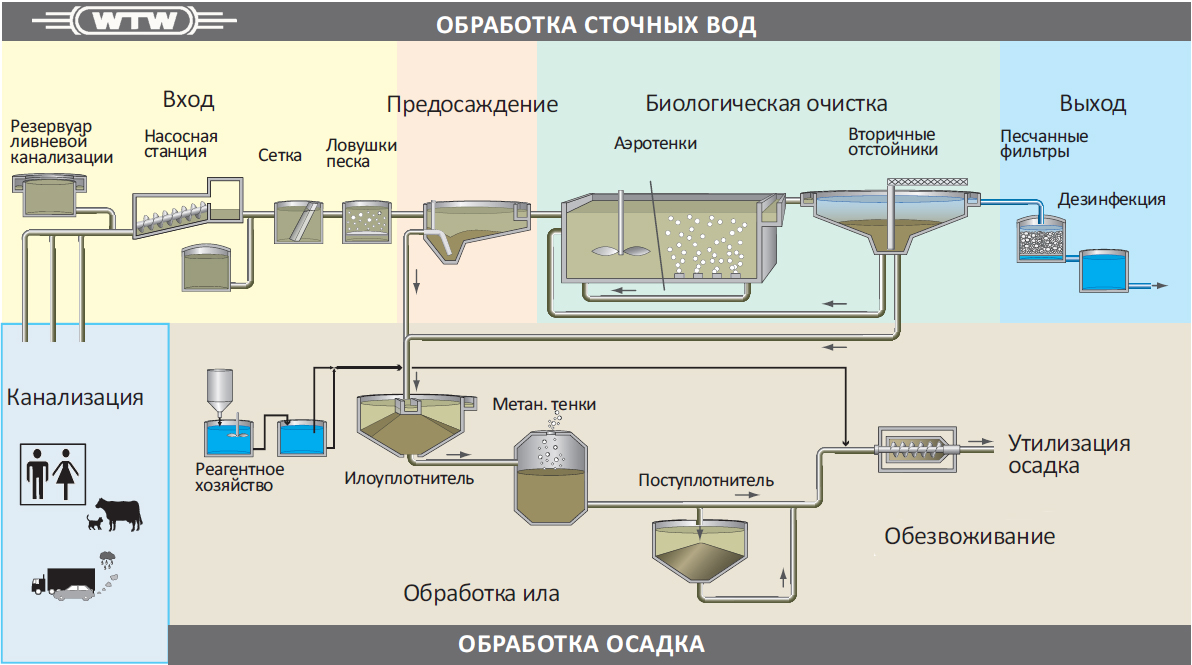 Процесс биохимической счистки сточных вод реализуется в специальных аппаратах - реакторах к числу которых относятся аэротенки, биофильтры, окситенки метанотенки. Наибольшее распространение на биохимических предприятиях настоящее время получили аэротенки, где в условиях аэрзиии осуществляются методом глубинного культивирования микроорганизмов активного ила утилизация и разрушение органических загрязнений сточных вод. Аэротенки разделяются на вытеснители и смесители. К первому классу относятся азротенки коридорного типа, в которых по ходу движения потока сточных вод происходит утилизация органических загрязнений. К премуществам аэротенков-вытеснителей коридорного типа относится возможность более глубокой утилизации загрязнений Недостатком традиционных коридорных аэротенков-вытеснителей является чувствительное колебаниям нагрузок, залповым сбросам, а также неравномерность скорости окисления и использования аэрационной мощности по длине аппарата. 3. Опишите процесс, изображенный на рисунке, по следующей схеме: - метод исследования генов; - цель определения существенности гена для патогенного организма; - принципы выбора гена для проведения исследования данным методом; - строение вектора pIVET8; - основные этапы исследования; - цель и особенности этапа in vitro; - цель и особенности этапа in vivo; - селективные признаки и отбор колоний для дальнейших исследований. 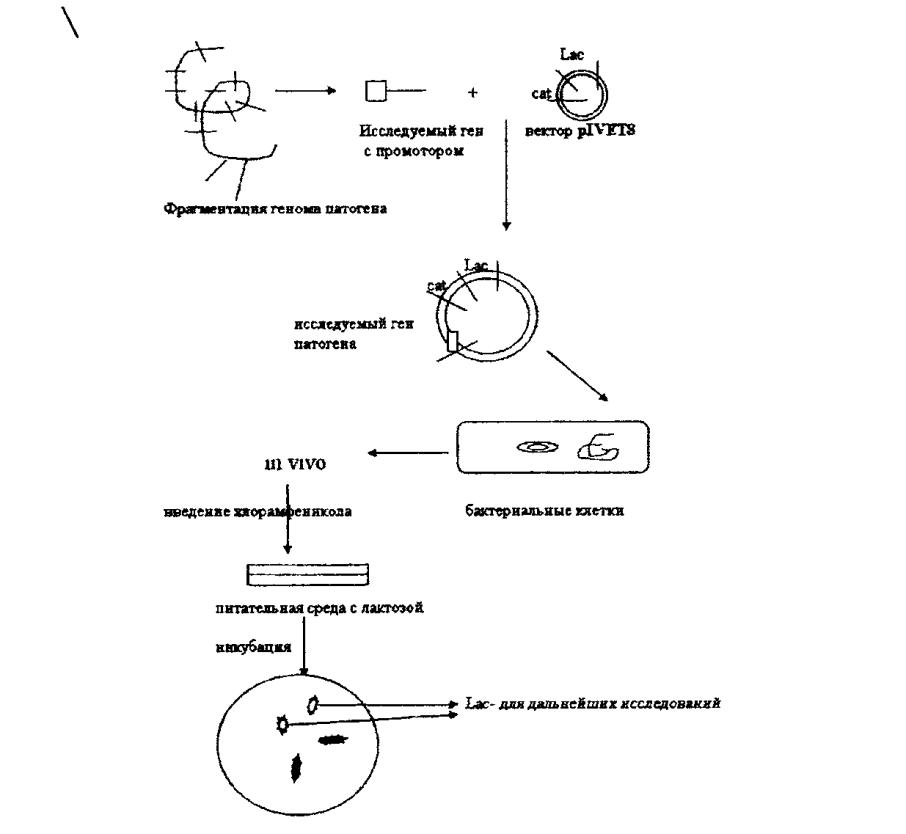 - метод исследования генов Метод IVET с использованием вектора pIVET8 - цель определения существенности гена для патогенного организма Метод IVET (In vivo expression technology) основан на захвате промотора и использовании целостного живого организма или культуры животных клеток как селективной среды, выявляющей экспрессию ivi генов. Необходимость изучения взаимодействия антимикробного агента с клеткой патогенного микроорганизма. Исследование взаимодействия антибиотика и клетки патогена необходимо, потому что Антибиотик может не проникать в клетку, Антибиотик может подвергаться ферментативной инактивации Антибиотик будет вступать во взаимодействие с другими макромолекулами клетки Патоген закроет доступ антибиотика к таргету - принципы выбора гена для проведения исследования данным методом Существенность (значение) конкретного гена для жизнедеятельности и размножения патогенного микроорганизма определяется при его трансляции в живом организме. Геномика на основе определения состава и размеров минимального генома, необходимого и достаточного для существования самостоятельного организма, позволяет дифференцировать у патогена гены «house keeping» (гены «домашнего содержания», экспрессия которых происходит всегда как in vivo, так и in vitro) и гены ivi-гены вирулентности. Гены вирулентности не экспрессируются на искусственных питательных средах, где они могут быть скрытыми, но обязательно экпрессируются в инфицированном организме. Способность воспринимать сигналы, поступающие из окружающей возбудителя инфекции среды, и давать на них ответ является ключевым компонентом патогенности. Ряд ivi генов кодирует регуляторные функции, усиливающие чувствительность к поступающим в клетку сигналам. Расшифровка сигнальной трансдукции - процесса передачи сигналов от клеточной мембраны на геном к транскрипционным факторам, регулирующим активацию отдельных «молчащих» генов, и создание ингибиторов сигнальной трансдукции является одним из путей таргетного скрининга. К ivi генам относятся также гены патогена, кодирующие образование токсинов, а также систем выживания в условиях воздействия на патоген факторов неспецифического иммунитета организма хозяина, систем жизнеобеспечения патогена в условиях дефицита метаболитов, неорганических ионов в жидкостях и тканях инфицированного организма человека. Гены ivi становятся в современных исследованиях существенной мишенью, инактивация продуктов экпрессии которых приведет к прекращению размножения и гибели патогена. Доказать существенность (значимость) гена для патогена возможно несколькими методами, но для большинства лабораторий применим метод IVET, т.к. позволяет выделить ivi гены экспрессируемые только в инфицированном организме. - строение вектора pIVET8 Вектор pIVET8 содержит ген cat, кодирующего синтез фермента хлорамфеникол-ацетилтрансферазы, обуславливающей выживание бактерий в животном организме при введении хлорамфеникола. Этапы метода IVET фрагментирование генома патогена встраивание гена патогена в плазмиду рIVET трансформация бактериальных клеток селекция in vivo селекция in vitro - цель и особенности этапа in vivo При селекции в животном организме через сутки после введения культуры гибридных клеток мышам вводили хлорамфеникол, не способные к экспрессии гена catклетки погибают. Выделенные из мышей штаммы высевают на индикаторную среду с лактозой. Клетки подвергают селекции в живом организме, для чего культуру вводят мышам интрагастрально или интраперинатально, или добавляют к культуре мышиных макрофагов и инкубируют в течение 3 часов. Клетки, не усвоившие вектор pIVET8, не способны синтезировать аденин и, следовательно, образовывать полноценные ДНК, погибают. Клетки, усвоившие вектор pIVET8, выживают за счет экспрессии гена cat на основе промотора бактериального гена В живом организме или культуре клеток выживают бактериальные ауксотрофные клетки, несущие как гены ivi, так и гены «домашнего содержания» исследуемого патогенного организма. - цель и особенности этапа in vitro С целью выявления клеток с ivi генами прошедшие селекцию в условиях целостного организма или в культуре клеток штаммы высевают на индикаторную среду с лактозой и аденином. В пуле (массиве) бактериальных клеток, выделенных из животного объекта, резко увеличивается по сравнению с исходным предселекционным массивом количество клеток, дающих на индикаторной среде окрашенные красные и розовые (Lac+) колонии, что свидетельствует о наличии в составе вектора патогенного гена «домашнего содержания». Промотор гена «house keeping» обеспечивает экспрессию гена LacZ, синтез фермента бета-галактозидазы, разлагающего лактозу до глюкозы и галактозы и приводящий к изменению рН. Изменение рН регистрируется с помощью индикатора, входящего в состав питательной среды и колонии окрашиваются в красный или розовый цвет. Если с Lac-геном соединены фрагменты ДНК, кодирующие гены, экспрессирующиеся только in vivo, то колонии на среде с лактозой оказываются неокрашенными. Белые (Lac-) колонии обозначают, что для роста на лабораторной среде экспрессия генов данного фрагмента ДНК не нужна. Lac- колонии, содержащие ivi гены, отбирают для дальнейшей идентификации генов. 4. Определите лекарственную субстанцию по описанию технологического процесса, назовите продуцент и метод его совершенствования: «...продуцент сконструирован по технологии рекомбинантных ДНК. Клонируемая ДНК получена на основе мРНК, и в составе вектора введена в клетки кишечной палочки. Рекомбинантный продуцент помещен в ферментатор на жидкую питательную среду. По завершении процесса культивирования целевой продукт выделен и очищен комбинацией методов ионнообменной хроматографии, осаждения и гель-фильтрации. Лекарственная субстанция стимулирует образование гранулоцитов, макрофагов, вызывает повышение концентрации эозинофилов и моноцитов в крови...». Молграмостим – генно-инженерный гранулоцитарномакрофагальный колониестимулирующий фактор. Продуцент - клетки Escherichia соli, несущие генно-инженерную плазмиду с геном данного фактора человека. Метод его совершенствования – технология рекомбинантных ДНК 5. Определите лекарственную субстанцию по описанию технологического процесса, назовите продуцент и метод его совершенствования: «...штамм Bacillus subtilis сконструирован методом генной инженерии. Отбор высокопродуктивных клонов проведен по устойчивости к аналогу целевого продукта. В качестве аналога использован розеофлавин. Сверхпродуцент культивируют на питательной среде с мелассой и дрожжевым экстрактом втечение 25-35 ч при температуре 37°С в условиях аэации. Целевой продукт секретируется в культуральную жидкость в количестве 3,4-4,0 г/л целевого продукта. Лекарственную субстанцию выделяют из культуральной жидкости по растворимости в щелочах и кислотах и низкой растворимости в органичных жидкостях...». Рибофлавин (витамин В2) Для промышленного получения витамина В2 используют сильные сверхпродуценты - дрожжеподобные грибы группы аскомицетов Eremothecium ashbyii и Ashbya gossypii (грибы, паразитирующие на хлопчатнике). Методами генной инженерии в России сконструирован штамм Bacillus subtilis. Генно-инженерный штамм Bacillus subtilis синтезирует рибофлавин в три раза быстрее, чем Eranothecium ashbytt, и более устойчив к экзогенной контаминации. 6. Перечертите в тетрадь и заполните таблицу:
ЛИТЕРАТУРА 1. Биотехнология лекарственных средств и диагностических препаратов. Учебно-методическое пособие.- Барнаул: АГМУ, 2003. 2. Машковский М.Д. Лекарственные средства. В двух томах.- Изд. 13-е, новое.- Харьков, Торсинг,1998. 3. Машковский М.Д. Лекарственные средства. В двух томах.- Изд.14-е. -Москва, ООО «Новая волна», 2002. 4. Слагаемые и структура биотехнологического производства лекарственных средств: Учебно-методическое пособие.- Барнаул: АГМУ, 2000.-122 с. 5. Технология лекарственных форм. Под ред. Л.А.Ивановой.- М..Медицина. 1991.-т.2., глава 19. - С. 476-490. |
