Контр 1.. Контрольная работа по курсу твердофазные реакции
 Скачать 157 Kb. Скачать 157 Kb.
|
|
Контрольная работа по курсу «ТВЕРДОФАЗНЫЕ РЕАКЦИИ»  Содержание 1. Твердофазные реакции. Классификация твердофазных реакций по Будникову П.П. и Гинстлинг А.М……………………………………………….3 2. Кинетическая модель топохимических (твердофазных) реакций. Модель академика Ерофеева Б. В…………………………………………………………7 Список использованной литературы…………………………………………...13 1. Твердофазные реакции. Классификация твердофазных реакций по Будникову П.П. и Гинстлинг А.М. Процессы, протекающие в твердофазных материалах, имеют ряд важных отличий от процессов, протекающих в жидкостях или газах. Эти отличия связаны, прежде всего, с существенно (на несколько порядков) более низкой скоростью диффузии в твердых телах, что препятствует усреднению концентрации компонентов в системе и, таким образом, приводит к пространственной локализации протекающих процессов. Пространственная локализация в свою очередь приводит к тому, что в наблюдаемую кинетику процессов вносит вклад как удельная скорость процесса (или коэффициент диффузии), так и геометрия реакционной зоны. Такие определяемые геометрическими факторами особенности твердофазных процессов называют топохимическими. Кроме того, поскольку превращения пространственно локализованы, их скорость может определяться как собственно процессами на границе раздела фаз (реакционный контроль), так и скоростью подвода к этой границе какого-либо из компонентов или отвода продукта (ов) (диффузионный контроль). Для простых систем, для которых выполняются модельные предположения, различные реакции могут быть идентифицированы в эксперименте по виду временной зависимости степени превращения. Еще одна особенность фазовых превращений в твердых телах связана с тем, что образование зародыша новой фазы в твердой матрице вызывает появление в последней упругих напряжений, энергия которых в ряде случаев должна учитываться при рассмотрении термодинамики этих превращений. Большое число факторов, влияющих на кинетику твердофазных процессов и микроструктуру получаемых при этом материалов, определяет и множественность типов классификации этих процессов. Так, рассматривая устойчивость системы по отношению к флуктуациям различного типа, выделяют гетерогенные (в случае систем, устойчивых к малым по занимаемому объему флуктуациям и неустойчивых к большим) и гомогенные (в случае систем, неустойчивых к малым флуктуациям) процессы. Для гетерогенных процессов в качестве примера можно привести превращения, идущие по механизму образования и роста зародышей, для гомогенных ‑ некоторые переходы порядок ‑ беспорядок и спинодальный распад твердых растворов. От гетерогенных и гомогенных процессов необходимо отличать гетерогенное и гомогенное зародышеобразование в случае гетерогенных процессов. Гетерогенным зародышеобразованием называют образование зародышей на дефектах структуры (включая точечные дефекты дислокации и границы раздела фаз); гомогенным зародышеобразованием — образование зародышей в бездефектном объеме твердой фазы. Анализируя продукт твердофазного превращения, различают однофазные и многофазные зародыши. В случае многофазных зародышей продуктом процесса оказывается многофазная колония с характерной микроструктурой, определяемой поверхностной энергией границы образующихся фаз; процессы данного типа называют прерывистыми в отличие от непрерывных в случае образования и роста однофазных зародышей. Еще один способ классификации твердофазных превращений основан на сопоставлении состава исходной фазы и состава продукта реакции. В случае их совпадения говорят о бездиффузионных процессах, а при изменении состава ‑ о диффузионных. Причем из бездиффузионных полезно выделить кооперативные процесс (например, мартенситное превращение), происходящие путем одновременного незначительного перемещения атомов в больше объеме исходной фазы. Бездиффузионные фазовые превращения могут различаться по типу изменяющихся в ходе процесса их термодинамических характеристик. Превращениями первого рода называют процессы, которых происходит изменение производных химического потенциала по температуре или давлению. Отсюда следует скачкообразное изменение при фазовом переходе таких термодинамических параметров, как энтропия, объем, энтальпия, внутренняя энергия. При превращениях второго рода первые производные химического потенциала по интенсивным параметрам не меняются, изменяются производные более высоких порядков (начиная второго). В этих процессах при непрерывных энтропии и объеме системы происходит скачкообразное изменение величин, выражаемых через вторые производные энергии Гиббса: теплоемкости, коэффициента теплового расширения, сжимаемости и т. д. Твердофазные реакции между двумя фазами (контакты между тремя или более фазами маловероятны, а соответствующие процессы могут быть представлены как комбинации нескольких двухфазных реакций) относятся к диффузионным процессам и могут быть как гетерогенными, так и гомогенными, как с гетерогенным, так и с гомогенным зародышеобразованием. Гомогенные процессы и процессы с гомогенным зародышеобразованием при таких реакциях возможны, например, в случае образования метастабильного твердого раствора с последующим его распадом (так называемые внутренние реакции). Твердофазовые реакции осуществляются за счет взаимодействия между частицами твердых веществ без участия жидкой или газовой фаз. В газовых или жидких смесях термодинамически возможные реакции происходят сравнительно легко при условиях, определяемых простыми статистическими законами. При взаимодействии же твердых тел, элементы структуры которых обладают малой подвижностью, способность веществ вступать в химическое взаимодействие друг с другом является недостаточным условием протекания реакции. Кроме того, реакциям с участием твердых тел присущи и другие особенности: 1) химическое превращение происходит внутри ограниченной зоны твердого тела; 2) если в реакции участвует несколько реагентов, твердые продукты взаимодействия могут образовывать слой, затрудняющий протекание реакций. Как правило, твердофазовая реакция начинается на поверхности. Наиболее обстоятельно вопрос о классификации твердофазовых реакций рассмотрен Будниковым П.П. и Гинстлингом А.М. Они предложили группировать их по следующим процессам: 1) непосредственное взаимодействие между частицами твердых веществ; 2) протекающие при участии газовой фазы; 3) протекающие при одновременном участии газовой и жидкой фаз. Для второй группы процессов, протекающих при участии газовой фазы, возможны пути химического взаимодействия: 1) возгонка: (Ат Аг) 2) диссоциация: АВт Аг + Вт 3) превращение в газообразный продукт: Ат + Вт АВг В качестве примера возгонки можно привести получение карбида кремния из кремнезема и углерода: SiO2 + Si 2SiO SiOт SiOг SiOг + 2С SiС + СО Тот же путь и при образовании шпинели при взаимодействии оксидов цинка и алюминия: ZnO + Al2O3 ZnAl2O4 ZnOт ZnOг ZnOг + Al2O3 ZnAl2O4 Возможны и иные принципы классификации твердофазовых реакций. 2. Кинетическая модель топохимических (твердофазных) реакций. Модель академика Ерофеева Б. В. Топохимические реакции – химические реакции, происходящие в твердой фазе, при которых процесс локализован на границе раздела твердое исходное вещество – твердый продукт реакции. Примеры топохимических реакций: дегидратация кристаллогидратов, окисление металлов, реакции процессов обжига, разложение взрывчатых веществ и др. название «топохимические» было предложено в 1918 г. Кольшуттером и в буквальном переводе означает: реакции, протекание которых связано с определенным местом в кристалле (от греческого «» – место). Основные черты топохимических реакций в значительной мере определяются тем, что реагирующие атомы, молекулы или ионы, образующие кристалл, жестко закреплены в узлах кристаллической решетки и лишены той подвижности, которой они обладают в газовой или жидкой фазах. Реакционная способность атомов или ионов в сильной степени зависит от того, в каком месте кристалла они находятся (в объеме, на поверхности грани, на ребре кристалла, на его вершине или на пороге дислокации). В связи с этим, при топохимических реакциях существенное значение приобретает реальная структура кристалла, связанная с наличием в кристалле различного рода дефектов, а образующийся при реакции твердый продукт, находясь в контакте с непрореагировавшим исходным веществом, может оказывать на скорость реакции каталитическое влияние, сила которого зависит от состояния продукта реакции. Благодаря тому, что при топохимических реакциях допустимо лишь минимальное перемещение реагирующих частиц, очень часто продукт реакции сохраняет внешнюю форму кристаллов исходного вещества. Так как процесс локализован в пределах реакционной зоны, скорость процесса пропорциональна величине реакционной зоны в данным момент времени. Следовательно процесс лимитируется образованием центров кристаллизации (твердого продукта реакции). Первоначально, как только центры реакции образовались, скорость реакции невелика, но по мере их роста, скорость – возрастает. Начиная с какого-то момента времени, зародыши начинают пересекаться. Момент их пересечения соответствует максимальной скорости. После пересечения площадь реакционной зоны начинает сокращаться, при этом уменьшается скорость.    d/d d/d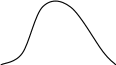 а б Рисунок 1. а – зависимость доли прореагировавшего вещества от времени; б – зависимость скорости реакции от времени. На основании таких простых представлений о развитии топохимических реакций было выведено большое количество кинетических уравнений, наиболее простым из них является уравнение, предложенное Рогинским и Шульцем. Если число зародышей после того, как началась реакция, остается постоянным, скорость реакции должна быть пропорциональна реакционной поверхности S каждого зародыша. Так как поверхность двумерна S = l2, а объем (и следовательно масса, которая пропорциональна объему) трехмерен v = l3, то выражая l через v и, соответственно, через степень прореагировавшего вещества , получим: Согласно этому уравнению, скорость реакции пропорциональна доли прореагировавшего вещества в степени 2/3, а общее количество прореагировавшего вещества пропорционально кубу времени. Уравнение было применено для анализа кинетических данных по термическому разложению твердых веществ. Процесс разложения азида кальция описывается на 40%, а -азида свинца на 50%. Из самого смысла уравнения следует, что оно может быть применено лишь в первой стадии реакции – до максимума скорости. После пересечения зародышей реакционная поверхность будет меньше, чем это следует из суммирования реакционных поверхностей отдельных зародышей, и поэтому начиная с этого момента, уравнение будет давать завышенные значения скорости реакций. Слияние реакционных поверхностей отдельных зародышей приводит к образованию общей реакционной поверхности, которая пропорциональна поверхности непрореагировавшей части кристалла. Выражая эту поверхность через массу непрореагировавшего вещества, получим следующее уравнение где а – масса непрореагировавшего вещества к моменту времени . Если, к примеру, в результате слияния зародышей образуется реакционная зона сферической формы, то скорость процесса хорошо описывается уравнением сокращающейся сферы Эти простые уравнения применяют при описании кинетики разложения многих веществ, однако экспериментально многие процессы не описываются этими уравнениями. Существует целый класс реакций, для которых число зародышей N определяется уравнением где n – показатель степени, для быстрых экзотермических реакций n = 4-8 до 20. Он зависит от геометрической формы зародышей (куб, плоскость, сфера и т.д.). Кинетика подобных реакций хорошо описывается обобщенным уравнением кинетики топохимических реакций выведенное Ерофеевым в 1946г. где p – вероятность реагирования. Позднее это уравнение приведено к наиболее известному в настоящее время виду топокинетического уравнения применительно к реакциям твердых веществ Это уравнение известно как Уравнение Ерофеева. По Ерофееву n – число последовательных стадий при образовании устойчивого начального центра новой фазы, плюс постоянное число, характеризующее форму зародыша, и равное 3 при образовании сферического зародыша, 2 – цилиндрического и 1 – плоского. Из смысла уравнения следует, что сопоставление скоростей по константе скорости может быть сделано лишь в том случае, если n постоянно, что наблюдается далеко не всегда. По смыслу константа скорости должна иметь ту же размерность, что и константа скорости мономолекулярной реакции. В уравнении (130) постоянная k зависит от n. В общем случае величина n отражает характер развития реакционной зоны. Во всех случаях. Когда n>1, исследуемый процесс находится в кинетической области. При n<1 процесс находится в диффузионной области. Саковичем показано, что постоянная k из уравнения не является еще константой скорости. Константа скорости может быть рассчитана по уравнению Размерность константы скорости, находимой по этому уравнению, соответствует размерности константы мономолекулярной реакции. Рассмотрим пример, когда уравнение может быть применимо, для процессов, лимитируемых диффузией. В этом случае показатель n должен быть меньше единицы. Степень отклонения показателя n от единицы (1-n) Сакович определяет как меру погружения реакции в диффузионную область. Итак, в дважды логарифмированном виде уравнение представляет собой уравнение прямой lg-lg(1-)=nlg+lgk+lglge. Откладывая по оси абсцисс значения lg, а по оси ординат значения lg-lg(1-), мы должны получить прямую линию, если наши экспериментальные результаты описываются уравнением. В качестве примера приводим кинетический анализ экспериментальных данных по скорости дегидратации пентагидрата сульфата меди. Откладывая значения lg по оси абсцисс, а значения lg-lg(1-) по оси ординат, видим, что экспериментальные точки ложаться на прямую линию, рис 32. Находя из графика тангенс угла наклона этой прямой к оси абсцисс, получаем значение n = 1,88. lg 1,0 2,0       0 0    -1,0 -1,0 lgk lgk tg = n  -2,0 -2,0Рисунок 2. Кинетический анализ экспериментальных данных по уравнению Казеева – Ерофеева – Колмогорова. Значение lgk может быть найдено из того же графика. Для этого продолжаем прямую до пересечения с осью ординат, находим значение lg-lg(1-) в точке пересечения – 2,56. Поскольку в нашем расчете мы оперируем не натуральными логарифмами, а десятичными, вычитая из него -lglge = -0,36, получаем для lgk = - 2,20. Как уже указывалось выше, для того чтобы найти константу скорости, нужно значение k из топокинетического уравнения подставить в выражение, предложенное Саковичем, или в логарифмической форме Подставив в это уравнение lgn, n и lgk, значения которых нам известны, найдем Список использованной литературы 1. Алесковский В. Б. Химия твёрдых веществ: учебное пособие. / Алесковский В. Б. М.: Высш.шк., 2018, - 256 с. 2. Епифанов Г. И. Физика твёрдого тела. Пособие для вузов. Изд. 2-е, перераб. и доп. / Епифанов Г. И. – М.: «Высшая школа» , 2017. – 275 с. 3. Калаганов, Б.Ф. Задачи и упражнения по общей химии / Б.Ф. Калаганов, З.В. Плоткина. - М.: Университет дружбы народов им. П. Лумумбы, 2016. - 122 c. 4. Левин Б.Е., Третьяков Ю.Д., Летюк Л.М., Физико-химические основы получения, свойства и применение твердых тел. / Е. Б. Левин. – М.: Металлургия, 2018. – 472 с. 5. Некрасов, Б.В. Краткий курс общей химии / Б.В. Некрасов. - М.: ОНТИ НКТП СССР; Издание 3-е, перераб., 2018. - 396 c. 6. Перекалин, В.В. Органическая химия / В.В. Перекалин, С.А. Зонис. - М.: Просвещение, 2016. - 686 c. 7. Третьяков Ю. Д., Химия и технология твёрдофазных материалов: учебное пособие./ Третьяков Ю. Д., М.: Изд-во Моск.ун-та, 2015, - 256 с. 8. Третьяков Ю. Д. Твёрдофазные реакции: учебное пособие. / Третьяков Ю. Д., М.: Изд-во «Химия», 2018, - 360 с. 9. Хомченко, И.Г. Общая химия / И.Г. Хомченко. - М.: Новая Волна, 2017. - 464 c. 10. Щукин, Е.Д. Коллоидная химия / Е.Д. Щукин, А.В. Перцов, Е.А. Амелина. - М.: Высшая школа; Издание 4-е, испр., 2019. - 444 c. |
