Контрольная работа ЭЛЕКТРИЧЕСКИЕ И КОНСТРУК,МАТ, 1.. Контрольные вопросы 4 Механизм кристаллизации путем самопроизвольного образования зародышевых центров 6
 Скачать 5.27 Mb. Скачать 5.27 Mb.
|
|
Содержание: Введение 2 1. Контрольные вопросы 4 2. Механизм кристаллизации путем самопроизвольного образования зародышевых центров 6 3. Диаграмма состояния компонентов с ограниченной растворимостью в твердом состоянии. Связь кривых охлаждения с равновесной диаграммой 10 4. Вредные примеси в сталях и их влияние на свойства 17 5. Классификация алюминиевых сплавов 21 5.1. Расшифровать маркировки и указать области применения 22 Заключение 24 Список литературы: 25 Введение Материаловедение - междисциплинарный раздел науки, изучающий изменения свойств материалов состоянии в зависимости от некоторых факторов. К изучаемым свойствам относятся структура веществ, электронные, термические, химические, магнитные, оптические свойства этих веществ. Кроме того, эта наука использует целый ряд методов, позволяющих исследовать структуру материалов. При изготовлении наукоёмких изделий в промышленности, особенно при работе с объектами микро - и наноразмеров необходимо детально знать характеристику, свойства и строение материалов. Знание структуры и свойств материалов приводит к созданию принципиально новых продуктов и даже отраслей индустрии. Однако и классические отрасли также широко используют знания, полученные учёными-материаловедами для нововведений, устранения проблем, расширения ассортимента продукции, повышения безопасности и понижения стоимости производства. Эти нововведения были сделаны для процессов литья и других процессов производства. В контрольной работе по дисциплине "Электротехнические и конструкционные материалы" необходимо ответить на вопросы соответствующие первому варианту: типы кристаллических решёток металлов; механизм кристаллизации путём самопроизвольного образования зародышевых центров; диаграмма состояния компонентов с ограниченной растворимостью в твёрдом состоянии. Связь кривых охлаждения с равновесной диаграммой; вредные примеси в сталях и их влияние на свойства; классификация алюминиевых сплавов; расшифровать маркировки и указать области применения. 1. Контрольные вопросы Типы кристаллических решёток металлов (элементарные кристаллические ячейки, количество атомов на одну элементарную ячейку) Кристалл состоит из атомов (ионов), расположенных в определенном порядке, который периодически повторяется в трех измерениях. Для описания атомно-кристаллической структуры пользуются понятием пространственной или кристаллической решетки. Кристаллическая решетка представляет собой воображаемую пространственную сетку, в узлах которой располагаются атомы (ионы), образующие металл (твердое кристаллическое тело). Наименьший объем кристалла, дающий представление об атомной структуре металла во всем объеме, получил название элементарной кристаллической ячейки. Металлы образуют одну из следующих высокосимметричных сложных решеток с плотной упаковкой атомов: кубическую объемно-центрированную, кубическую гранецентрированную и гексагональную. 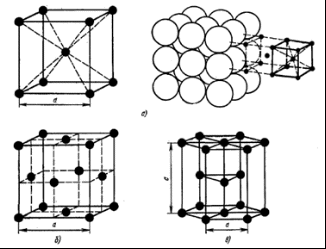 Рисунок 1 - Кристаллическая решетка: а - кубическая объемно-центрированная (о. ц. к.); б - кубическая гранецентрированная (г. ц. к.); в - гексагональная плотноупакованная (г. п. у.) В кубической объемно-центрированной решетке (рисунок 1, а) атомы расположены в узлах ячейки и один атом - в центре объема куба. Кубическую объемно-центрированную решетку имеют следующие металлы: Rb, К, Na, Li, Tiβ, Tlβ, Zrβ, Та, W, V, Feα, Cr, Nb, Ba. На одну элементарную ячейку объемно-центрированной решетки в целом приходятся два атома: один атом в центре куба и один атом по массе суммарно вносят атомы, располагающиеся в вершинах куба (каждый атом в вершине куба одновременно принадлежит восьми сопряженным элементарным ячейкам и на данную ячейку приходится лишь 1/8 массы этого атома, а на всю ячейку 1/8 × 8 = 1 атом). В кубической гранецентрированной решетке (рисунок 1, б) атомы расположены в углах куба и в центре каждой грани. Этот тип решетки имеют металлы: Саα, Се, Srα, Th, Pb, Sc, Ni, Ag, Au, Pd, Pt, Rh, Ir, Feγ, Си, Coα. На элементарную ячейку гранецентрированной кубической решетки приходятся четыре атома; из них один атом (по такому же расчету, как и для объемно-центрированной решетки) вносят атомы, находящиеся в вершинах куба (1/8 × 8), и три атома вносят атомы, находящиеся на середине грани, так как каждый из таких атомов принадлежит двум решеткам. В гексагональной решетке (рисунок 1, в) атомы расположены в углах и центре шестигранных оснований призмы и три атома в средней плоскости призмы. Эту упаковку атомов имеют металлы: Hfα, Mg, Tiα, Cd, Re, Os, Ru, Zn, Coβ, Be, Caα, Laα, Tlα, Zrα. На элементарную ячейку гексагональной плотноупакованной решетки приходятся шесть атомов (3 + 1/6 × 12 + 1/2 × 2 = 6). 2. Механизм кристаллизации путем самопроизвольного образования зародышевых центров Явления, протекающие в процессе кристаллизации, сложны и многообразны. Особенно трудно представить начальные стадии процесса, когда в жидкости образуется первый кристаллик, или центр кристаллизации. Очевидно, что для выяснения условий появления этих центров надо ясно представить строение исходного жидкого металла. Схематические модели кристаллической и жидкой фаз представлены на рисунке 2.  Рисунок 2 - Модели кристаллической (а) и жидкой (б и в) фаз металла В жидком металле атомы не расположены хаотично, как в газообразном состоянии, и в то же время в их расположении нет той правильности, которая характерна для твердого кристаллического тела (рисунок 2, а), где атомы сохраняют постоянство межатомных расстояний и угловых соотношений на больших расстояниях (дальний порядок). В жидком металле (рис.2, б) сохраняется лишь так называемый ближний порядок, когда упорядоченное расположение атомов распространяется на очень небольшое расстояние. Вследствие интенсивного теплового движения атомов ближний порядок динамически неустойчив. Микрообъемы с правильным расположением атомов, возникнув, могут существовать некоторое время, затем рассасываться и возникать вновь в другом элементарном объеме жидкости и так далее. С понижением температуры степень ближнего порядка и размер таких микрообъемов возрастают. При температурах, близких к температуре плавления, в жидком металле возможно образование небольших группировок, в которых атомы упакованы так же, как в кристаллах. Такие группировки называются фазовыми (или гетерофазными) флуктуациями (рисунок 2, в). В чистом от примесей жидком металле наиболее крупные гетерофазные флуктуации превращаются в зародыши (центры кристаллизации). Зародыши, возникающие в процессе кристаллизации, могут быть различной величины. Рост зародышей возможен только при условии, если они достигли определенной величины, начиная с которой их рост ведет к уменьшению свободной энергии. В процессе кристаллизации свободная энергия системы (рисунок 3, а) уменьшается на VΔf вследствие перехода некоторого объема жидкого металла в твердый, а также и возрастает в результате образования поверхности раздела с избыточной поверхностной энергией, равной Sσ. 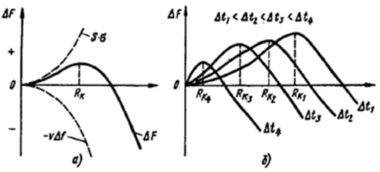 Рисунок 3 - Изменение свободной энергии металла при образовании зародышей кристалла в зависимости от их размера (а) и степени переохлаждения (б) Общее изменение свободной энергии можно определить из следующего выражения: где V - объем зародыша; Δf - разность свободных энергий жидкого и твердого металла Fж - Fт; S - суммарная величина поверхности кристаллов; σ - поверхностное натяжение. Чем меньше величина зародыша, тем выше отношение его поверхности к объему, а, следовательно, тем большая часть от общей энергии приходится на поверхностную энергию. Изменение свободной энергии металла ΔF при образовании кристаллических зародышей в зависимости от их величины R и степени переохлаждения показано на рисунке 3, б. При образовании зародыша размером меньше Rк или критического (рисунок 3, б) Rк1, Rк2, Rк3, Rк4 свободная энергия системы возрастает, так как приращение свободной энергии вследствие образования новой поверхности перекрывает ее уменьшение в результате образования зародышей твердого металла, то есть объемной свободной энергии. Следовательно, зародыш размером меньше Rк расти не может и растворится в жидком металле. Если возникает зародыш размером более Rк, то он устойчив и способен к росту, так как при увеличении его размеров свободная энергия системы уменьшается. Минимальный размер зародыша Rк, способного к росту при данных температурных условиях, называется критическим размером зародыша, а сам зародыш критическим, или равновесным. Величину критического зародыша можно определить из соотношения: На образование критического зародыша затрачивается энергия (работа) ΔFк, равная одной трети его поверхностной энергии: ΔFк = 1/3 Sσ. Следовательно, уменьшение объемной свободной энергии при переходе атомов из жидкого состояния в твердое кристаллическое недостаточно для образования критического зародыша. Оно лишь на две трети компенсирует энергетические затраты, связанные с образованием поверхности зародыша. Образованию зародыша способствует неравномерное распределение энергии между атомами вещества. При каждой данной температуре большинство атомов имеет энергию, соответствующую некоторой средней величине. Однако в малых объемах вещества всегда существует некоторое количество атомов, которые имеют энергию, меньшую или большую средней энергии. Эти случайные и временные отклонения энергии отдельных атомов или группировок атомов от среднего значения для данной температуры называют флуктуациями энергии. Энергия, требуемая для образования зародыша критического размера, может быть получена за счет энергетических флуктуаций: зародыш, способный к росту, образуется там, где гетерофазные флуктуации в жидком металле размером не меньше критического обладают повышенной энергией, которая не менее определенного уровня. Образование зародышей в жидком металле по описанному выше механизму называется самопроизвольным (или спонтанным). Самопроизвольное образование зародышей на основе фазовых и энергетических флуктуации может происходить только в высокочистом жидком металле. 3. Диаграмма состояния компонентов с ограниченной растворимостью в твердом состоянии. Связь кривых охлаждения с равновесной диаграммой Диаграммы состояния, или диаграммы фазового равновесия в удобной графической форме показывают фазовый состав сплава в зависимости от температуры и концентрации. Диаграммы состояния строят для условий равновесия или условий, достаточно близких к ним. Ограниченная растворимость наиболее часто встречается в металлических сплавах. Оба компонента неограниченно растворимы в жидком состоянии, ограниченно в твердом и не образуют химических соединений. При образовании ограниченных твердых растворов различают два типа диаграмм состояния: с эвтектическим и с перитектическим превращением. Диаграмма с эвтектикой. В этой системе не образуются фазы, представляющие собой чистые компоненты. Из жидкости могут выделяться только твердые растворы α или β. Следовательно, около вертикалей А и В (рисунок 4), соответствующих чистым компонентам, находятся области существования твердых растворов α или β. Предельная растворимость компонента В в А определяется линией DF, а предельная растворимость А в В - линией CG. 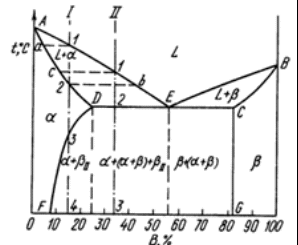 Рисунок 4 - Диаграмма состояния с эвтектикой Сплавы, находящиеся между этими двумя линиями, находятся за пределами растворимости и являются двухфазными, состоящими из α+β. Окончание кристаллизации происходит по эвтектической реакции L→α+β. Линия АЕВ является на этой диаграмме линией ликвидус, линия АDСВ - линией солидус. Кристаллизация сплава I. Выше точки 1 сплав находится в жидком состоянии. В точке 1 начинается процесс кристаллизации. Выделяются кристаллы твердого раствора α, концентрация которого изменяется по кривой а - 2, а состав жидкости изменяется по кривой 1 - b. В точке 2 кристаллизация закончится, и полученные кристаллы твердого раствора должны иметь (для равновесной кристаллизации) концентрацию исходной жидкости. Эти кристаллы не претерпевают изменений до точки 3, лежащей на линии предельной растворимости. Ниже этой точки твердый раствор α является пересыщенным и выделяет избыточные кристаллы. Такими кристаллами являются кристаллы β-твердого раствора, что определяют, применяя правило рычага для сплава, лежащего внутри двухфазной области α+β (для сплава ниже линии DF). Состав твердого раствора α изменяется по кривой 3 - F, вследствие выделения кристаллов β концентрации G. Количество кристаллов β при охлаждении увеличивается. Количество кристаллов β, выделившихся из сплава I, характеризуется отрезком по вертикали I до линии 3 - F. Кристаллы β, выделившиеся из твердого раствора, называются вторичными кристаллами и часто обозначаются символом βII в отличие от первичных β-кристаллов (βI), выделяющихся из жидкости. Процесс выделения вторичных кристаллов из твердой фазы носит название вторичной кристаллизации в отличие от процесса первичной кристаллизации, когда кристаллы (первичные) образуются в жидкой фазе. Сплав, концентрация которого лежит левее точки F, не будет иметь вторичных выделений β-кристаллов. Так как линия CG в отличие от линии FD изображена на рисунке 4 вертикальной, то есть растворимость компонента А в В не зависит от температуры, то вторичных выделений α-кристаллов нет, но они были бы. Если бы линия CG была наклонена вправо, то есть растворимость уменьшалась бы с понижением температуры. Точка D для твердого раствора α показывает максимальную растворимость компонента В в компоненте А при наиболее благоприятных условиях. Кривая охлаждения и схемы структур этого сплава при различных температурах показаны на рисунке 5, а. 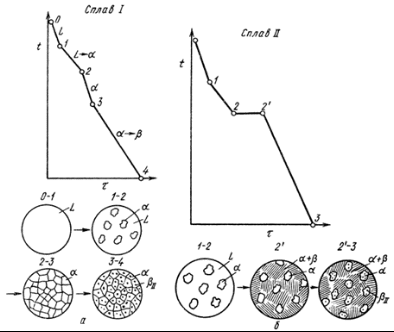 Рисунок 5 - Кривые охлаждения и схемы структур: а - сплава, образующего при кристаллизации твердый раствор с последующим выделением вторичной фазы; б - доэвтектического сплава Кристаллизация сплава II. При кристаллизации этого сплава, в отличие от предыдущего, при достижении горизонтальной линии DEC наступает нонвариантная реакция. В равновесии находятся три фазы - жидкость Е, α-кристаллы состава точки D и β-кристаллы состава точки C. По достижении температуры, соответствующей горизонтали DEC, наступает эвтектическая реакция - из жидкости выделяются кристаллы обоих твердых растворов: LЕ→αD+βC. Реакция эта нонвариантная, так как при двух компонентах в реакции участвуют три фазы (с = k - f + 1 = 2 - 3 + 1 = 0). Все три фазы, участвующие в реакции, имеют определенные составы (проекции точек E, D и C) и температура их превращения постоянна. В результате кристаллизации сплава II, кроме первичных (выделившихся при охлаждении от точки 1 до точки 2) кристаллов α, образуется еще эвтектика α+β. При дальнейшем охлаждении вследствие изменения растворимости α-кристаллы (как первичные, так и входящие в эвтектику) будут иметь состав, отвечающий точке F. Кривая охлаждения сплава II и структуры этого сплава показаны на рисунке 5, б. Выделение вторичных кристаллов из эвтектических составляющих обычно не обнаруживается при микроскопическом исследовании, так как вторичные выделения объединяются с такой же (одноименной) фазой эвтектики. Несмотря на многообразие структурных составляющих, окончательно охлажденный сплав содержит только две фазы α и β, и правило фаз, если его применить ниже линии DE, покажет все количество α - и β-фаз независимо от того, в какой структурной форме они находятся. Диаграмма с перитектикой. При эвтектическом превращении жидкость кристаллизуется с образованием двух твердых фаз. Возможен и другой тип нонвариантного превращения (трехфазного равновесия), когда жидкость реагирует с ранее выпавшими кристаллами и образует новый вид кристаллов L+β→α. Реакция подобного типа называется перитектической. Диаграмма с перитектическим превращением показана на рисунке 6. 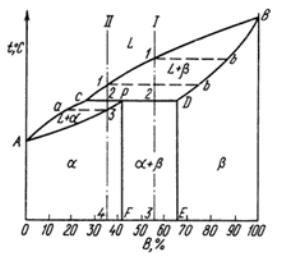 Рисунок 6 - Диаграмма состояния с перитектикой На диаграмме показаны три однофазные области: жидкость L и ограниченные твердые растворы α и β. Линия АВС является линией ликвидус, линия APDB - линией солидус. 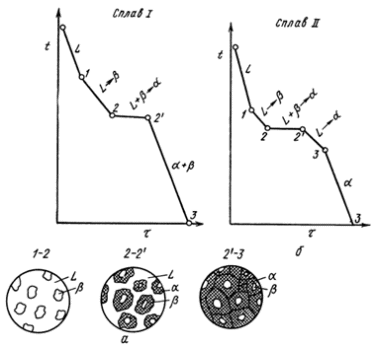 Рисунок 7 - Кривые охлаждения сплавов после окончания перитектической реакции, в которых в избытке остаются: а - твердый раствор, б - жидкая фаза Кристаллизация сплава I. Кристаллизация начинается в точке 1 (рисунок 7, а), когда из жидкости выпадают кристаллы β-раствора состава точки b. Затем по мере снижения температуры жидкость меняет свою концентрацию по линии ликвидус от точки 1 до точки С, а кристаллы β - по линии солидус от точки b до точки D. По достижении перитектической горизонтали СPD состав жидкости будет отвечать точке С, а состав кристаллов - точке D. Эти обе фазы реагируют и дают третью фазу α, концентрация которой определяется точкой P - третьей точкой на горизонтали. Перитектическая реакция изображается следующим образом: LС+βD→αP, так как точки D и P показывают предельную концентрацию твердых растворов β и α (для простоты линии предельной растворимости даны вертикальными). Количественное соотношение фаз при перитектической реакции, необходимое для образования α-фазы, определяется по правилу отрезков соотношением: В рассматриваемом же сплаве количество участвующих в перитектической реакции кристаллов β и жидкости определяется соотношением: то есть в данном сплаве имеется избыток β-фазы по сравнению с тем количеством, которое необходимо для образования α-кристаллов. Поэтому по окончании реакции в избытке остаются β-кристаллы. Следовательно, в структуре будут продукты перитектической реакции (то есть α-кристаллы) и оставшиеся избыточные первичные β-кристаллы. Чем ближе точка 2 лежит к точке P, тем меньше в реакции остается избыточных β-кристаллов. Для сплава, отвечающего по концентрации точке P, соотношение реагирующих при перитектическом превращении жидкости и β-кристаллов таково, что оно как раз достаточно для образования α-кристаллов предельной концентрации. Для перитектической кристаллизации характерно то, что новая α-фаза появляется на границе реагирующей друг с другом жидкости и β-кристаллов. Для сплава I перитектической реакцией заканчивается процесс кристаллизации. Кристаллизация сплава II (рисунок 7, б). Отличие кристаллизации этого сплава от кристаллизации сплава I состоит в том, что при перитектической температуре имеется избыток жидкой фазы по сравнению с тем количеством, которое необходимо для образования α-кристаллов концентрации P. Поэтому перитектическое превращение заканчивается исчерпанием β-твердого раствора, и оставшаяся жидкость в интервале между точками 2' - 3 кристаллизуется в α-фазу. При этом концентрация жидкости изменяется по кривой С - а, а концентрация образующихся α-кристаллов - по Р - 3 (рисунок 6). 4. Вредные примеси в сталях и их влияние на свойства Сталь является многокомпонентным сплавом, содержащим углерод и ряд постоянных или неизбежных примесей: Mn, Si, S, Р, О, N, Н и другие, которые оказывают влияние на ее свойства. Присутствие этих примесей объясняется трудностью удаления части из них при выплавке (Р, S), переходом их в сталь в процессе ее раскисления (Mn, Si) или из шихты - легированного металлического лома (Cr, Ni). Влияние углерода. Структура стали после медленного охлаждения состоит из двух фаз - феррита и цементита. Количество цементита возрастает в стали прямо пропорционально содержанию углерода, твердость цементита во много раз больше твердости феррита. Твердые и хрупкие частицы цементита повышают сопротивление движению дислокаций, то есть повышают сопротивление деформации, и, кроме того, они уменьшают пластичность и вязкость. Вследствие этого с увеличением в стали углерода возрастают твердость, пределы прочности и текучести и уменьшаются относительное удлинение, относительное сужение и ударная вязкость. Повышение содержания углерода облегчает переход стали в хладноломкое состояние. При содержании в стали углерода свыше 1,0-1,1% ее твердость в отожженном состоянии возрастает, а предел прочности уменьшается. Последнее объясняется выделением по границам бывшего зерна аустенита вторичного цементита, образующего в сталях указанного состава сплошную сетку. При испытании на растяжение в этой сетке возникают высокие напряжения, и цемент, будучи хрупким, разрушается. Это приводит к преждевременному разрушению образца и соответственно к снижению предела прочности. С увеличением содержания углерода в стали снижается плотность, растет электросопротивление и коэрцитивная сила и понижаются теплопроводность, остаточная индукция и магнитная проницаемость. Влияние кремния и марганца. Содержание кремния в углеродистой стали в качестве примеси обычно не превышает 0,35-0,4%, а марганца 0,5-0,8%. Кремний и марганец переходят в сталь в процессе ее раскисления при выплавке. Они раскисляют сталь, то есть соединяясь с кислородом закиси железа FеO, в виде окислов переходят в шлак. Эти процессы раскисления улучшают свойства стали. Кремний, дегазируя металл, повышает плотность слитка. Кремний, остающийся после раскисления в твердом растворе (в феррите), сильно повышает предел текучести. Это снижает способность стали к вытяжке, и особенно холодной высадке. В связи с этим в сталях, предназначенных для холодной штамповки и холодной высадки, содержание кремния должно быть сниженным. Марганец заметно повышает прочность, практически не снижая пластичности и резко уменьшая красноломкость стали, то есть хрупкость при высоких температурах, вызванную влиянием серы. Влияние серы. Сера является вредной примесью в стали. С железом она образует химическое соединение FeS, которое практически нерастворимо в нем в твердом состоянии, но растворимо в жидком металле. Соединение FeS образует с железом легкоплавкую эвтектику с температурой плавления 988°С, эвтектика образуется даже при очень малых содержаниях серы. Кристаллизуясь из жидкости по окончании затвердевания, эвтектика преимущественно располагается по границам зерна. При нагревании стали до температуры прокатки или ковки (1000 - 1200°С) эвтектика расплавляется, нарушается связь между зернами металла, вследствие чего при деформации стали в местах расположения эвтектики возникают надрывы и трещины. Это явление носит название красноломкости. Присутствие в стали марганца, обладающего большим сродством к сере, чем железо, и образующего с серой тугоплавкое соединение MnS, практически исключает явление красноломкости. В затвердевшей стали частицы MnS располагаются в виде отдельных включений. В деформированной стали эти включения деформируются и оказываются вытянутыми в направлении прокатки. Сернистые включения сильно снижают механические свойства, особенно ударную вязкость и пластичность в поперечном направлении вытяжки при прокатке и ковке, а также предел выносливости. Работа зарождения трещины не зависит от содержания серы, а работа развития вязкой трещины и вязкость разрушения с увеличением содержания серы резко снижаются. Кроме того, эти включения ухудшают свариваемость и коррозионную стойкость. В связи с этим содержание серы в стали строго ограничивается; в зависимости от качества стали оно не должно превышать 0,035-0,06%. Влияние фосфора. Фосфор является вредной примесью, и содержание его в зависимости от качества стали допускается не более 0,025 - 0,045%. Растворяясь в феррите, фосфор сильно искажает кристаллическую решетку и увеличивает пределы прочности и текучести, но уменьшает пластичность и вязкость. Снижение вязкости тем значительнее, чем больше в стали углерода. Фосфор значительно повышает порог хладноломкости стали и уменьшает работу развития трещины. Сталь, содержащая фосфор на верхнем пределе для промышленных плавок (0,045%), имеет работу распространения трещины в 2 раза меньшую, чем сталь, содержащая менее 0,005% Р. Каждая 0,01% Р повышает порог хладноломкости стали на 20-25°С. Вредное влияние фосфора усугубляется тем, что он обладает большой склонностью к ликвации. Вследствие этого в серединных слоях слитка отдельные участки сильно обогащаются фосфором и имеют резко пониженную вязкость. Современные методы получения стали не обеспечивают глубокого очищения металла от фосфора. Влияние азота, кислорода и водорода. Азот и кислород присутствуют в стали в виде хрупких неметаллических включений (например, окислов FeO, SiO2, А12О3, нитридов Fe4N), в виде твердого раствора или, находясь в свободном виде, располагаются в дефектных участках металла (раковинах, трещинах). Примеси внедрения (азот, кислород), концентрируясь в зернограничных объемах и образуя выделения нитридов и оксидов по границам зерен, повышают порог хладноломкости и понижают сопротивление хрупкому разрушению. Неметаллические включения (окислы, нитриды, частицы шлаков), являясь концентраторами напряжений, могут значительно понизить, если они присутствуют в повышенных количествах или располагаются в виде скоплений, предел выносливости и вязкости разрушения. Очень вредным является растворенный в стали водород, который сильно охрупчивает сталь. Поглощенный при выплавке стали водород не только охрупчивает сталь, но приводит к образованию в катаных заготовках и крупных поковках флокенов. Флокены представляют собой очень тонкие трещины овальной или округлой формы, имеющие в изломе вид пятен - хлопьев серебристого цвета. Флокены резко ухудшают свойства стали. Металл, имеющий флокены, нельзя использовать в промышленности. Влияние водорода при сварке проявляется в образовании холодных трещин в наплавленном и основном металле. Нанесение на поверхность стальных изделий гальванических покрытий или травление в кислотах для очистки ее связано с опасностью насыщения поверхности водородом, что также вызывает охрупчивание. Если водород находится в поверхностном слое, то он может быть удален в результате нагрева при 150 - 180°С, лучше всего в вакууме. Наводороживание и охрупчивание возможно и при работе стали в контакте с водородом, особенно при высоком давлении. 5. Классификация алюминиевых сплавов Наибольшее распространение получили сплавы: А1 - Сu, Al - Si, Al - Mg, Al - Сu - Mg, Al - Сu - Mg - Si, Al - Mg - Si, а также Al - Zn - Mg - Сu. В равновесном состоянии эти сплавы представляют собой низколегированный твердый раствор и интерметаллидные фазы CuAl2 (Ɵ-фаза), Mg2Si, Al2CuMg (S-фаза),. A16CuMg4 и A12Mg3Zn3 (T-фаза), Al3Mg2 и другие (рисунок 8). 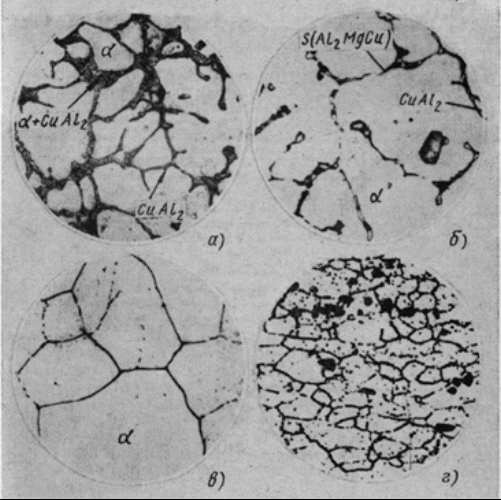 Рисунок 8 - Микроструктура сплавов алюминия: а - литой сплав А1+12% Сu (α-раствор и кристаллы эвтектики α + CuAl2 и CuAl2); б - литой сплав Д16 (α-раствор и кристаллы CuAl2 и Al2MgCu); в - сплав Д16 после закалки (α-фаза); г - сплав Д16 после закалки и старения Все сплавы алюминия можно разделить на три группы: деформируемые, предназначенные для получения полуфабрикатов (листов, плит, прутков, профилей труб), а также поковок и штамповок путем прокатки, прессования, ковки и штамповки; литейные, предназначенные для фасонного литья; получаемые методом порошковой металлургии (САП - спеченные алюминиевые порошки, САС - спеченные алюминиевые сплавы). Деформируемые сплавы по способности упрочняться термической обработкой подразделяют на сплавы, не упрочняемые термической обработкой, и сплавы, упрочняемые термической обработкой. Сплавы алюминия широко применяют в тех случаях, когда важно снижение массы машины (конструкции). 5.1. Расшифровать маркировки и указать области применения У12А - сталь инструментальная углеродистая. Применение: режущие инструменты, работающие в условиях, не вызывающих разогрева режущей кромки: метчики ручные, метчики машинные мелкоразмерные, плашки для круппов, развертки мелкоразмерные, надфили, измерительный инструмент простой формы (гладкие калибры, скобы). С2ВА - 0,65% углерода, 2% кремния, 1% вольфрам, 1% азот. Сталь конструкционная рессорно-пружинная. Применение: ответственные и высоконагруженные пружины и рессоры. ШХ15 - 15% хром. Сталь конструкционная подшипниковая. Применение: шарики диаметром до 150 мм, ролики диаметром до 23 мм, кольца подшипников с толщиной стенки до 14 мм, втулки плунжеров, плунжеры, нагнетательные клапаны, корпуса распылителей, ролики толкателей и другие детали, от которых требуется высокая твердость, износостойкость и контактная прочность. Н9Х12Т2Б - углерода нет, 9% никель, 12% хром, 2% титан, 1% ниобий. Высоколегированная сталь 24%. Д16 - Al основа. Дюралюминий, дюраль. Алюминиевый деформируемый сплав. Применение: для силовых элементов конструкций самолетов, кузовов автомобилей, труб; для деталей, работающих при температурах до 230°С. БрКМц3-1 - другое обозначение CuSi3Mn1, основа медь, кремний 3%, марганец 1% Бронза безоловянная, обрабатываемая давлением. Применение: детали химических аппаратов, пружины и пружинящие детали, детали для судостроения, а также сварных конструкций; проволока для ручной сварки в защитных газах нежестких конструкций из меди и автоматической сварки меди под флюсом. Заключение В результате проведенной работы изучены некоторые разделы материаловедения и металлообработки: типы кристаллических решеток металлов, элементарные кристаллические ячейки и количество атомов на одну элементарную ячейку; механизм кристаллизации путем самопроизвольного образования зародышевых центров, то есть начальные стадии процесса, когда в жидкости образуется первый кристаллик, или центр кристаллизации; диаграмма состояния компонентов с ограниченной растворимостью в твердом состоянии (диаграмма с эвтектикой и диаграмма с перитектикой). Изучена связь кривых охлаждения с равновесной диаграммой; вредные примеси в сталях и их влияние на свойства многокомпонентных сплавов; классификация алюминиевых сплавов; расшифрованы маркировки некоторых сплавов и указаны области их применения. Таким образом, задачи контрольной работы решены в полном объеме. Список литературы: 1. Гуляев, А.П. Металловедение: Учебник для вузов. 6-е изд., перераб. и доп / А.П. Гуляев. - М.: Металлургия, 1986. - 544 с, ил. 2. Лахтин, Ю.М. Материаловедение: Учебник для машиностроительных вузов.2-е изд., перераб. и доп. / Ю.М. Лахтин, В.П. Леонтьева. - М.: Машиностроение, 1980. - 493 с, ил. 3. http://splav. kharkov.com/mat_start. php? name_id=368 |
