лекарственное растительное сырье, содержащее дубильные вещества. курсовая сивикова. Курсовая работа по фармакогнозии лекарственное растительное сырье, содержащее дубильные вещества
 Скачать 1.14 Mb. Скачать 1.14 Mb.
|
|
Глава 2. Фитохимический анализ лекарственного растительного сырья, содержащего дубильные вещества Качественный анализ исследуемой группы БАВ Все качественные реакции, которые осуществляются для идентификации дубильных веществ можно подразделить на 2 категории: реакции осаждения и хромогенные (цветные) реакции [7, 10, 18]. Реакции осаждения: 1) При взаимодействии дубильных веществ с 1% раствором желатина, приготовленном на 10% растворе натрия хлорида, образуется осадок или возникает помутнение раствора. При добавлении избытка желатина помутнение исчезает. 2) Танниды дают обильные осадки с алкалоидами (кофеин, пахикарпин, 1% раствор хинина хлорида - появляется аморфный осадок за счет образования водородных связей между гидроксильными группами дубильных веществ и атомами азота алкалоида), а также некоторыми азотистыми основаниями (уротропин, новокаин, дибазол). 3) При взаимодействии с 10% раствором уксуснокислого свинца – (CH3COO)2Pb дубильные вещества гидролизуемой группы образуют хлопьевидный осадок. 4) Дубильные вещества конденсированной группы образуют хлопьевидный осадок в реакции с бромной водой. Цветные реакции: 1) Дубильные вещества гидролизуемой группы с раствором железоаммонийных квасцов образуют черно-синие окрашенные соединения, а конденсированной группы - черно-зеленые. 2) Если в растении одновременно содержатся дубильные вещества и гидролизуемой и конденсированной группы, то вначале гидролизуемые таниды осаждают 10% раствором ацетата свинца, осадок отфильтровывают, а затем проводят реакцию фильтрата с раствором железоаммонийных квасцов. Появление темно-зеленой окраски свидетельствует о наличии веществ конденсированной группы. Групповые качественные реакции на дубильные вещества представлены в таблице 2 [10, 18, 21]: Таблица 2. Реактивы и эффекты реакций на дубильные вещества различных групп
Методики количественного определения дубильных веществ Согласно ОФС.1.5.3.0008.18 «Определение содержания дубильных веществ в лекарственном растительном сырье и лекарственных растительных препаратах» определение содержания дубильных веществ проводят титриметрическим (перманганатометрическим) и/или спектрофотометрическим методами [8]. Титриметрический метод заключается в определении суммы дубильных веществ в пересчете на танин, а спектрофотометрический метод позволяет определять сумму дубильных веществ в пересчете на пирогаллол или (+)-катехин в зависимости от группы дубильных веществ (гидролизуемые или конденсируемые соответственно), если в фармакопейной статье не указан другой стандартный образец [4, 8, 27]. Арбитражным методом определения содержания дубильных веществ в лекарственном растительном сырье и лекарственных растительных препаратах является спектрофотометрический метод. Метод 1. Определение суммы дубильных веществ в пересчете на танин: Около 2 г (точная навеска) измельченного лекарственного растительного сырья или лекарственного растительного препарата, просеянного сквозь сито с отверстиями размером 3 мм, помещают в коническую колбу вместимостью 500 мл, заливают 250 мл нагретой до кипения воды и кипятят с обратным холодильником на электрической плитке с закрытой спиралью в течение 30 мин при периодическом перемешивании. Полученное извлечение охлаждают до комнатной температуры и фильтруют через вату в мерную колбу вместимостью 250 мл так, чтобы частицы сырья/препарата не попали в колбу, доводят объем раствора водой до метки и перемешивают. 25,0 мл полученного водного извлечения помещают в коническую колбу вместимостью 1000 мл, прибавляют 500 мл воды, 25 мл раствора индигосульфокислоты и титруют при постоянном перемешивании 0,02 М раствором калия перманганата до золотисто-желтого окрашивания. Параллельно проводят контрольный опыт: в коническую колбу вместимостью 1000 мл помещают 525 мл воды, 25 мл раствора индигосульфокислоты и титруют при постоянном перемешивании 0,02 М раствором калия перманганата до золотисто-желтого окрашивания. 1 мл 0,02 М раствора калия перманганата соответствует 0,004157 г дубильных веществ в пересчете на танин. Содержание суммы дубильных веществ в пересчете на танин в абсолютно сухом сырье в процентах (Х) вычисляют по формуле, указанной на рисунке:  Рисунок 16. Расчет количественного содержания дубильных веществ, Х% (в пересчете на танин) перманганатометрическим методом. Метод 2. Определение суммы дубильных веществ спектрофотометрическим методом – арбитражный метод [4, 8, 21]: Около 2,0 г (точная навеска), если иное не указано в частной фармакопейной статье, измельченного лекарственного растительного сырья или лекарственного растительного препарата, просеянного сквозь сито с отверстиями размером 1 мм, помещают в коническую колбу вместимостью 500 мл, заливают 250 мл воды и кипятят с обратным холодильником на электрической плитке с закрытой спиралью в течение 30 мин при периодическом перемешивании. Полученное извлечение охлаждают до комнатной температуры и фильтруют через вату в мерную колбу вместимостью 250 мл так, чтобы частицы сырья не попали в колбу, доводят объем раствора водой до метки и перемешивают. Полученный раствор фильтруют через бумажный фильтр диаметром около 125 мм, отбрасывая первые 50 мл фильтрата. Раствор А. 1,0 мл фильтрата помещают в мерную колбу вместимостью 25 мл, доводят объем раствора водой до метки и перемешивают. Измеряют оптическую плотность раствора А (А1) на спектрофотометре при длине волны 266 нм (для гидролизуемых дубильных веществ) или 278 нм (для конденсированных дубильных веществ), если иное не указано в фармакопейной статье, в кювете с толщиной слоя 10 мм относительно раствора сравнения. В качестве раствора сравнения используют воду. Раствор Б. К 5,0 мл фильтрата прибавляют 0,05 г кожного порошка, перемешивают полученную смесь в течение 30 мин и фильтруют через бумажный фильтр диаметром около 125 мм. 1,0 мл полученного фильтрата помещают в мерную колбу вместимостью 25 мл, доводят объем раствора водой до метки и перемешивают. Измеряют оптическую плотность раствора Б (А2) на спектрофотометре при длине волны 266 нм (для гидролизуемых дубильных веществ) или 278 нм (для конденсированных дубильных веществ), если иное не указано в фармакопейной статье, в кювете с толщиной слоя 10 мм относительно раствора сравнения. В качестве раствора сравнения используют воду. Раствор СО. 0,1 г (точная навеска) СО пирогаллола (для гидролизуемых дубильных веществ) или (+)-катехина (для конденсированных дубильных веществ), если иное не указано в фармакопейной статье, помещают в мерную колбу вместимостью 100 мл, растворяют в воде, доводят объем раствора водой до метки и перемешивают. 2,0 мл полученного раствора помещают в мерную колбу вместимостью 100 мл, доводят объем раствора водой до метки и перемешивают. Раствор используют свежеприготовленным. Измеряют оптическую плотность раствора СО (А3) на спектрофотометре при длине волны 266 нм (для гидролизуемых дубильных веществ) или 278 нм (для конденсированных дубильных веществ), если иное не указано в фармакопейной статье, в кювете с толщиной слоя 10 мм относительно раствора сравнения. В качестве раствора сравнения используют воду. Содержание суммы дубильных веществ в пересчете на пирогаллол или (+)-катехин в абсолютно сухом лекарственном растительном сырье или лекарственном растительном препарате в процентах (Х) вычисляют по формуле, указанной на рисунке 17, где: A1 – оптическая плотность раствора А; A2 – оптическая плотность раствора Б; A3 – оптическая плотность СО пирогаллола или (+) – катехина; a – навеска лекарственного сырья или лекарственного растительного препарата, г; ao – навеска СО пирогаллола или (+) – катехина, г; P – содержание основного вещества в СО пирогаллола или (+) – катехина,% W – влажность лекарственного растительного сырья или лекарственного растительного препарата, %. 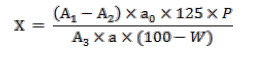 Рисунок 17. Формула расчета количественного содержания дубильных веществ спектрофотометрическим методом Согласно литературным данным, развивающимся и перспективным методом анализа дубильных веществ является кулонометрия. Сущность данного способа описана на примере количественного определения исследуемой группы БАВ дубровника белого (Teucrium polium) [1, 22]. Описание: В электролитическую ячейку на 50,0 мл вводят 20-25 мл фонового электролита, помещают рабочий (платиновый), вспомогательный (платиновый) и индикаторные электроды (платиновые игольчатые электроды). Включают генераторную и индикаторную цепи. При достижении индикаторным током определенного значения в ячейку вводят аликвоту исследуемого образца (0,4-0,5 мл) и одновременно включают секундомер. Величина разности потенциалов, накладываемая на индикаторные электроды, составляет 300 мВ. Конечную точку титрования фиксируют по достижению индикаторным током первоначального значения. Выключают секундомер и отключают индикаторную цепь. Определение проводят при комнатной температуре. Электрогенерацию йода проводили из 0,1 М раствора йодида калия в фосфатном буферном растворе (рН = 9,8) на платиновом электроде при постоянной силе тока 5,0 мА. Содержание дубильных веществ в лекарственном растительном сырье в пересчете на танин (X, %) рассчитывают по формуле, отраженной на рисунке: 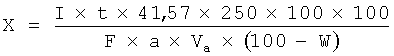 Рисунок 18. Формула расчета кулонометрического определения содержания дубильных веществ в растительных объектах Условные обозначения: I - сила тока, A; t - время достижения конечной точки титрования, с; 41,57 - условная величина молярной массы эквивалента танина, г/моль; а - навеска сырья, г; Va - объем аликвоты, вводимый в кулонометрическую ячейку, мл; 250 - объем водного извлечения из лекарственного растительного сырья, мл; W - потеря в массе при высушивании, %; F - постоянная Фарадея 96485 Кл/моль. Глава 3. Перспективные источники дубильных веществ из лекарственного растительного сырья 3.1. Исследование содержания дубильных веществ корней шиповника собачьего Шиповник собачий - Rosa canina (L.): густой кустарник, с дугообразными ветвями, высотой 1,5-2 метра. Шипы редкие, у основания весьма широкие, серповидно-изогнутые. Листья непарноперистые, 6-9 см длины, с 5-7 листочками продолговато-яйцевидной формы. Длина листочков 1,5-5 см, край зубчатый, снизу они серо-зелёного цвета. Плоды ягодообразные, сочные, светло-красного цвета. Чашелистики перисто-рассечённые, после цветения отгибаются вниз и опадают вниз, оставляя после себя пятиугольную площадку. Установлены внешние признаки цельного сырья: корневища узловатые, ветвистые, длиной 20-25 см, толщиной 10-12 см, с гладкой, блестящей поверхностью, красновато-бурого цвета. Корни по форме цилиндрические, изогнутые и слабоветвистые, цвет - коричневато-серый с бурым оттенком, на изломе желтовато-белый. Длина корней достигает 30 см, толщина - 0,3 -1,0 см. Запах слабый, терпкий [11, 24].  Рисунок 19 Внешний вид шиповника собачьего - Rosa canina Содержание дубильных веществ определяли в водном извлечении. Количественное определение органических кислот (фенолокислот) устанавливали титриметрическим методом, используя пермангонатометрическое титрование, определяли содержание дубильных и легко окисляемых веществ. Для определения танина в исследуемом сырье использовали микроколоночный жидкостный хроматограф «Милихром А-02», снабжённый колонкой из нержавеющей стали размером 2х75 мм, заполненный адсорбентом Prontosil 120-5CAQ. Анализ проводили методом изократического элюирования при комнатной температуре. В качестве подвижной фазы использовали систему растворителей кислота муравьиная 2% - ацетонитрил (60:40). При хроматографировании в предложенных условиях раствора РСО танина 0,1% фиксировались два симметричных пика со временем удерживания 1,85 и 2,45 мин, коэффициент разделения пиков составил 2,1. Содержание дубильных и легко окисляемых веществ, определяемые фармакопейным методом, составило 10,77±0,03%. Относительная ошибка при доверительной вероятности не превышает ±0,28%. В связи с тем, что фармакопейный перманганатометрический метод позволяет определить в растительном сырье не только содержание дубильных веществ, а сумму всех легко окисляемых соединений, переходящих в водное извлечение, нами для стандартизации сырья был использован метод высокоэффективной жидкостной хроматографии, как более точный и информативный метод качественного и количественного анализа, которым определили содержание в ЛРС танина, что в количественном соотношении равно (1,46±0,026%). На рисунке 20 представлены метрологические характеристики метода ВЭЖХ для определения дубильных веществ (ДВ) в корнях шиповника собачьего (в пересчете на танин) (рис.20) [24].  Рисунок 20. Метрологические характеристики метода ВЗЖХ для определения ДВ 3.2. Исследование содержания дубильных веществ растений семейства Hydrocharitaceae Материалом для исследования послужили образцы побегов растений семейства Hydrocharitaceae: Hydrocharis morsus - ranae L. (Водокрас лягушачий), Stratiotes aloides L. (Телорез алоевидный), Elodea canadensis Mich. (Элодея канадская), Egeria densa Planch. (Эгерия густая), Hydrilla verticillata Royle (Гидрилла мутовчатая) [19]. Для исследования компонентного состава отбор проб растений проводили в фазу цветения - начала плодоношения/вегетации после цветения (в июле-августе) из нескольких участков одного местонахождения. Отобранные рандомизированным путем, средние пробы высушивались до воздушно-сухого состояния и хранились при комнатных условиях до проведения испытаний. Полученные, путем экстрагирования горячей водой, водные извлечения (1:10) были подвергнуты количественному анализу пермагантометрическим методом, результаты которого представлены на рисунке 21 [19]. 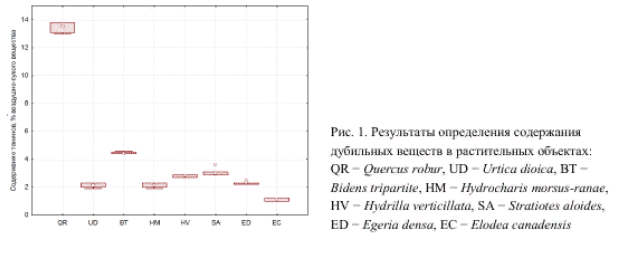 Рисунок 21. Результаты определения содержания дубильных веществ в растительных объектах Рисунок 21. Результаты определения содержания дубильных веществ в растительных объектахТаким образом, результаты количественного анализа позволили обнаружить гидролизуемые дубильные вещества у Hydrocharis morsus-ranae, а у Stratiotes aloides, Elodea canadensis, Egeria densa, Hydrilla verticillata - смесь гидролизуемых и конденсированных дубильных веществ. Наибольшим содержанием дубильных веществ отличается Stratiotes aloides, содержаний 3.1±0.1%, и Hydrilla verticillata, содержащая - 2.8±0.1%, минимальным - Elodea canadensis 1.1±0.1%. В качестве возможной фармакологической активности предложена – антиоксидантное действие. Также, были проведены исследования качественных характеристик выделенных дубильных веществ из растений рода Hydrocharitaceae путем проведения серии качественных реакций с 1% раствором железоамммонийных квасцов и 0,5% раствором бромной воды. |
