Защита металла от коррозии. Курсовая работа по специальности Химия Содержание. Введение а химическая коррозия б электрохимическая коррозия
 Скачать 272 Kb. Скачать 272 Kb.
|
1 2 Собирали ячейку, в неё с раствором NaCl подключали оксидированный и неоксидированный образцы. Получили полярность и значения потенциалов, которые представлены ниже:-для оксидированного образца, который прокипятили 2 раза : E= -0,198; -для оксидированного образца, который прокипятили 1 раз : E=+0,228. Защитные свойства покрытия. Поверхность оксидированного и неоксидированного образца парафинировали. В парафине делали отверстие и помещали туда каплю необходимого реактива, включали секундомер и замечали время изменения окраски всей капли. С течением времени капля должна была приобрести окраску красного цвета. Защитные свойства считают высокими, если это время изменения окраски больше 5 минут. В нашем случае это время составило: для неоксидированного –менее 5 мин. (плохие защитные свойства);для оксидированного и прокипяченного один раз – более 5 мин. , это хуже, чем у оксидированного и прокипячённого 2 раза. На основе этого сделать вывод о том, что защитные свойства полученного нами покрытия высокие у оксидированного образца прокипяченного 2 раза. На одном из образцов определяли распределение анодно-катодных зон, используя соответствующий раствор. Через некоторый промежуток времени мы наблюдали изменение окраски в 2 цвета, что и свидетельствовало о распределение анодно-катодных зон: катодная зона окрасилась в розовый, анодная зона окрасилась в синий. Коррозионные испытания. В рабочий раствор (дистиллированная вода) завесили шесть образцов для коррозионных испытаний (из расчёта определения изменения массы через 1 неделю, 2 недели). При этом мы брали 2 раствора без добавки ингибитора и один с добавкой органического ингибитора. По прошествии указанного выше времени, мы вытащили образцы из растворов и взвесили их. Сначала с образовавшимися на пластинках продуктами, затем без них. Данные записали в таблицу ниже:
где: m1-исходная масса пластинки + масса образовавшихся продуктов; m2-масса пластинки, очищенной от продуктов. Далее мы провели расчёт по следующим формулам: m – m1 = масса образовавшихся растворимых продуктов на пластинках; m – m2 = масса образовавшихся нерастворимых продуктов. При этом надо заметить, что масса образцов, завешанных в раствор с ингибитором, уменьшилась. Это говорит о том, что все образовавшиеся продукты на пластинках растворимы.
Получение анодных и катодных поляризационных кривых. В данной работе использовали потенциостат марки П – 5827, к нему подключали ячейку с тремя электродами: 1 электрод – рабочий (сталь 3), 2 электрод - сравнения (хлорсеребряный), 3 электрод – вспомогательный (графитный). Использовались два раствора: 0,1М NaCl и 0,001 HCl. В них снимали анодную и катодную поляризационные кривые. В бестоковом условии, когда не подавали ток на ячейку, установился коррозионный потенциал стального электрода относительно хлорсеребряного (- 480 mB). Снимая катодную кривую, мы навязывали боле отрицательные значения потенциала, то есть мы подавали более положительные значения потенциала и смещались в положительную сторону. Все полученные данные мы занесли в таблицы:
0,001 HCl 0,1 NaCl Результаты и их обсуждение. По полученным данным построили следующие поляризационные кривые: 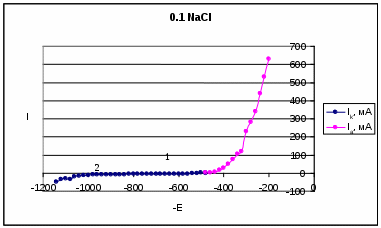 На данной катодной поляризационной кривой (синего цвета) выделили две области: 1 – область восстановления кислорода; 2 – область выделения водорода. Диффузионный ток в данном процессе равняется скорости коррозии. Ток диффузии равен 580 мА. Ниже перестроили анодную поляризационную кривую в координатах E – lg I: 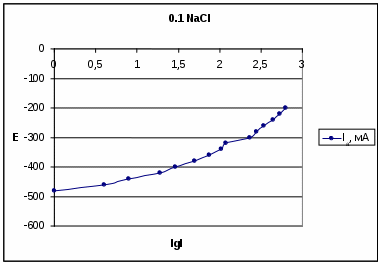 Тангенс угла наклона данной кривой составил: tg α = 140/1,8 = 77,8 На основе этого можно сделать вывод ,что в данном процессе лимитирующей стадией является перенос заряда. 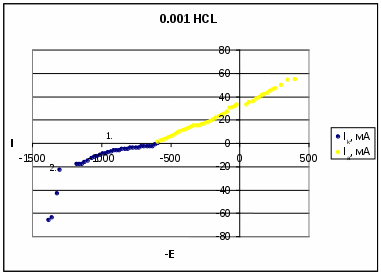 На данном катодной поляризационной кривой (синего цвета) также выделили две области: 1 – область восстановления кислорода; 2 – область выделения водорода. Рассчитали диффузионный ток (он также равен скорости коррозии), он равен 400 мА. Ниже перестроили анодную поляризационную кривую в координатах E – lg I: 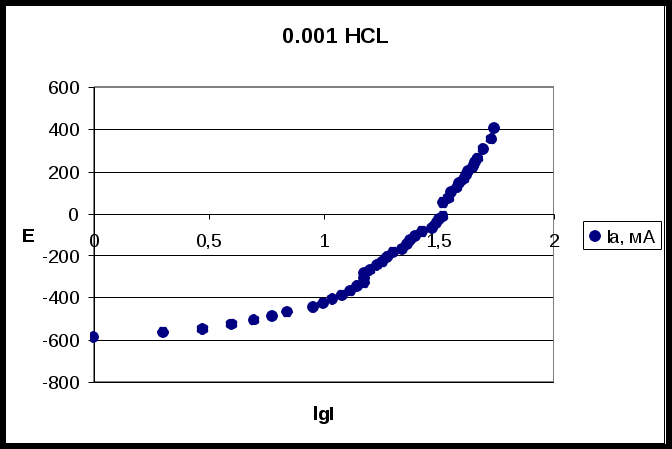 Тангенс угла наклона данной кривой составил: tgα = 670/0,7 = 1285,7. На основе полученного результата можно сделать вывод, что лимитирующей стадией в данном процессе я является перенос заряда и диффузия (из-за большого наклона кривой). Выводы. В проделанной нами работе была получена оксидная пленка щелочным методом. Как показали результаты, данный метод защиты от коррозии является благоприятным. Опыты показали, что полученный нами оксидный слой обладает высокими защитными свойствами. Это подтверждалось тем, что полученная оксидная пленка непористая (отсутствие синих точек на фильтре). Методом защиты от химической коррозии является применение ингибитора (в нашем случае это органический ингибитор). Введение ингибитора в рабочий раствор, с которым контактировал наш образец, замедлило процесс коррозии. В ходе работы также были получены и изучены поляризационные (катодные и анодные) кривые. Были определены скорость коррозии, ток коррозии и лимитирующая стадия. Литература. Томашов Н.Д. Теория коррозии и защиты металлов , Москва, 1959. Томашов Н.Д. и др. Лабораторные работы по коррозии и защите металлов . Кеше Г. Коррозия металлов , Москва, «Металлургия», 1984. Дамаскин Б.Б. Электрохимия , «Химия», «КолосС», 2006 Кинетика химических и электрохимических процессов. Электропроводность . Методическое пособие под науч. ред. Введенского А.В., Воронеж, 2003. 1 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
