Химические свойства свободных альфа -аминокислот. Лабораторная работа №1. Лабораторная работа 1 Химические свойства свободных аминокислот
 Скачать 498.75 Kb. Скачать 498.75 Kb.
|
|
ЛАБОРАТОРНАЯ РАБОТА №1 Химические свойства свободных α-аминокислот Опыт №3.1. Реакции аминокислот в водных растворах Реактивы: водные растворы метионина и серина с массовой долей 1%; Универсальный индикатор фенолфталеин с массовой долей 0,01% В пронумерованные пробирки помещаем по 1 мл фенолфталеина и отмечаем, что реакция в обоих одинаковая. Это указывает на нейтральный характер водных растворов обеих аминокислот. Известно, что серин относится к полярным неионогенным аминокислотам и в условиях нейтральной среды не способен к диссоциации. Метионин относится к неполярным неионогенным аминокислотам и также не способен к диссоциации. В условиях водных растворов в нейтральной среде данные аминокислоты существуют в виде внутренней соли: NH2-СНCH2OH-COOH ↔ NH3+-СНCH2OH-COO- (серин) NH2-СН(CH2)2-S-СН3-COOH ↔ NH3+-СН(CH2)2-S-СН3-COO- (метионин) В кислой среде суммарный заряд аминокислот становится +1: NH2-СНCH2OH-COOH ↔ NH3+-СНCH2OH-COOН (серин) NH2-СН(CH2)2-S-СН3-COOH ↔ NH3+-СН(CH2)2-S-СН3-COOН (метионин) В щелочной основной среде суммарный заряд становится -1: NH2-СНCH2OH-COOH ↔ NH2-СНCH2OH-COO- (серин) NH2-СН(CH2)2-S-СН3-COOH ↔ NH2-СН(CH2)2-S-СН3-COO- (метионин) Опыт №3.2. Реакция α- аминокислот с азотистой кислотой Реактивы: водные растворы метионина и серина с массовой долей 1%; Нитрит натрия, раствор с массовой долей 5%; Азотная кислота концентрированная Берем 3 пробирки, в первую, контрольную, вносим 1 мл воды и 1 каплю азотной кислоты. Во вторую и третью вносим по 1 мл аминокислот и по 1 капле азотной кислоты. Затем в каждую пробирку добавляем 1 мл раствора нитрита натрия и встряхиваем. В первой пробирке наблюдаем одиночные пузырьки окислов азота, возникших при разложении азотистой кислоты. 2NaNO2 + 2HNO3 → 2NaNO3 + NO2 + NO + H2O В двух других отмечаем интенсивное выделение пузырьков газообразного азота. 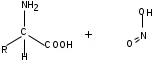 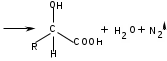 Опыт №3.3. Реакция α- аминокислот с нингидрином Реактивы: растворы метионина и серина с массовой долей 1%; Нингидрин, раствор с массовой долей 0,2%; Для обнаружения и количественного определения аминокислот, находящихся в растворе, используют нингидриновую реакцию. Реакция основана на том, что бесцветный нингидрин, реагируя с аминокислотой, конденсируется в виде димера через атом азота, отщепляемый от α- аминогруппы аминокислоты. В результате образуется пигмент синего или фиолетового цвета. Берем 3 пробирки, в первую, контрольную, вносим 1 мл воды и 3 капли раствора нингидрина. Во вторую и третью вносим по 1 мл аминокислот и по 3 капли раствора нингидрина. Нагреваем все пробирки и отмечаем появление синего и фиолетового окрашивания, что отличает эти пробирки от контрольной. Окрашивание пробирок с метионином и серином не от- 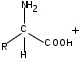 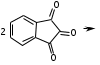 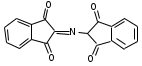 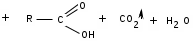 личается. Опыт №3.4. Реакция α-аминокислот с формальдегидом Реактивы: растворы метионина, серина, триптофана с массовой долей 1%; Фенолфталеин, спиртовой раствор с массовой долей 0,1% Гидроксид натрия. Раствор с массовой долей 0,4% Формальдегид, раствор с массовой долей 1,0% Глиоксиловая кислота Аминокислоты реагируют с формальдегидом, образуя метиленовые производные. При этом в случае с серином и метионином взаимодействуют аминогруппа α-аминокислот и карбонильная группа формальдегида. В пробирки вносим по 1 мл раствора α-аминокислот,добавляем по 1 капле раствора фенолфталеина и по каплям гидроксид натрия до слабо-розовой окраски. Затем добавляем по 1 мл формальдегида и встряхиваем пробирки. Наблюдаем обесцвечивание раствора – формальдегид связывает аминогруппу и реакция раствора сдвигается в кислую сторону. 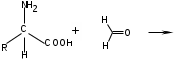 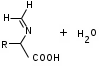 Триптофан, реагируя в кислой среде с альдегидами, образует окрашенные продукты конденсации. Вносим в пробирку 1 мл раствора триптофана и 1 мл глиоксиловой кислоты, являющейся примесью к концентрированной уксусной кислоте. Наблюдаем появление окрашенных продуктов(красно-фиолетовый цвет) 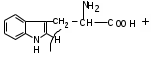 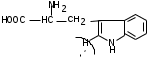 Триптофан 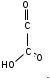 Глиоксиловая кислота  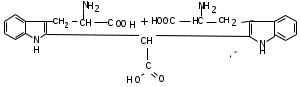 Опыт №3.5. Образование хеллатов α-аминокислот Аминокислоты способны вступать во взаимодействие с ионами некоторых металлов с образованием комплексных соединений =хеллатов. При этом между органическим соединением и металлом возникают 2 типа связи. Аминокислоты, вошедшие в состав хеллатных комплексов, резко меняют свои свойства – не дают реакцию с нингидрином. Также хеллаты являются окрашенными соединениями. Эти свойства мы и изучим в ходе лабораторной работы. 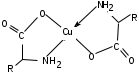 Реактивы: растворы метионина, серина с массовой долей 1%; Сульфат меди, раствор с массовой долей 5,0% Хлорид висмута, раствор с массовой долей 5,0% Сульфат кобальта, раствор с массовой долей 5,0% Хлорид железа(3+), раствор с массовой долей 5,0% Нингидрин, раствор с массовой долей 0,1%; 1.Берем 5 пробирок, в 4 из них вносим по 1 мл раствора серина, в последнюю контрольную вносим 1 мл воды. В первую пробирку вносим 1 мл раствора сульфата меди, во вторую - хлорид висмута, в третью -сульфат кобальта, в четвертую – хлорид железа, и встряхиваем их содержимое. В каждой из пробирок видим различную окраску. Так, в первой она приобретает сине-фиолетовый цвет, во второй - желтоватый, в третьей –темно-оранжевый, в четвертой, где содержится соединение кобальта –коричневый цвет. Цвет жидкости в контрольной, пятой пробирке остается без изменения, бесцветным. 2. Для проверки реакции с нингидрином берем 2 пробирки, в каждую добавляем по 1 мл метионина, такой же алифатической нейтральной кислоты как и серин. В первую добавляем 1 мл сульфата меди, 0,2 мл нингидрина, и встряхнув, нагреваем.В контрольную пробирку вносим 6 капель нингидрина, и также нагреваем после встряхивания. В первой пробирке не наблюдаем цветную реакцию, во второй видим типичную для нингидриной реакции сине-фиолетовую окраску. Опыт №3.6. Ксантопротеиновая реакция на ароматические α-аминокислоты Реактивы: Алифатические аминокислоты(серин, метионин) растворы с массовой долей 1%; Ароматические аминокислоты(триптофан), раствор с массовой долей 1% Азотная кислота концентрированная  Берем 3 пробирки, в первую добавляем 1 мл раствора ароматической α-аминокислоты, во вторую 1 мл воды, в третью 1 мл раствора алифатической кислоты( серин), затем в каждую по 0,5 мл концентрированной азотной кислоты. Нагреваем. Отмечаем наличие желтого окрашивания, характерного для реакции нитрования соединений с бензольным кольцом (пробирка с триптофаном). Опыт №3.7. Разделение смеси аминокислот методом тонкослойной распределительной хроматографии Одним из методов, позволяющих определять аминокислотный состав белков, определять их молекулярную массу является распределительная хроматография на бумаге в тонких слоях(ТСХ). На пластинку из фольги с нанесенным тонким слоем силикагеля или окиси алюминия наносят каплю раствора, содержащего аминокислоты, а затем погружают пластину в смесь органических растворителей. Растворители пропитывают тонкий слой и поднимаются вверх, захватывая аминокислоты. В зависимости от химического строения и молекулярной массы скорость их перемещения будет неодинакова. Кроме того, их можно обнаружить и идентифицировать, обработав пластину нингидрином. Известно, что большинство аминокислот дают с нингидрином сине-фиолетовую реакцию, но пролин образует с нингидрином соединение желтого цвета, триптофан –коричневого, фенилаланин, тирозин и аспартат –синего цвета, глицин и гистидин –красно-серого цвета. 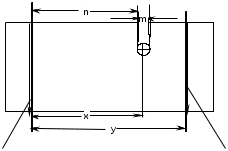 Линия старта Линия фронта Для данной хроматографической системы важной величиной является Rf : Rf = х\у Величина Rf - это характеристика конкретного соединения в условиях данного опыта на данном сорбенте. По этой величине идентифицируются соединения. Так, для растворителя, состоящего из н-бутилового спирта , муравьиной кислоты и воды в соотношении 7:1,5:1,5 эта характеристики следующие: Аланин -0,51, гистидин -0,16, глицин -0,41, метионин -0,69, серин -0,37 Опыт №3.8.1 Реакция Фоля на серосодержащие α-аминокислоты Реакцию на серу дают только аминокислоты, содержащие группу –SH. На первом этапе происходит замещение SH-группы на ОН и переход серы из органического соединения в неорганическое. В нашем случае использование в качестве реагента метионина затруднено из-за отсутствия в его составе группы SH, и так как для подобного замещения в его реакции с гидроксидом натрия требуется сплавление, используем цистеин. Реактивы: цистеин, серин, метионин,растворы с массовой долей 1%; Гидроксид натрия, раствор с массовой долей 1,0% Свинец уксуснокислый, раствор с массовой долей 5,0% Молоко Берем 5 пробирок: в первую пробирку наливаем 3 мл раствора цистеина, во вторую и третью соответственно по 3 мл серина и метионина, в четвертую 3 мл молока, в пятую наливаем воду.Затем в каждую добавляем по 2 мл раствора гидроксида натрия. Содержимое пробирок встряхиваем, кипятим в течение 1 минуты, затем добавляем по 1 мл раствора углекислого свинца. В первой пробирке отмечаем появление коричневого окрашивания, которое указывает на положительную реакцию появления сульфида свинца. На первом этапе это выглядит так CH2− SH CH2− OH | T | CH2 − NH2 + 2 NaOH → CH2 − NH2 + Na2S +H2O | | COOH COOH На втором этапе –качественное обнаружение ионов серы в растворе: Na2S + (CH3COO)2Pb → PbS + 2CH3COONa В других случаях изменения окраски не происходит. Билет №6 1. Кислотно–основное равновесие для цистеина. Значение рН, разделяющее цистеин и метионин. Кислотно–основное равновесие для цистеина можно представить следующим образом: +H+ +OH‾ H3N+ − CH−COOH ↔ H3N+ − CH−COO‾ ↔ H2N − CH−COO‾ | | | CH2 – SH CH2 – SH CH2 – SH Катионная форма биполярный ион Анионная форма Известно, что изоэлектрической точкой считают значение рН, при котором суммарный заряд аминокислоты равен нулю. Изоэлектрической точкой метионина считается величина рН=5,8, аналогичная величина для цистеина равна 5,0. Следовательно, диапазон значений рН от 5,0 до 5,8 является разделительным для данных аминокислот. 2.Абсолютная и относительная конфигурация метионина Как известно, прежде понимания абсолютной конфигурации несложных органических молекул использовалась некая условная, относительная конфигурация молекулы. За основу были взяты проекции Фишера, которые фиксируют визуальную проекцию тетраэдрической конфигурации молекул глицеринового альдегида. Для получения проекционной модели Фишера тетраэдрическую модель энантиомеров располагаем в пространстве так, чтобы карбоксильная группа была сверху, а связи с неуглеродными носителями у хирального центра должны быть направлены к наблюдателю. 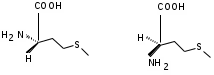 При проецировании цепь атомов углерода занимает вертикальное положение. Чаще всего символ ассиметрического атома(С) опускается, в нашем случае он сохранен. COOH COOH | | NH2 − C − H H − C− NH2 | | CH2 CH2 | | CH2 CH2 | | S S | | CH3 CH3 L-метионин D метионин В период создания указанных выше проекций абсолютная конфигурация не была известна ни для одного хирального соединения. Установление абсолютной конфигурации стало возможным только благодаря развитию физико –химических методов, которые подтвердили , что абсолютная конфигурация d,l α-аминокислот действительно такая, какая им была приписана первоначально. 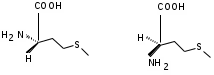 L-метионин D метионин 3.Пути превращения α-аминокислот при дезаминировании на примере аргинина 1. Наиболее простым следует считать вариант дезаминирования путем взаимодействия аргинина с азотистой кислотой. H2N − CH−COOH OH − CH−COOH | | ( CH2)3 ( CH2)3 | | NH + HNO2 → NH +N2 +H2O | | C− NH C− NH | | H2N OH 2.Окислительное дезаминирование α-аминокислот под действием 1,2,3-индатриона –нингидрина- лежит в основе их качественного обнаружения. При этом α-аминокислота претерпевает глубокие превращения. 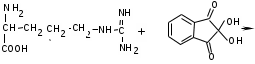 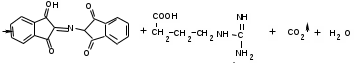 ЛАБОРАТОРНАЯ РАБОТА №2 Физические и химические свойства белков Опыт №4.1. Осаждение белка спиртом Реактивы: Этиловый спирт 96% Хлорид натрия, насыщенный раствор. Белок, раствор с массовой долей 10,0% Смешиваем в пробирке по 1 мл раствора белка и раствора хлорида натрия, затем добавляем 1 мл этилового спирта, встряхиваем и оставляем на 5-10 минут. Наблюдаем постепенное образование осадка белка. Известно, что растворимость белков в воде обусловлена наличием гидратной оболочки их макромолекул. Добавление органического растворителя, в данном случае спирта, вызывает осаждение белка вследствие разрушения этой оболочки. При добавлении воды наблюдаем постепенное растворение осадка по причине уменьшение концентрации спирта. Глубокого изменения структуры белка не произошло, реакция его осаждения обратима. Опыт №4.2. Осаждение белка ацетоном Реактивы: Ацетон Яичный белок, раствор с массовой долей 10,0% Смешиваем в пробирке по 1 мл раствора белка и ацетона, встряхиваем и отмечаем появление помутнения, которое указывает на осаждение белка. При добавлении воды изменения в структуре осадка не наблюдаем. Опыт №4.3. Осаждение белка алкалоидными растворами Реактивы: Пикриновая кислота, насыщенный раствор Танин, насыщенный раствор Железистосинеродистый калий, раствор с массовой долей 5,0% Уксусная кислота, раствор с массовой долей 2,0% Яичный белок, раствор с массовой долей 10,0% Белки также осаждаются при добавлении алкалоидных реактивов -пикриновой кислоты, танина, солей железистосинеродистой кислоты. Эти реакции указывают на наличие в молекуле белка положительно заряженных группировок. Для улучшения осаждения белка обычно добавляют уксусную кислоту. Это увеличивает количество положительных зарядов в белковой молекуле и облегчает взаимодействие белка с алкалоидным реактивом. Берем три пробирки, в каждую из которых вносим по 2 мл белка. Затем в первую пробирку добавляем по 2 мл пикриновой и уксусной кислоты, во вторую 2 мл уксусной кислоты и 2 мл танина, в третью 4 мл уксусной кислоты и 2 мл железистосинеродистого калия. Встряхиваем содержимое всех пробирок. Отмечаем появление осадков в первой пробирке с общим характерным желтым окрашиванием жидкости, во второй с помутнением и слабокоричневой окраской раствора. В третьей пробирке осадок обычен. При добавлении воды структура осадков не меняется. Опыт №4.4. Осаждение белка концентрированными минеральными кислотами Реактивы: Азотная кислота, концентрированная Серная кислота, концентрированная Соляная кислота, концентрированная Яичный белок, раствор с массовой долей 10,0% В три пробирки вносим по 2 мл раствора белка. Затем в первую пробирку добавляем 1 мл азотной кислоты, во вторую 1 мл серной кислоты, в третью - 1 мл соляной кислоты. Встряхиваем содержимое пробирок. Во всех трех наблюдаем образование осадка, который частично растворяется в пробирках с серной и соляной кислот вследствие недостатка объема кислоты, но сохраняется в виде помутнения и не растворяется даже частично в пробирке с азотной кислотой. При добавлении воды структура осадков не меняется. Опыт №4.6. Биуретовая реакция на простые белки Белки реагируют в щелочной среде с сернокислой медью с образованием соединений, окрашенных в фиолетовый (синий) цвет. Подобную окраску дают все соединения, содержащие пептидные связи (-NH-CO-). Реактивы: Гидроксид натрия, раствор с массовой долей 10,0% Сульфат меди, раствор с массовой долей 1,0% Испытуемый белок, водный раствор с массовой долей 10,0% В пробирку наливаем 2 мл раствора испытуемого белка, затем добавляем 1 мл раствора гидроксида натрия и 1 мл раствора сульфата меди. Встряхиваем пробирку. Наблюдаем интенсивное фиолетовое(синее) окрашивание,которое указывает на положительную реакцию. Опыт №4.7. Реакция Паули для белков, содержащих гистидин Реакцию Паули дают только белки, содержащие в своем составе гистидин 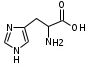 Реактивы: Натрий углекислый,, раствор с массовой долей 10,0% Диазореактив (HCl + NaNO2 + сульфаниловая кислота), Яичный белок, раствор с массовой долей 10,0% Наливаем в пробирку 2 мл раствора белка , затем добавляем 0,5 мл раствора углекислого натрия и 2 мл диазореактива (диазобензолсульфоновая кислота) и встряхиваем. Наблюдаем положительную реакцию – оранжевое окрашивание содержимого пробирки. Опыт №3.8.2. Реакция на серосодержащие α-аминокислоты с нитропруссидом натрия Нитропруссид натрия – Νa2[Fe(CN)5NO] дает с меркаптанами в щелочной среде характерную красную или красно-фиолетовую окраску вследствие образования комплексных соединений следующего типа: Νa2[Fe(CN)5NO] + 2HS-R + 2NH3 → Na2(NH4)2[Fe(CN)5NO(S-R)2] Цистеин дает положительную реакцию в разбавленном растворе аммиака, а метионин - отрицательную. Аммиак, а не щелочь, как обычно, используется для того, чтобы исключить возможность образования меркаптанов из цистина и метионина. Меркаптаны дают положительную реакцию с нитропруссидом натрия, образуя с ним комплексные соединения. Реактивы: Цистеин, раствор с массовой долей 1,0% Метионин, раствор с массовой долей 1,0% Аммиак, раствор с массовой долей 10,0% Нитропруссид натрия, раствор с массовой долей 1,0% Берем 3 пробирки. В первую наливаем 3 мл раствора цистеина, во вторую пробирку наливаем 3 мл раствора метионина, в третью наливаем воду. В каждую пробирку добавляем по 2 мл раствора аммиака( среда щелочная, (рН˃9).Содержимое пробирок встряхиваем и нагреваем в течение 1 минуты, затем добавляем 1 мл раствора нитропруссида натрия. Появление характерной красно-фиолетовой окраски, указывающей на положительную реакцию, наблюдаем в первой пробирке. Во второй и третьей пробирках окраска не меняется, во второй реакция отрицательная. ЛАБОРАТОРНАЯ РАБОТА №3 Качественные реакции моноуглеводов. Опыт №2.3.1. Восстанавливающие свойства моноуглеводов. Реакция моноз с реактивом Троммера. Многие углеводы обладают способностью в щелочной среде восстанавливать ионы меди, висмута серебра, других металлов.Эта реакция обусловлена наличием в молекуле моносахаридов альдегидной группы, которая, легко окисляясь, превращается в карбоксильную, при этом происходит восстановление металлов. На этом основан метод обнаружения моносахаридов по Троммеру. Для проведения реакции исследуемую жидкость нагревают с растворами едкого натра и сульфата меди. Образующийся гидрат окиси меди в присутствии альдегидной группы восстанавливается с образованием гидрата закиси меди(СuОН, желтого цвета) или закиси меди(Сu2О), красного цвета), а исследуемая жидкость приобретает соответственно желтое, оранжевое или красное окрашивание. CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4 Реакцию Троммера нельзя проводить в присутствии избытка солей меди, так как в этом случае желтая или красная окраска маскируется черным осадком окиси меди, образующимся из гидроксида меди. Для предотвращения этого реакцию проводят в присутствии сегнетовой соли, связывающей избыток гидроксида меди. 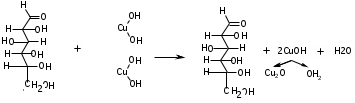 Реактивы: Сульфат меди, раствор с массовой долей 1,0% Гидроксид натрия, раствор с массовой долей 10,0% Глюкоза, раствор с массовой долей 1,0% Фруктоза, раствор с массовой долей 1,0% Сахароза, раствор с массовой долей 1,0% Берем три пронумерованные пробирки, в первую добавляем 2 мл раствора глюкозы, во вторую 2 мл раствора фруктозы, в последнюю -2 мл раствора сахарозы. В каждую затем вносим по 1 мл раствора гидроксида натрия и по 0,5 мл раствора сульфата меди. Пробирки встряхиваем и нагреваем. Отмечаем появление желтого окрашивания в первой и второй пробирке, которое при дальнейшем нагревании переходит в красное, третья пробирка характерного окрашивания не дает. Опыт №2.3.3. Реакция моноз с реактивом Селиванова Для обнаружения фруктозы в растворе используют реактив Селиванова, представляющий собой раствор резорцина в соляной кислоте. Реактивы: Глюкоза, раствор с массовой долей 1,0% Фруктоза, раствор с массовой долей 1,0% Реактив Селиванова Берем три пронумерованные пробирки, в первую добавляем 2 мл раствора глюкозы, во вторую – 2 мл раствора фруктозы, в третью -2 мл раствора сахарозы. В каждую из них вносим по 2 мл реактива Селиванова. Содержимое пробирок встряхиваем, нагреваем до кипения. Отмечаем вишнево-красное окрашивание во второй пробирке с фруктозой. Опыт №2.3.4. Реакция на обнаружение углеводов Для обнаружения в исследуемой пробе углеводов используем их способность образовывать с концентрированной серной кислотой фурфурол, который дает фиолетовое окрашивание с α-нафтолом и красное с тимолом. Реактивы: Углевод, раствор с массовой долей 1,0% Тимол, раствор с массовой долей 0,01% α-нафтол, раствор с массовой долей 1,0% Серная кислота концентрированная В две пробирки вносим по 1 мл исследуемого раствора углевода, в первую добавляем 0,2 мл раствора α-нафтола, во вторую -0,2 мл раствора тимола. Затем в каждую пробирку осторожно, по стенке, прибавляем 1 мл серной кислоты. которая образует на дне нижний слой. Отмечаем в первой пробирке образование фиолетовое окрашенное кольцо на границе раздела фаз, во второй пробирке аналогично кольцо красного цвета. Опыт №2.3.5. Гидролиз сахарозы Реактивы: Сульфат меди, раствор с массовой долей 1,0% Гидроксид натрия, раствор с массовой долей 10,0% Сахароза, раствор с массовой долей 1,0% Серная кислота концентрированная В пробирку вносим 2 мл раствора сахарозы, и 0,5 мл серной кислоты. Встряхнув, пробирку нагреваем до кипения, кипятим 1-2 минуты. После этого охлаждаем и добавляем 2 мл раствора гидроксида натрия и 1 мл сульфата меди. Снова доводим содержимое пробирки до кипения, отмечаем изменения окраски. Опыт №2.3.6. Гидролиз крахмала. Обнаружение декстринов и конечных продуктов гидролиза При гидролизе крахмал распадается, давая последовательно декстрины, мальтозу, и глюкозу. В начале гидролиза образуются амилодекстрины, дающие синее окрашивание с йодом; затем эритродекстрины, дающие с йодом красно-бурое окрашивание. Ахродекстрины йодом не окрашиваются. Продуктом гидролиза последних является мальтоза, которая в дальнейшем распадается на 2 молекулы глюкозы. Реактивы: Крахмал, раствор с массовой долей 0,1% Раствор Люголя Реактив Фелинга Гидроксид натрия, раствор с массовой долей 10,0% Серная кислота, раствор с массовой долей 10,0% В пробирку вносим 5 мл раствора крахмала, 10 мл воды и 5 мл серной кислоты. После встряхивания отбираем 2 капли полученного раствора, в которые добавляем одну каплю раствора Люголя. Отмечаем появление синего окрашивания, характерного для крахмала. В пробирку с основным раствором помещаем в водяную баню для гидролиза. Через каждую минуту из этой пробирки отбираем по 2 капли раствора, перенося его в отдельную пробирку, как в первом случае, и в которую сразу же добавляем по одной капле раствора Люголя, по окрашиванию раствора определяем степень гидролиза крахмала. Пробы берем до момента отсутствия окрашивания, сравнивая окраску продуктов гидролиза с исходным раствором Люголя. После этого в оставшемся гидролизате открываем глюкозу – подщелачиваем остаток равным объемом раствора гидроксида натрия, добавляем раствор Фелинга и нагреваем. Появляется желтое, позже красное окрашивание,указывающее на наличие в гидролизате продуктов, обладающих восстановительными свойствами. Опыт №2.3.7. Цветные реакции на лигнин Лигнин входит в состав древесииы наряду с целлюлозой и гемицеллюлозой. Он не гидролизуется при лействии минеральных кислот и представляет собой сложное органическое ароматическое соединение. Реактивы и оборудование: Флюроглицин, раствор с массовой долей 0,1% Анилин Фильтровальная бумага Фильтровальная бумага Деревянная дощечка Соляная кислота, концентрированная Приготавливаем раствор солянокислого анилина, смешивая 1 мл анилина , 1 мл соляной кислоты и 4 мл воды. Приготавливаем также раствор. Смешивая 1 мл раствора флюроглицина и 0,1 мл соляной кислоты. Приготовленные растворы наносим на деревянную дощечку и полоски фильтровальной и газетной бумаги. На чистой фильтровальной бумаге оба эти раствора окрашивания не дают. На дощечке и на газетной бумаге раствор солянокислого анилина оставляет ярко-желтое пятно, флюроглицин – сначале бесцветное, затем красное пятно. Билет №15 1.Дисахариды, структура, свойства, классификация. Это сложные сахара, каждая молекула которых при гидролизе распадается на 2 молекулы моноуглеводов. По своему строению они являются гликозидами, в которых 2 молекулы моносахаридов соединены гликозидной связью. Это определяет их классификацию и свойства. Если один полуацетальный гидроксил остается свободным, дисахариды проявляют альдегидные свойства, такие дисахариды относят к восстанавливающим. Если же связь между двумя остатками моносахаридов осуществляется посредством обоих полуацетальных гидроксилов,то для таких дисахаридов альдегидные свойства не характерны и они называются невосстанавливающими. Такие дисахариды еще называют трегалозами. К первым относят мальтозу, лактозу, целлобиозу, ко вторым сахарозу. Лактоза 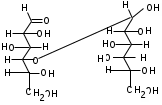 Мальтоза 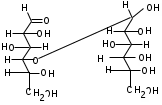 Сахароза 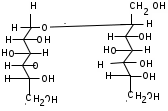 2.L -фруктоза→метил ß - L-глюкозид и полное метилирование Как известно, L –фруктоза в природе не встречается. Ее получают синтетическим путем. Указанную реакцию покажем на примере ß - L-фруктофуранозы как одного из распространенных таутомеров фруктозы. Первым продуктом реакции поучится 2-метил ß - L-глюкозид или 2-метил ß - L-фруктофуранозид. 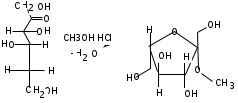 Дальнейшее метилирование приведет к смеси продуктов, конечным из которых вероятно станет 2,3,4,6-метил ß -L-фруктофуранозид. 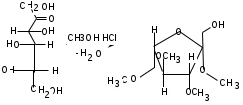 При полном метилировании как у альдоз, так и у кетоз (к ним относится и L –фруктоза), метилируются все гидроксильные группы, за исключением 1 и 5 атома углерода. 3.Химические свойства углеводов как спиртов. Какие производные имеют наибольшее значение. Углеводы, содержащие в молекуле одновременно альдегидную или кетонную группу и несколько гидроксильных спиртовых групп, можно рассматривать как многоатомные альдегидоспирты или кетоноспирты. Вследствие этого они обладают свойствами спиртов. Если опустить наиболее свойственное для сахаров окисление альдегидных групп, то схожее со спиртами окисление в гидроксогруппах является основанием для получения из сахаридов ряда веществ. Например, участие гидроксильных групп в образование водородных связей определяет способность целлюлозы взаимподейстыоыать со щелочами с образованием солей. Например, нптриевая соль карбоксиметилцеллюлозы используется в фармацевтике. К сложным эфирам целлюлозы относится ксантогенат, образующийся из натриевого производного целлюлозы и сероуглерода. Его вязкий раствор, называемый вискозой, используется для получения искусственного волокна и целлофана. При окислении моносахаридов могут быть получены 3 вида кислот. Рассмотрим 2 вида, когда окислению подвергается концевая гидроксильная группа. Дикарбоновая кислота на основе глюкозы называется глюкаровой, которая используется в фармацевтике, и образуется взаимподействием глюкозы с разбавленной азотной кислотой. 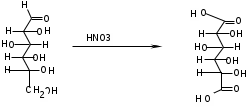 Глюкоза при превращении ее последней группы ОН в 6 положении превращается в кислоту, которая называется глюкуроновой, или глюкуронатом, который отвечает в организме за нейтрализацию билирубина. Для получения глюкуроновой кислоты, использующейся в создании также многих биополимеров, окислению подвергают моносахариды с защищенной альдегидной группой в виде гликозида. 4. Необходимо определить соединение по неполному уравнению химической реакции 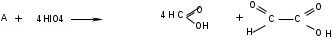 Из практики известно, что взаимодействие некоторых аминокислот с иодистой кислотой позволяет получить глиоксиловую кислоту и муравьиный альдегид или муравьиную кислоту. Этими аминокислотами являются серин или треонин. Анализ возможных продуктов реакции говорит о том, что вероятной аминокислотой для данных продуктов реакции является серин. 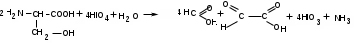 5. Кето - енольная таутомерия кетопентозы. Как известно, по положению карбонильной группы углеводы делятся на альдозы и кетозы. Пятиуглеродные кетопентозы, как и другие монозы, могут испытывать изомерные превращения, в том числе в виде кето - ендиольной таутомерии. Рассмотрим данную изомеризацию на примере такой кетопентозы, как D-рибулоза. 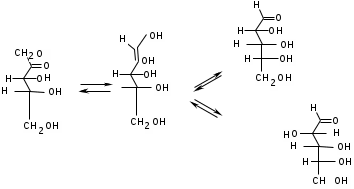 D-рибулоза Ендиольная форма D-рибоза D-арабиноза В результате данного вида изомеризации мы, очевидно, при комнатной температуре и щелочной среде можем получить из одного моносахарида равновесную смесь моносахаридов, различающихся конфигурациями атомов С-1 и С-2. ЛАБОРАТОРНАЯ РАБОТА №4 Изучение химического состава рибонуклепротеинов дрожжей. Спиртовое брожение. Опыт №5.1-5.2. Биуретовая реакция на белок Реактивы: Дрожжи Серная кислота, раствор с массовой долей 10% Гидроксид натрия, раствор с массовой долей 10% Сульфат меди, раствор с массовой долей 1% 200 мг дрожжей помещаем в широкую пробирку и добавляем 5 мл раствора серной кислоты и 5 мл дистиллированной воды. Перемешиваем и закрываем пробкой с обратным воздушным холодильником. Помещаем пробирку в кипящую водяную баню и кипятим при слабом нагревании 1 час. После этого содержимое пробирки охлаждаем, фильтруем, и используем фильтрат (гидролизат) для опытов для изучения составных частей нуклеотидов. К 1-2 мл гидролизата прибавляем раствор гидроксида натрия до щелочной реакции на лакмус и 1-2 мл раствора сульфата меди. Отмечаем розово –фиолетовое окрашивание, свидетельствующее о наличии в жидкости белка. Опыт №5.3. Серебряная проба на пуриновые основания Реактивы: Гидролизат дрожжей Аммиак, раствор с массовой долей 10% Азотнокислое серебро, раствор с массовой долей 5% К 1 мл гидролизата добавляем аммиак до щелочной реакции на лакмус и 0,5 мл аммиачного раствора оксида серебра. При стоянии содержимого отмечаем выпадение хлопьевидного осадка серебряных соединений пуриновых оснований. Опыт №5.4. Реакция на пентозы Реактивы: Гидролизат дрожжей Гидроксид натрия, раствор с массовой долей 10% Сульфат меди, раствор с массовой долей 1% К 1мл гидролизата добавляем раствор гидроксида натрия до щелочной реакции на лакмус, затем по каплям раствор сульфата меди до образования гидрата окиси меди, не допуская избытка. Нагреваем до кипения. Отмечаем слабое красное окрашивание появившейся в содержимом закиси меди, которое характеризует незначительное присутствие пентоз. Опыт №5.5. Молибденовая проба на фосфорную кислоту Реактивы: Гидролизат дрожжей Молибденовый реактив, раствор с массовой долей 5% К 1 мл гидролизата прибавляем равный объем молибденового реактива. Жидкость окрашивается в лимонно-желтый цвет. При охлаждении наблюдаем желтый осадок фосфорно- молибдено- кислого аммония. Опыт №6.3.4.1. Спиртовое брожение Для изучения процесса спиртового брожения готовим суспензию дрожжей. Вносим в колбу 10 г сазарозы,2 г пекарских дрожжей и 50 мл воды. Закрываем колбу ватно-марлевой пробкой, взвешиваем( m0 =70 г) и выдерживаем 1 час в термостате при температуре 30º С. Ставим в теплое и темное место на несколько дней. Надо помнить, что для расчета выхода этилового спирта колбу по окончании процесса брожения необходимо взвесить(m1). Количество молей этилового спирта соответствует количеству молей выделившегося углекислого газа. mэт=(m0-m1)/MмCO2∙Mмэт , где mэт – масса этанола, г MмCO2 – молярная масса углекислого газа; Mмэт -молярная масса этанола. Выход этанола в процентах в расчете на сахарозу: Х(%) =10/ mэт∙ 100. ЛАБОРАТОРНАЯ РАБОТА №5 Витамины Опыт №4.2. Реакция с диазореактивом на тиамин( витамин В1) В основе реакции лежит способность витамина В1 в щелочной среде с диазореактивом ( смесь солянокислого или сернокислого раствора сульфаниловой кислоты с раствором нитрита натрия) образовывать сложное комплексное соединение оранжевого или красного цвета. 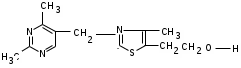 Реактивы: Сульфаниловая кислота, раствор с массовой долей 10% Гидроксид натрия, раствор с массовой долей 10% Нитрит натрия, раствор с массовой долей 10% Бикарбонат натрия, раствор с массовой долей 20% Тиамин, раствор с массовой долей 20% Приливаем в пробирку 1 мл раствора сульфаниловой кислоты и 1 мл раствора нитрита натрия. Образуется диазореактив. Сюда же вносим 0,5 мл раствора тиамина и по стенке пробирки осторожно добавляем 1 мл раствора бикарбоната натрия. Заметно, что на границе двух жидкостей появляется образование оранжевого цвета. 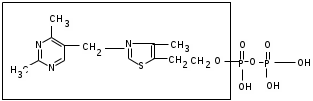 Опыт №4.11. Обнаружение витамина А Витамин А(ретинол) относится к классу жирорастворимых витаминов. В природе многие растения, окрашенные в красный цвет, содержат провитамины А –каротины. Провитамины А –каротины, витамин А экстрагируют из растительного сырья хлороформом. К экстракту добавляют серную кислоту, и возникает характерное для каратиноидов и витамина А синее окрашивание. 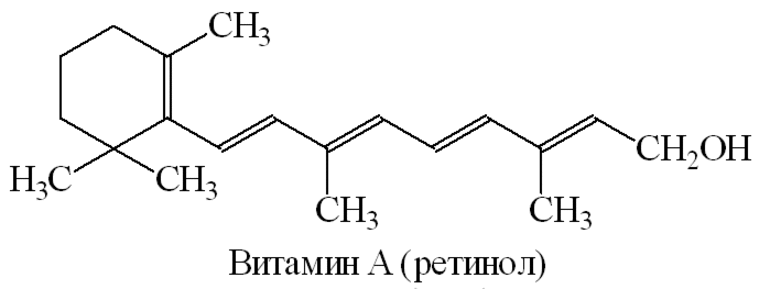 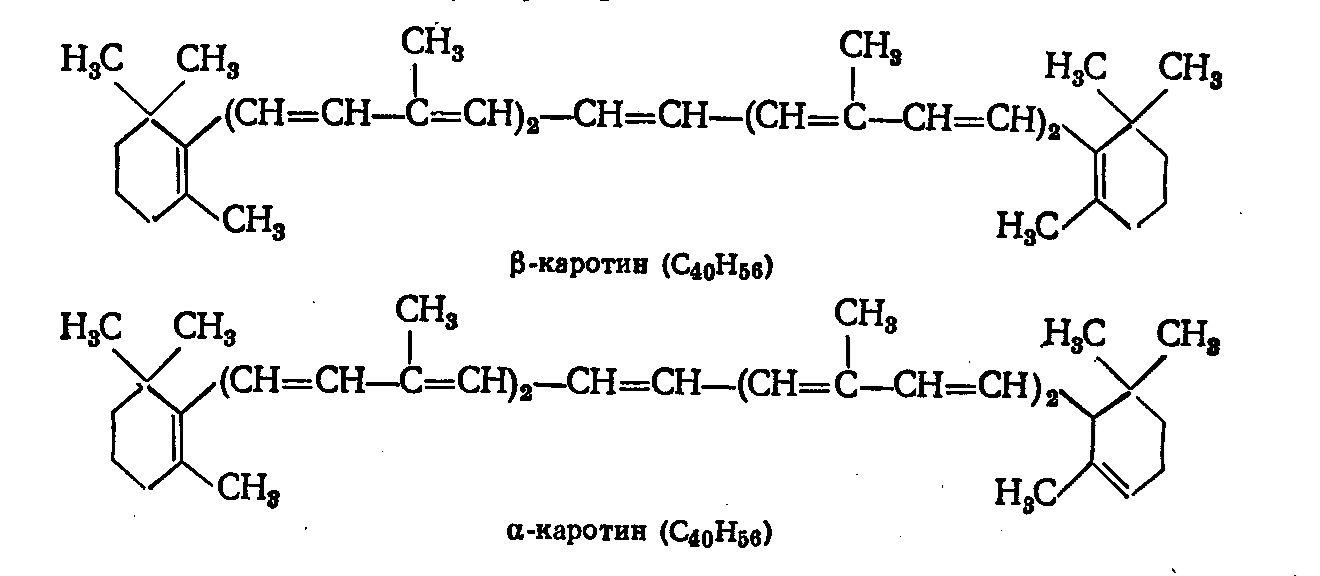 Реактивы и материалы: Хлороформ Серная кислота концентрированная Морковь Витамин А, драже Помещаем в пробирку натертую морковь и добавляем 2-5 мл хлороформа. Сильно встряхиваем содержимое до тех пор не окрасится в оранжевый цвет. Несколько капель этого экстракта вносим в другую пробирку, куда добавляем каплю серной кислоты. Наблюдаем синее окрашивание экстракта. Берем 1 драже витамина А и измельчаем его в ступке. Заливаем полученный порошок водой, тщательно перемешиваем и фильтруем от нерастворившихся примесей. 1 мл полученного фильтрата вносим в пробирку, добавляем равное количество хлороформа и столько же серной кислоты. Отмечаем появление синего окрашивания, постепенно переходящего в темно-красное и коричневое. Опыт №4.12. Обнаружение витамина D В этой группе существует несколько веществ, обладающих похожими свойствами. Среди них наиболее распространены витамины D2 и D3. Многие продукты содержат не готовые витамины D, а провитамины, которые превращаются в витамины при облучении ультрафиолетовыми лучами. Так, провитамином D2 является эргостерол, а провитамином D3 -7-дегидрохолестерол. Они дают характерную с ангидридом уксусной кислоты и серной кислотой реакцию –синее и зеленое окрашивание. 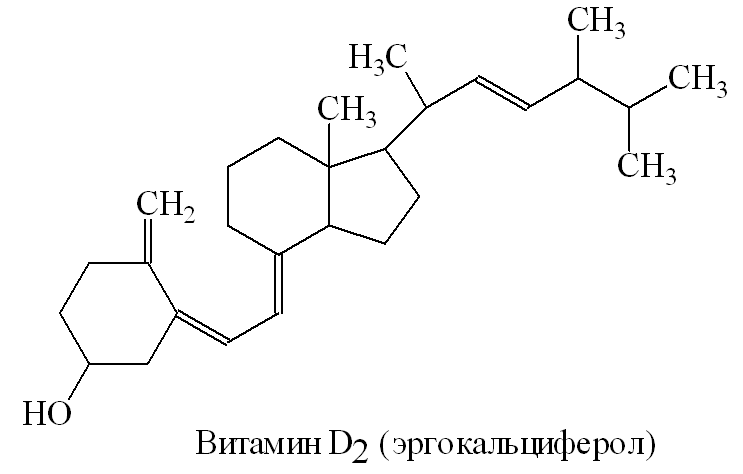 Реактивы: Витамин D, масляный раствор Ангидрид уксусной кислоты Серная кислота концентрированная 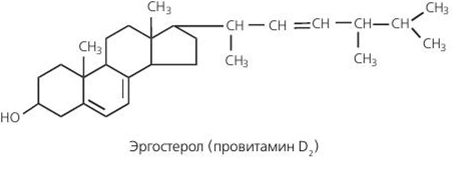 Вносим в пробирку по 0,5 мл раствора витамина D в масле, уксусного ангидрида и серной кислоты. Перемешав содержимое пробирки, наблюдаем появление зеленой окраски. 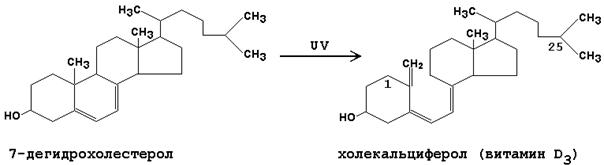  |
