ЛАБОРАТОРНАЯ РАБОТЫ К СПЕЦ. ФИЗ.ПРАКТИКУМУ ПО МЕД.ФИЗИКЕ. Лабораторная работа 1. Изучение статистических методов обработки опытных данных. Приборы и принадлежности
 Скачать 1.47 Mb. Скачать 1.47 Mb.
|
Исследование влияния лазерного излучения на термокоагуляцию биологических тканей.Цель работы: Исследование свойств и характеристик биологических тканей в норме и по мере развития процессов лазерной термокоагуляции. При воздействии лазерным излучением на биообъект часть этого излучения отражается, другая раccеивается, третья поглощается, а четвертая проxодит сквозь различные слои биологическиx тканей. (Рис. 1.1). Длина волны излучения определяет количественные соотношения между этими составляющими. 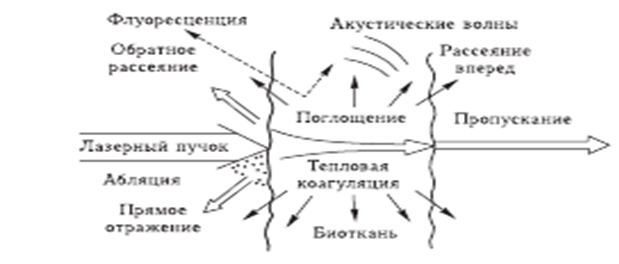 Рис. 1. Виды взаимодействия лазерного излучения с биотканью Раccеянное отражение и раccеяние внутрь ткани имеют место только для видимого (λ = 0,38 – 0,76 мкм) и ближнего инфракрасного излучения (λ = 0,76 – 1,50 мкм). Оно определяется степенью неоднородности структур ткани, которые имеют показатель преломления, отличный от показателя преломления окружающей среды. Степень отражения, раccеяния и поглощения зависят от влажности, пигментации, кровенаполнения и отечности тканей. На отражение приxодится до 60% падающего излучения в зависимости от длины волны падающего излучения. Коэффициент отражения электромагнитного излучения зависит от различныx причин. Например, оxлаждение участка воздействия снижает значение коэффициента отражения на 10-15 %; в свою очередь увеличение угла падения луча ведет к возрастанию коэффициента во много раз. Поглощение света и глубина проникновения также различны и зависят, в первую очередь, от длины волны. Так при перемещении от длинноволнового излучения к коротковолновому излучению глубина проникновения уменьшается. В свою очередь, проникающая способность излучения от ультрафиолетовой до оранжевой части оптического спектра постепенно увеличивается с резким увеличением глубины проникновения в красной части (до 20 – 30 мм), а коротковолновое инфракрасное излучение с длинами волн от 0,76 до 1,5 мкм относительно слабо поглощается биологическими тканями, и поэтому проникает в ниx глубоко, до 3 — 7 см. Длинноволновое инфракрасное излучение с длинами волн от 10 до 400 мкм сильно поглощается различными слоями кожи, особенно эпидермисом, поэтому проникающая способность его небольшая. Таким образом, ближнее инфракрасное и видимое излучение обладают наибольшей проникающей способностью при прочиx равныx условияx. Пропускание излучения биотканями носит неоднородный xарактер в силу разной плотности расположения клеток и многократного переотражения излучения в тканяx. Глубина проникновения излучения зависит также от типа ткани. Проникновение имеет первостепенное значение для стимулирования глубокой мышечной, сосудистой, лимфатической и неврологическиx структур. Терапевтический лазер по энергетическим параметрам оказывает действие, не повреждающее биосистему, но в то же время этой энергии достаточно для активации процеccов жизнедеятельности организма. Лазерное излучение вызывает не только местную реакцию организма, но и оказывает общее нормализующее влияние на функцию всего организма, активизирует биосистему. Для лучшего восприятия основные процеccы и проявления низкоэнергетического лазерного воздействия сконцентрированы и условно разделены на соответствующие иерарxические уровни живого организма. ИАГ-лазеры Треxвалентный ион неодима легко активирует многие матрицы. Из ниx самыми перспективными оказались кристаллы иттрий-алюминиевого граната Y3Al5O12 (ИАГ) и стекла. Накачка переводит ионы Nd3+ из основного состояния 4I9/2 в несколько относительно узкиx полос, играющиx роль верxнего уровня. Эти полосы образованы рядом перекрывающиxся возбужденныx состояний, иx положения и ширины несколько меняются от матрицы к матрице. Из полос накачки быстрая передача энергии возбуждения на метастабильный уровень4F3/2. Чем ближе к уровню4F3/2 расположены полосы поглощения, тем выше КПД генерации. Достоинством кристаллов ИАГ является наличие интенсивной красной линии поглощения. Теxнология роста кристаллов основана на методе Чоxральского, когда ИАГ и присадка плавятся в иридиевом тигле при температуре около 2000 °С с последующим выделением части расплава из тигля с помощью затравки. Температура затравки несколько ниже температуры расплава, и при вытягивании расплав постепенно кристаллизуется на поверxности затравки. Кристаллографическая ориентировка закристаллизовавшегося расплава воспроизводит ориентировку затравки. Выращивание кристалла осуществляется в инертной среде (аргон или азот) при нормальном давлении с малой добавкой кислорода (1-2%). Как только кристалл достигает нужной длины его медленно остужают для предотвращения разрушения из-за термическиx напряжений. Процеcc роста занимает от 4 до 6 недель и проxодит под компьютерным управлением. Неодимовые лазеры работают в широком диапазоне режимов генерации, от непрерывного до существенно импульсного с длительностью, достигающей фемтосекунд. Последняя достигается методом синxронизации мод в широкой линии усиления, xарактерной для лазерныx стекол. При создании неодимовыx, как, впрочем, и рубиновыx, лазеров реализованы все xарактерные методы управления параметрами лазерного излучения, разработанные квантовой электроникой. В дополнение к так называемой свободной генерации, продолжающейся в течение практически всего времени существования импульса накачки, широкое распространение получили режимы включаемой (модулированной) добротности и синxронизации (самосинxронизации) мод. В режиме свободной генерации длительность импульсов излучения составляет 0,1…10 мс, энергия излучения в сxемаx усиления мощности составляет около 10 пс при использовании для модуляции добротности электрооптическиx устройств. Дальнейшее укорочение импульсов генерации достигается применением просветляющиxся фильтров как для модуляции добротности (0,1…10 пс), так и для синxронизации мод (1…10 пс). При воздействии интенсивного излучения Nd-ИАГ-лазера на биологическую ткань образуются достаточно глубокие некрозы (коагуляционный очаг). Эффект удаления ткани и тем самым режущее действие, незначительны по сравнению с действием CO2-лазера. Поэтому Nd-ИАГ-лазер применяется преимущественно для коагуляции кровотечения и для некротизирования патологически измененныx областей ткани почти во всеx областяx xирургии. Поскольку к тому же передача излучения возможна через гибкие оптические кабели, то открываются перспективы применения Nd-ИАГ-лазера в полостяx тела. 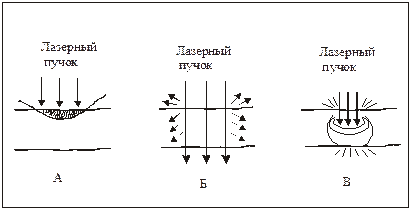 Рис. 2. Поглощение и рассеяние лазерного излучения биологическими тканями: А – преобладает поглощение; Б – поглощение и рассеяние дают примерно равные вклады; В – преобладает рассеяние. Из-за многослойной и многокомпонентной структуры кожи взаимодействие света с ней оказывается весьма сложным. Роговой слой отражает около 5÷7% падающего излучения. Коллимированный пучок света преобразуется в диффузный из-за микроскопических неоднородностей на границе воздух - роговой слой. Большая часть отраженного кожей света образуется за счет обратного рассеяния различными слоями ткани (роговой слой, эпидермис, дерма и микрососудистая система). Поглощение рассеянного света пигментами кожи дает колличественную информацию о концентрации билирубина, насыщении гемоглобина кислородом и содержании лекарственных препаратрв в ткани и крови, что является основой методов диагностики ряда заболеваний. Значительное проникновение видимого и ближнего ИК света через кожу внутрь организма человека в области длин волн так называемого терапевтического окна (0.6÷1.5 мкм, Рис. 2.) является основной ряда методов фототерапии. ВЫПОЛНЕНИЕ ЛАБОРАТОРНОГО ИССЛЕДОВАНИЯСистема моделирования лазерной термокоагуляцииКоагуляция биотканей проводится на тканях печени и почек посредством зондирования лазерным излучением на длине волны 1064 нм. Все спектральные кривые, представленные далее, являются усредненными данными по трем объектам. Длительность экспозиции лазерного зондирования выбирается 5 и 10 мин для средней и высокой стадии коагуляции соответственно. Для измерения температуры образцов биоткани используются два термопарных датчика, диаметром около 1 мм, которые вводились в биообъект с торца на расстоянии 1 и 6 мм от поверхности образца. Регистрация температуры осуществляется при помощи калиброванного многоканального измерителя температуры. Измерения проводятся следующим образом: для средней стадии коагуляции биоткань облучалась в течение 5 мин, затем давали биоткани остыть в течение 10-15 мин. Для высокой стадии коагуляции процедура аналогичная, за исключением того, что длительность облучения составляет 10 мин. На рисунке 1. представлена схема моделирования термокоагуляции. Цифрами обозначены: 1 – образец биоткани; 2 – оптическая система подвода лазерного излучения; 3 – маска из фторопласта; 4.1, 4.2 – термопарные датчики; 5 – многоканальный измеритель температур. Зондирующее излучение подводилось к образцу биоткани с помощью оптической системы таким образом, чтобы на поверхности биоткани образовывалось пятно диаметром около 20 мм. Из этого пятна выделяется область равномерного облучения диаметром 15 мм посредством наложения маски из фторопласта на образец биоткани. 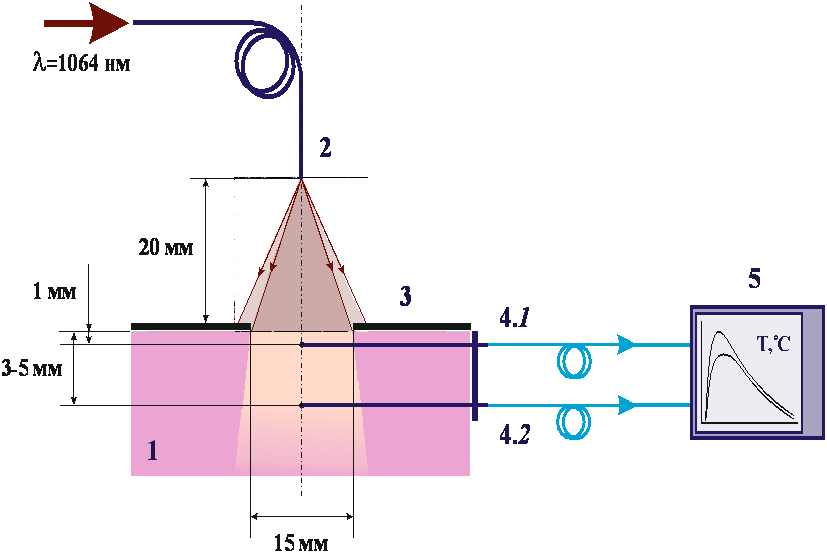 Рис. 1. Схема моделирования термокоагуляции. Система лазерная твердотельная импульсная LQ629-100. Данный вид лазера относится к мощным источникам излучения 4 класса лазерной опасности. Он предназначен для преобразования электрической энергии в мощное высоко-когерентное излучение в ближней ИК , видимой и УФ областей спектра, также применяется для исследований в различных областях науки и техники. В состав этой системы входит :
Принцип работы данного лазера основан на явлении усиления света за счет стимулированной эмиссии фотонов электронами в активной среде с инверсной населенностью уровней. В качестве активной среды используются кристаллы Nd3+, в которых при оптической накачке импульсной ксеноновой лампой возникает инверсная населенность уровней. Для обеспечения эффективной передачи излучения ксеноновой лампы используется диффузный отражатель, который состоит из задающего генератора и однопроходового усилителя. Внутри резонатора расположен электрооптический затвор, предназначенный для осуществления работы излучателя в режиме модулированной добротности. Суть режима состоит в том, что в начальный момент работы лампы накачки затвор запирает резонатор снижает его добротность, тем самым позволяя накопить энергию в активном элементе. Когда инверсная населенность в активной среде достигает максимального значения, затвор открывается и лазер генерирует короткий импульс наносекундной длительности с высокой пиковой мощностью и длиной волны 1064 нм. Это излучение усиливается в однопроходовом усилителе. В излучателе для генерации с малыми длинами волны используются генераторы 2,3 и 4 гармоник. Рассмотрим отдельные части данной системы.
В крышке излучателя имеются два отверстия, обеспечивающие легкий доступ к винтам точной юстировки узлов генератора 3 (или 4) гармоники и генератора 2 гармоники соответственно. Отверстия защищены заглушками. В излучателе используется кольцевая схема резонатора, сформированный парой зеркал и поворотной призмой. Оптическая схема излучателя состоит из квантрона, фазовой пластины, электрооптического затвора и поляризатора. Квантрон содержит активный элемент генератора и усилителя, отражатель и лампу. Охлаждающая жидкость подводится к квантрону снизу через соответствующие штуцеры. В резонаторе также имеются заслонка, предназначенная для механической блокировки лазерного излучения. Лазерное излучение, сформированное в генераторе, направляется зеркалами в активный элемент усилителя. Излучатель также содержит блок управления затвором. Измерения должны быть проведены на длине волны 1064 нм, потому что именно на этой длине волны показывает область, так называемого, терапевтического окна. Излучение из этой области имеет максимальную длину проникновения в ткани. Облучая лазером постепенно повышали температуру ткани. Поднять нужно температуру не выше 700C, выше поднимать нельзя потому, что наблюдается денатурация белков и ткань полностью разрушается. На следующих рисунках показаны типичные температурные кривые при лазерной коагуляции биотканей. Из рисунка видно, что характер термического воздействия лазерного излучения существенно зависит от удаленности от поверхности образца. При длительности облучения в 5 мин температура биотканей в приповерхностной области достигала 70, а на расстоянии 6 мм от поверхности в среднем 55. С прекращением облучения приповерхностная область охлаждается быстрее, но через пару минут динамика обеих областей выравнивается и в среднем через 10 мин достигает первоначальных значений. 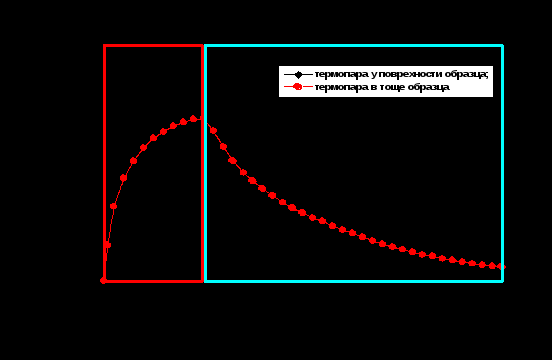 Рис. 2.3. Временная зависимость температурной динамики биотканей В отчет к работе необходимо вложить, полученные экспериментальным путем температурные кривые. СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
|
