лабораторная работа. Лабораторная работа № 1.. Лабораторная работа 1 Кинетика химических реакций
 Скачать 19.66 Kb. Скачать 19.66 Kb.
|
|
Лабораторная работа №1 Кинетика химических реакций Цель работы: изучение скорости химической реакции и ее зависимости от различных факторов: природы реагирующих веществ, температуры, концентрации. Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений. Предметом химической кинетики является изучение всех факторов, влияющих на скорость как суммарного процесса, так и всех промежуточных стадий. Основные понятия химической кинетики: Гомогенная реакция — реакция, в которой реагирующие вещества находятся в одной фазе. Гетерогенная реакция — реакция, происходящая на границах раздела фаз – между газообразным веществом и раствором, между раствором и твёрдым веществом, между твёрдым и газообразным веществами. Реакция называется простой, если продукт образуется в результате непосредственного взаимодействия молекул (частиц) реагентов. Реакция называется сложной, если конечный продукт получается в результате осуществления двух и более простых реакций (элементарных актов) с образованием промежуточных продуктов. Важным понятием химической кинетики является скорость химической реакции. Эта величина определяет, как изменяется концентрация компонентов реакции с течением времени. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножается на −1. Например, для реакции скорость можно выразить так: 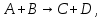 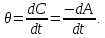 (1) (1)В 1865 году Н. Н. Бекетовым и в 1867 году К. М. Гульдбергом и П. Вааге был сформулирован закон действующих масс, согласно которому скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведённым в некоторые степени. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы: природа реагирующих веществ, наличие катализатора, температура (правило Вант-Гоффа) и площадь поверхности раздела фаз. Значение энергии активации является тем фактором, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции. Если энергия активации мала (< 40 кДж/моль), то это означает, что значительная часть столкновений между частицами реагирующих веществ приводит к их взаимодействию, и скорость такой реакции очень большая. Все реакционного обмена протекают практически мгновенно, ибо в этих реакциях участвуют разноименно заряженные ионы, и энергия активации в данных случаях ничтожно мала. Если энергия активации велика (> 120 кДж/моль), то это означает, что лишь ничтожная часть столкновений между взаимодействующими частицами приводит к реакции. Скорость такой реакции поэтому очень мала. Например, протекание реакции синтеза аммиака при обычной температуре заметить практически невозможно. Если энергии активации химических реакций имеют промежуточные значения (40120 кДж/моль), то скорости таких реакций будут средними. К таким реакциям можно отнести взаимодействие натрия с водой или этиловым спиртом, обесцвечивание бромной воды этиленом, взаимодействие цинка с соляной кислотой и др. При повышении температуры в большинстве случаев скорость химической реакции значительно возрастает. В XIX в. голландский химик Я. X. Вант- Гофф сформулировал правило: повышение температуры на каждые 10°С приводит к увеличению скорости реакции в 2-4 раза. При повышении температуры средняя скорость молекул, их энергия, число столкновений увеличиваются незначительно, зато резко повышается доля «активных» молекул, участвующих в эффективных соударениях, преодолевающих энергетический барьер реакции. Математически эта зависимость выражается соотношением: 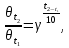 (2) (2) где 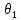 и и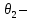 скорости реакции соответственно при конечной t2 и начальной t1температурах, м/с; скорости реакции соответственно при конечной t2 и начальной t1температурах, м/с;γ – температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции с повышением температуры на каждые 10 °С. Однако для увеличения скорости реакции повышение температуры не всегда применимо, т. к. исходные вещества могут начать разлагаться, могут испаряться растворители или сами вещества и т. д. Скорость реакций, идущих на поверхности веществ, т. е. гетерогенных, зависит при прочих равных условиях от свойств этой поверхности. Известно, что растертый в порошок мел гораздо быстрее растворяется в соляной кислоте, чем равный по массе кусочек мела. Увеличение скорости реакции объясняется в первую очередь увеличением поверхности соприкосновения исходных веществ, а также рядом других причин, например, нарушением структуры «правильной» кристаллической решетки. Это приводит к тому, что частицы на поверхности образующихся микрокристаллов значительно реакционноспособнее, чем те же частицы на «гладкой» поверхности. В промышленности для проведения гетерогенных реакций используют «кипящий слой», чтобы увеличить поверхность соприкосновения реагирующих веществ, подвод исходных веществ и отвод продуктов. Например, при производстве серной кислоты с помощью «кипящего слоя» проводят обжиг колчедана. Опыт №1.Изучение зависимости скорости гомогенной реакции от концентрации реагирующих веществ Эту зависимость можно изучить на классическом примере гомогенной реакции взаимодействия тиосульфата натрия с серной кислотой, протекающей по уравнению: Na2S2O3+H2SO4=Na2SO4+S+SO2+H2O. Сера образует с водой коллоидный раствор. Время реакции засекают по секундомеру от момента сливания реагентов до появления едва заметного помутнения.Определив время, можно вычислить относительную скорость реакции V=1/t. Приборы и реактивы: пробирки, секундомер, раствор тиосульфата натрия, раствор серной кислоты. Ход работы: приготовить три сухие чистые пробирки, пронумеровать их. В первую пробирку внести 4 капли раствора тиосульфата натрия и 8 капель воды, во вторую – 8 капель тиосульфата натрия и 4 капли воды, в третью – 12 капель тиосульфата натрия без добавления воды. Пробирки встряхнуть. Получим 3 раствора тиосульфата натрия разной концентрации. Если условно обозначить молярную концентрацию тиосульфата натрия в первой пробирки через «с», то во второй пробирке она будет, соответственно, 2с моль/л, в третьей –3с моль/л; в первую пробирку внести одну каплю серной кислоты. Одновременно включить секундомер; встряхивая пробирку, держа ее на уровне глаз, следить за появлением мути. При появлении малейших ее признаков – остановить секундомер, отметить время реакции и записать его в таблицу. Пробирку сразу тщательно вымыть; проделать аналогичные опыты во второй и третьей пробирках. Результаты занести в таблицу №1. Таблица 1 – Экспериментальные данные для определения зависимости скорости реакции от концентрации
По полученным данным построить график зависимости V=f(c), откладывая по оси абсцисс – концентрацию, а по оси ординат – скорость. Сделать вывод о характере зависимости скорости данной реакции от концентрации тиосульфата натрия. https://www.youtube.com/watch?v=_RJKvaK6kEI Опыт 2: https://www.youtube.com/watch?v=wmuglTWP0rA Опыт 3: https://www.youtube.com/watch?v=3QjCBkRpJw4 |

 , с
, с