Лабораторные работы по химии для 1 курса. Лабораторная работа 1 Моделирование построения Периодической таблицы химических элементов
 Скачать 484.57 Kb. Скачать 484.57 Kb.
|
|
Критерии оценки:Выполнение работы более 90% –оценка «5», 70-90% - оценка «4», 50 -70% - оценка «3», Менее 50% - оценка «2». Лабораторная работа№20-22 Растворение белков в воде. Обнаружение белков в молоке и в мясном бульоне. Изучение свойств белков. Цель: изучить свойства белков. Оборудование и реактивы: - раствор белка; - раствор медного купороса; - раствор ацетата свинца; - пробирки Ход работы: Опыт Результаты Денатурация раствора белка куриного яйца солями тяжелых металлов. В 2 пробирки налейте по 1-2 мл раствора белка и медленно, при встряхивании, по каплям добавьте в одну пробирку насыщенный раствор медного купороса, а в другую – раствор ацетата свинца. Отметьте образование труднорастворимых солеобразных соединений белка. Данный опыт иллюстрирует применение белка как противоядия при отравлении тяжелыми металлами. Сделайте выводы._____________________ _____________________________________ _____________________________________ _____________________________________ _____________________________________ _____________________________________ Растворение белков Многие белки растворяются в воде, что обусловлено наличием на поверхности белковой молекулы свободных гидрофильных групп. Растворимость белка в воде зависит от структуры белка, реакции среды, присутствия электролитов. В кислой среде лучше растворяются белки, обладающие кислыми свойствами, а в щелочной - белки, обладающие основными свойствами. Альбумины хорошо растворяются в дистиллированной воде, а глобулины растворимы в воде только в присутствии электролитов. Не растворяются в воде белки опорных тканей (коллаген, кератин, эластин и др.) Оборудование и реактивы: - яичный белок; - дистиллированная вода; - раствор хлористого калия; - кератин (шерсти или волос). Ход работы: К 2 каплям неразведенного яичного белка прибавляют 1 мл дистиллированной воды и перемешивают. При этом яичный альбумин растворяется, а яичный глобулин выпадает в виде небольшого осадка. Проверяют растворимость в воде и 5% растворе хлористого калия белка кератина, содержащегося в шерсти и волосах. Результаты работы оформить в виде таблицы: Название белка в Н2О в 5% КСl Денатурация белка спиртом. Оборудование и реактивы: раствор белка; этанол, пробирки Опыт Результаты К 1 мл 1% раствора белка добавляют 2 мл органического растворителя (96% этанола, хлороформа, ацетона или эфира) и перемешивают. Образование осадка можно усилить добавлением нескольких капель насыщенного раствора хлорида натрия. Осаждение белков при нагревании. Белки являются термолабильными соединениями и при нагревании свыше 50-60°С наступает денатурация. Сущность тепловой денатурации заключается в развертывании специфической структуры полипептидной цепи и разрушении гидратной оболочки белковых молекул, что проявляется заметным уменьшением их растворимости. Наиболее полное и быстрое осаждение происходит в изоэлектрической точке, т.е. при таком значении рН среды, когда суммарный заряд белковой молекулы равен нулю, поскольку при этом частицы белка наименее устойчивы. Белки, обладающие кислыми свойствами, осаждаются в слабокислой среде, а белки с основными свойствами – в слабощелочной. В сильнокислых или сильнощелочных растворах денатурированный при нагревании белок в осадок не выпадает, так как частицы его перезаряжаются и несут в первом случае положительный, а во втором отрицательный заряд, что повышает их устойчивость в растворе. Оборудование и реактивы: - 1% раствор яичного белка; - 1% раствор уксусной кислоты; - 10% раствор уксусной кислоты ; - 10% раствор гидроксида натрия; -4 пробирки, держатель, спиртовка. Опыт Результаты В четыре пронумерованные пробирки приливают по 10 капель 1% раствора яичного белка. а) первую пробирку нагревают до кипения. б) во вторую пробирку добавляют 1 каплю 1% раствора уксусной кислоты и нагревают до кипения. в) в третью пробирку добавляют 1 каплю 10% раствора уксусной кислоты и нагревают до кипения. г) в четвертую пробирку добавляют 1 каплю 10% раствора гидроокиси натрия и нагревают до кипения. а) Раствор белка мутнеет, но так как частицы денатурированного белка несут заряд, они в осадок не выпадают. Это связано с тем, что яичный белок имеет кислые свойства (изоэлектрическая точка его равна рН 4,8) и в нейтральной среде заряжен отрицательно; б) Выпадает осадок белка, так как раствор белка приближается к изоэлектрической точке и белок теряет заряд; в) Осадка не образуется, так как в сильнокислой среде частицы белка приобретают положительный заряд (сохраняется один из факторов устойчивости белка в растворе); г) Осадка не образуется, так как в щелочной среде отрицательный заряд частиц белка увеличивается. Сделайте выводы._____________________________________________________________ _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Условия выполнения задания 1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время 2. Максимальное время выполнения задания: ____90_______ мин. 3. Вы можете воспользоваться учебником, конспектом лекций Шкала оценки образовательных достижений: Критерии оценки:Выполнение работы более 90% –оценка «5», 70-90% - оценка «4», 50 -70% - оценка «3», Менее 50% - оценка «2». Практическая работа№1 Приготовление раствора заданной концентрации. Цель: приготовить растворы солей определенной концентрации. научиться готовить раствор заданной концентрации, используя весы и мерную посуду. Оборудование: стеклянная лопаточка; стакан объемом 50 мл; стеклянная палочка с резиновым наконечником; мерный цилиндр; весы; холодная кипяченая вода. соли; Теоретическая часть Раствор- это однородная система , состоящая из растворителя ,растворенных веществ и продуктов их взаимодействия. Растворителем чаще всего является то вещество, которое в чистом виде имеет тоже агрегатное состояние, что и раствор, либо присутствует в избытке. По агрегатному состоянию различают растворы: жидкие, твердые, газообразные. По соотношению растворителя и растворенного вещества : разбавленные, концентрированные , насыщенные, ненасыщенные , перенасыщенные. Состав раствора обычно передается содержанием в нем растворимого вещества в виде массовой доли, процентной концентраций и молярности. Массовая доля (безразмерная величина) – это отношение массы растворенного вещества к массе всего раствора: Wм .д .= mраст. вещества/mраствора. (учебникО.С.Габриелян, И.Г.Остроумов Химия, М. «Академия» 2013, с 57) Процентная концентрация ( %) – это величина показывающая сколько грамм растворенного вещества cсодержится в 100 гр. раствора : W% = mраст. вещества100% /mраствора (учебникО.С.Габриелян, И.Г.Остроумов Химия, М. «Академия» 2013, с 57) Молярная концентрация , или молярность (моль/литр)- это величина показывающая сколько молей растворимого вещества содержатся в 1 литре раствора: См = mраст. вещес/Мr(раст. вещества )V раствора. (учебникО.С.Габриелян, И.Г.Остроумов Химия, М. «Академия» 2013, с 57) Ход работы: 1. Приготовление раствора соли с определенной массовой долей вещества. Задача: определите, какую массу соли и воды потребуется взять для приготовления 20 г водного раствора поваренной соли с массовой долей соли 5 %. Произведите расчеты: Дано: Найти: Решение: Приготовьте раствор. Для этого: Отвесьте соль и поместите ее в стакан. Отмерьте измерительным цилиндром необходимый объем воды и вылейте в колбу с навеской соли. Внимание! При отмеривании жидкости глаз наблюдателя должен находиться в одной плоскости с уровнем жидкости. Уровень жидкости прозрачных растворов устанавливают по нижнему мениску. 2. Приготовление раствора с заданной молярной концентрацией. Задача: определите, какую массу соли и воды потребуется взять для приготовления 25 мл раствора хлорида калия, молярная концентрация которого 0,2 моль/л. Произведите расчеты: Дано: Найти: Решение: Приготовьте раствор. В соответствии с расчетами возьмите навеску соли, поместите ее в мерный стакан и добавьте немного воды (примерно 7-10 мл). помешивая стеклянной палочкой, растворите полностью соль, а затем прилейте воды до необходимого по условию задачи объема. 3. Задания для самостоятельного решения 1. Приготовлено 300 г 5%-ного раствора иода в этаноле. Рассчитайте массу (в граммах) использованного спирта 2. Какой объем (в литрах, н. у.) метаналя необходимо растворить в 500 мл воды, чтобы приготовить 30 %-ныйформалин. 3. Приготовлен раствор из 219 г кристаллогидрата СаCl2 6Н2O и 1 л воды. Рассчитайте массовую долю (в %) безводной соли в этом растворе. 4. Определите количество гидроксида калия (моль), содержащееся в 3 л 25 %-ного раствора (плотность 1,24 г/мл). 5.Определите массовую долю (%) нитрита железа (II), если из 4 кг 15% раствора выпарили 1 кг. Условия выполнения задания 1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время 2. Максимальное время выполнения задания: ____90_______ мин. 3. Вы можете воспользоваться учебником, конспектом лекций Шкала оценки образовательных достижений: Критерии оценки:Выполнение работы более 90% –оценка «5», 70-90% - оценка «4», 50 -70% - оценка «3», Менее 50% - оценка «2». Практическая работа№2-3 Получение, собирание и распознавание газов. Решение экспериментальных задач. Цель: получит экспериментально некоторые газы. Оборудование: гранулы цинка, серная кислота, хлорид цинка и азотная кислота; сульфит натрия и серная кислота; сульфат меди (II) и соляная кислота; карбонат калия и соляная кислота. Теоретическая часть Углекислый газ или оксид углерода (IV) СО2 – бесцветный, не имеющий запах газ. Он примерно в полтора раза тяжелее воздуха. Растворим в воде. В лаборатории углекислый газ получают действием соляной кислоты на карбонат кальция: CaCO3 + 2HCl = CaCl2 + H2O + CO2↑. Распознание: Помутнение известковой воды (продувание углекислого газа через известковую воду) СО2 + Са(ОН)2 = СаСО3 + Н2О ; Горящую лучину опустить в сосуд с углекислым газом. Лучина гаснет. Водород (Н2) – самый легкий, бесцветный газ, не имеет запаха. Вытеснением водорода металлами из растворов кислот: Zn + 2HCl = ZnCl2 + H2 ↑. Кислород (О2) - без запаха и цвета, тяжелее воздуха, мало растворим в воде. 1.Разложением перманганата калия: 2KMnO4 = K2MnO4 + MnO2 + О2 ↑; 2.Разложением пероксида водорода: 2H2O2 = 2Н2О + О2 ↑ . Распознание: Вспыхивание тлеющей лучинки, внесенной в сосуд с кислородом. Аммиак (NН3) имеет резкий характерный запах, без цвета, хорошо растворим в воде, легче воздуха. 1.В промышленности: 3H2 + N2 = 2NH3 ; 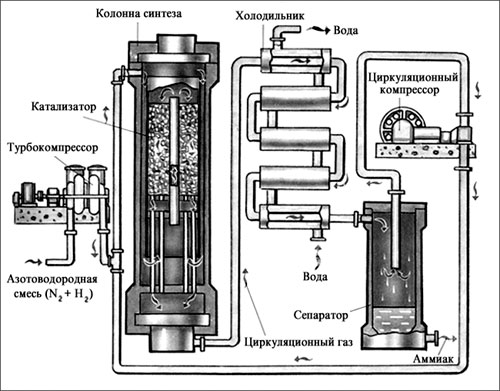 2. В лаборатории: NH4Cl + NaOH = NaCl + H2O + NH3↑. Ход работы: Опыт Результаты Задание № 1. Налейте в пробирку 1—2 мл концентрированной серной кислоты и опустите в нее кусочек цинка. Обратите внимание на скорость реакции. Перелейте содержимое в другую пробирку с 5—10 мл воды. Изменилась ли скорость реакции? Составьте уравнение происходящей реакции в молекулярном, ионном и сокращенном ионном виде: _______________________________________ ______________________________________ __________________________________________ _______________________________________ Покажите переход электронов и объясните: а) что в этой реакции является окислителем; _______________________________________ _______________________________________ ______________________________________ ______________________________________ б) как и почему изменяется скорость реакции при разбавлении? _______________________________________ Задание №2. Подействуйте на кусочки цинка: а) разбавленной серной кислотой; б) концентрированной серной кислотой (слегка нагрейте). Осторожно понюхайте выделяющийся из второй пробирки газ. Составьте уравнения происходящих реакций и укажите окислитель в первом и во втором случае. а)________________________________________ _______________________________________ _______________________________________ б)_____________________________________ _______________________________________ _______________________________________ Задание №3. На раствор хлорида магния последовательно, подействуйте растворами: а) гидроксида натрия; б) сульфата калия; в) карбоната натрия; г) нитрата цинка; д) ортофосфата калия; е) сульфида натрия. Составьте уравнения реакций, идущих до конца, в молекулярном, ионном и сокращенном ионном виде. _______________________________________ _______________________________________ _______________________________________ _______________________________________ _______________________________________ _______________________________________ _______________________________________ _______________________________________ _______________________________________ _______________________________________ _______________________________________ _______________________________________ Задание №5. Даны растворы: а) карбоната калия и соляной кислоты; б) сульфида натрия и серной кислоты; в) хлорида цинка и азотной кислоты; г) сульфита натрия и серной кислоты; д) сульфата меди (II) и соляной кислоты. Слейте попарно эти растворы, немного нагрейте, осторожно понюхайте и определите, в каких случаях реакции идут до конца и почему. Составьте уравнения соответствующих реакций в молекулярном, ионном и сокращенном ионном виде. _______________________________________ _______________________________________ _______________________________________ _______________________________________ _______________________________________ _______________________________________ _______________________________________ _______________________________________ _______________________________________ _______________________________________ _______________________________________ _______________________________________ Общий вывод:_________________________________________________________________ _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________ ___________________________________________________________________________________________________________________________________________________________________________________________________ Условия выполнения задания 1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время 2. Максимальное время выполнения задания: ____90_______ мин. 3. Вы можете воспользоваться учебником, конспектом лекций Шкала оценки образовательных достижений: |
