Лабораторные работы по химии для 1 курса. Лабораторная работа 1 Моделирование построения Периодической таблицы химических элементов
 Скачать 484.57 Kb. Скачать 484.57 Kb.
|
|
2. Получение гидроксида железа(П) и взаимодействие его с кислотами Налейте в пробирку 2 — 3 мл свежеприготовленного раствора сульфата железа (П) и добавьте в нее немного раствора гидроксида натрия. К полученному осадку, вначале белому, а затем позеленевшему, добавьте раствор соляной кислоты. Что наблюдаете в начале реакции ______________________________________ ______________________________________ и через 2 — 3 мин после начала реакции? ______________________________________ ______________________________________ Что наблюдаете? _______________________ ______________________________________ Напишите уравнения реакций в молекулярной и ионной формах. _______________________________________ _______________________________________ _______________________________________ _______________________________________ _______________________________________ _______________________________________ 3. Получение гидроксида железа(Ш) и взаимодействие его с кислотами Прилейте в пробирку 2 — 3 мл раствора хлорида железа(Ш) и добавьте немного раствора щелочи. К выпавшему осадку прилейте раствор соляной кислоты. Что наблюдаете? ______________________________________ ______________________________________ Что наблюдаете? _______________________ ______________________________________ Напишите уравнения реакций в молекулярной и ионной формах. _______________________________________ _______________________________________ _______________________________________ _______________________________________ _______________________________________ _______________________________________ 4. Получение гидроксида хрома(Ш) и исследование его свойств В две чистые пробирки прилейте по 2 мл раствора сульфата хрома(Ш) и с помощью пипетки добавьте по 5 —6 капель раствора щелочи. В первую пробирку добавьте избыток раствора щелочи, а во вторую прилейте раствор соляной кислоты. Что наблюдаете? _______________________ ______________________________________ Что наблюдаете? _______________________ ______________________________________ Напишите уравнения реакций в молекулярной и ионной формах. _______________________________________ _______________________________________ _______________________________________ _______________________________________ _______________________________________ _______________________________________ . Общий вывод:_________________________________________________________________ _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________ ___________________________________________________________________________________________________________________________________________________________________________________________________ Условия выполнения задания 1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время 2. Максимальное время выполнения задания: ____90_______ мин. 3. Вы можете воспользоваться учебником, конспектом лекций Шкала оценки образовательных достижений: Критерии оценки:Выполнение работы более 90% –оценка «5», 70-90% - оценка «4», 50 -70% - оценка «3», Менее 50% - оценка «2». Лабораторная работа№12 Изготовление моделей молекул органических веществ. Цель урока: закрепить теоретический материал. приобрести навыки написания структурных формул изомеров органических веществ. научиться собирать шаростержневые модели молекул органических веществ; закрепить знания на составление структурных формул изомеров и гомологов; познакомиться с названиями органических веществ по систематической (международной) номенклатуре ИЮПАК. построить шаростержневые и масштабные модели молекул первых гомологов предельных углеводородов и их галогенопроизводных. Приборы и реактивы: деревянные стержни, материал для лепки (пластилин), набор шаростержневых моделей. Общие указания. Для построения моделей используйте детали готовых наборов или пластилин с палочками. Изготовьте шарики, имитирующие атомы углерода, готовят обычно из пластилина темной окраски, шарики, имитирующие атомы водорода, - из светлой окраски, атомы хлора – из зеленого или синего цвета. Для соединения шариков используют палочки (спички, зубочистки). Написав формулу органического соединения, изготовьте его пространственную структуру, используя заранее приготовленные модели атомов и применяя знания о строении молекул предельных углеводородов (угол связи, длина связи, форма молекулы). Ход занятия: Задание 1. По формуле органического соединения напишите пространственную структуру: А) нонана Б) декан В) гексана Г) октана. Задание 2. Напишите структурные формулы всех возможных изомеров веществ пентана, гексана, этана, дихлорметана CH2Cl2, в соответствии с ними сделайте шаровидные модели изомеров на примере бутана и изобутана Н Н H H | | | | Н – С – C – C – C – H | | | | Н Н H H Н H H | | | Н – С – C – C – H | | | H | H H – C – H | H Условия выполнения задания 1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время 2. Максимальное время выполнения задания: ____90_______ мин. 3. Вы можете воспользоваться учебником, конспектом лекций Шкала оценки образовательных достижений: Критерии оценки:Выполнение работы более 90% –оценка «5», 70-90% - оценка «4», 50 -70% - оценка «3», Менее 50% - оценка «2». Практические работы (в том числе работа на компьютере) Лабораторная работа №13-14 Ознакомление с коллекцией образцов нефти и продуктов ее переработки. Ознакомление с коллекцией каучуков и образцами изделий из резины. Цель: изучить физические свойства нефти, продуктов ее переработки. Оборудование: Приборы и реактивы: штативы, пробирки Растворы веществ: бромная вода, KMnO4, HCl, фракции нефти. Ход работы Опыт Результат Опыт №1 Поместите в пробирку несколько кусочков с каучука и закройте ее пробкой с газоотводной трубкой. Пробирку с каучуком нагрейте, и продукты разложения соберите в пробирку-приемник. Половину полученных жидких продуктов влейте в пробирку с 1—2 мл бромной воды. Оставшиеся жидкие продукты влейте в другую пробирку с раствором перманганата калия, слегка подкисленным серной кислотой. Что наблюдаете? _________________________________ ____________________________________________________________________________________________________________________________________ Опыт №2 В две пробирки налейте по 2—3 мл бензина. В одну из пробирок опусти кусочек резины, а в другую — такой же кусочек невулканизированного каучука. Закройте пробирки корковыми пробками и оставьте до следующего занятия. Через несколько дней можно будет убедиться, что каучук в бензине частично растворяется, а резина только набухает. Что наблюдаете? _________________________________ ____________________________________________________________________________________________________________________________________ Используя ранее полученные знания и учебник О.С. Габиелян, И.Г. Остроумов Химия, тема: «Этиленовые и диеновые углеводороды» вам, предлагается выполнить следующие задания: Задание №1. Как доказать, что в продуктах термического разложения каучук содержатся непредельные углеводороды? _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Задание №2. Вам предлагаются образцы резины из следующего перечня: бензомаслостойкая, теплостойкая, морозостойкая, теплохимическистойкая. Пользуясь таблицей №1, определите, какая именно резина вам выдана. Таблица 1. Основные типы резин и характеристики каучуков Тип резины Вид каучука Плотность, г/см3 Предел прочности, МПа Относительное удлинение, % Удлинение после разрыва, % Диапазон рабочих температур, °С Общего назначения Натуральный (НК) 0,91 29 650 32 -50...+130 Бутадиеновый синтетический (СКБ) 0,91 17 470 60 -50...+150 Изопреновый синтетический (СКИ) 0,91 30 700 28 -50...+130 Специального назначения: бензомаслостойкая Бутадиен-нитрильный (СКН) 0,96 26 600 20 -40...+170 теплостойкая Силоксановый (СКТ) 1,85 6 250 4 -70...+300 теплохимическистойкая Фторкаучук (СКФ) 1,85 17 200 8 -40...+300 морозостойкая Бутадиен-метилстирольный (СКМС) и бутадиен-стирольный (СКС) 0,94 31 800 16 -80...+130 ___________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Задание №3.Вам предлагается коллекция каучуков. Пользуясь таблицей №2, опишите в сравнении 2 образца каучука. Таблица 2 Важнейшие виды каучуков и их применение Название Исходные вещества (мономеры) Химическая формула полимера Важнейшие свойства и применение Бутадиеновый каучук СН2 = СН — СН— СН2 1,3-бутадиен 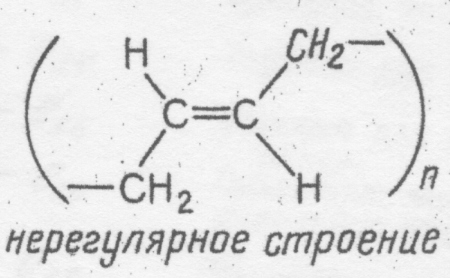 Характерна водо- и газонепроницаемость. По эластичности отстает от природного каучука. Для. производства кабелей, обуви, принадлежностей быта Диви-ниловый каучук СН2 = СН — СН = СН2 1,3-бутадиен 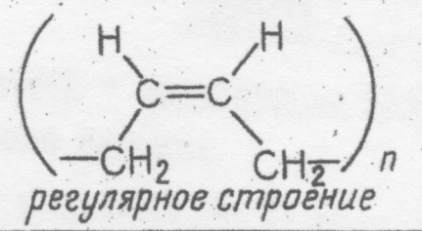 По износоустойчивости и эластичности превосходит природный каучук. В производстве шин Изоп-реновый каучук СН2 = С— СН = СН2 | СН3 2-метил-1,3-бутадиен 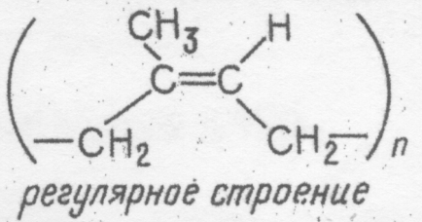 По эластичности и износоустойчивости сходен с природным каучуком. В производстве шин. Хлоро преновый каучук СН2 = С — СН = СН2 | Cl 2-хлор-1,3-бутадиен (- СН2 – C = СН - СН2 -)n | Сl Устойчив к воздействиям высоких температур, бензинов и масел. В производстве кабелей, трубопроводов для перекачки бензинов, нефти Бутадиен-стирольный каучук СН2 = СН— СН = СН2 1,3-бутадиен СН – СН2 | С6Н5 стирол (- CH2 – CH = CH— СН2-- - СН - СН2- ) n | С6Н5 Характерна газонепроницаемость, но недостаточная жароустойчивость. В производстве лент для транспортеров, автокамер ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Задание №4. Вам предлагаются образцы фракций перегонки нефти. Пользуясь таблицей № 3, определите где, что находится. Таблица 3. Фракции перегонки нефти Название фракции Ткип и 0С Углеродный состав Применение Бензин 40-200 С5 – С11 Моторное топливо Лигроин 150 - 250 С8 – С14 Горючее для тракторов Керосин 180 -300 С12 – С16 Горючее для самолетов, ракет Газойль /соляровое масло/ 300 - 460 С16 – С15 Смазочные масла, дизельное топливо Мазут 360- 500 С26 – С38 Из мазута получают тяжелые смазочные масла, вазелин, парафин Гудрон Асфальт /дорожное покрытие/ ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Условия выполнения задания 1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время 2. Максимальное время выполнения задания: ____90_______ мин. 3. Вы можете воспользоваться учебником, конспектом лекций Шкала оценки образовательных достижений: Критерии оценки:Выполнение работы более 90% –оценка «5», 70-90% - оценка «4», 50 -70% - оценка «3», Менее 50% - оценка «2». Лабораторная работа №15-19 Растворение глицерина в воде и взаимодействие с гидроксидом меди(II). Свойства уксусной кислоты, общие со свойствами минеральных кислот. Доказательство непредельного характера жидкого жира. Взаимодействие глюкозы и сахарозы с гидроксидом меди(II). Качественная реакция на крахмал. Цель работы: изучить свойства глицерина уксусной кислоты, жидкого жира, глюкозы, сахарозы и крахмала. Приборы и реактивы: штативы, пробирки, пробиркодержатель, спиртовки. Растворы веществ: глицерин, гидроксид натрия, раствор сульфата меди (II), подсолнечное масло, твердый животный жир, бромная вода, глюкоза, крахмальный клейстер. Ход работы: Опыт Результаты 1.Растворение глицерина в воде и взаимодействие с гидроксидом меди (II) Налейте в пробирку 1 см3 глицерина, добавьте столько же воды и встряхните. Затем добавьте в 2-3 раза больше воды. Перемешайте содержимое пробирки. В пробирку налейте 1-2 см3 раствора гидроксида натрия и добавьте несколько капель раствора сульфата меди (II). К образовавшемуся осадку добавьте немного глицерина и перемешайте смесь стеклянной палочкой. Сделайте вывод о растворимости глицерина в воде. ___________________________________ ______________________________________ ______________________________________ Напишите молекулярное и краткое ионно-молекулярное уравнения этой реакции. ________________________________________ _________________________________________ _________________________________________ __________________________________________ __________________________________________ Отметьте, какие изменения произошли. ______________________________________ ______________________________________ ______________________________________ ______________________________________ Сделайте соответствующий вывод о свойствах глицерина: __________________________________________________________ 2.Свойства уксусной кислоты, общие со свойствами минеральных кислот Разбавьте уксусную кислоту наполовину водой и разлейте в четыре пробирки. В первую пробирку внесите 1-2 капли раствора лакмуса (отметьте цвет индикатора), затем нейтрализуйте кислоту раствором щелочи. Во вторую пробирку добавьте немного порошка магния, в третью — оксида меди (П), а в четвертую — карбоната натрия. Отметьте цвет индикатора в 1-ой пробирке: __________________________________________ Составьте полные и краткие ионно-молекулярные уравнения реакций. 1-я пробирка: __________________________________________ __________________________________________ __________________________________________ __________________________________________ 2-я пробирка: __________________________________________ __________________________________________ __________________________________________ __________________________________________ 3-я пробирка: __________________________________________ __________________________________________ __________________________________________ __________________________________________ 4-я пробирка: __________________________________________ __________________________________________ __________________________________________ __________________________________________ Сделайте вывод о свойствах уксусной кислоты. ________________________________________________________________ 3.Доказательства непредельного характера жидкого жира В одну пробирку налейте 1-2 см3 подсолнечного масла, во вторую поместите кусочек твердого животного жира и нагрейте ее до расплавления жира. К содержимому каждой пробирки добавьте немного бромной воды и встряхните смеси. Отметьте, в какой из пробирок бромная вода обесцветилась. О чем это свидетельствует? __________________________________________ __________________________________________ __________________________________________ Составьте уравнение реакции. __________________________________________ __________________________________________ __________________________________________ __________________________________________ __________________________________________ __________________________________________ __________________________________________ 4.Взаимодействие глюкозы и сахарозы с гидроксидом меди (II) Налейте в пробирку 2 см3 раствора гидроксида натрия и прибавьте не более трех капель раствора сульфата меди (II). К свежеприготовленному гидроксиду меди (II) добавьте 1 см3 раствора глюкозы. Встряхните смесь. Нагрейте содержимое пробирки. Что вы наблюдаете? __________________________________________ Что доказывает данный опыт? _______________________________________ __________________________________________ Какие соединения вступают в аналогичную реакцию? ______________________________ _______________________________________ Какие изменения вы наблюдаете? ____________ _________________________________________ О чем они свидетельствуют? ________________ _________________________________________ Какие вещества при нагревании с гидроксидом меди (II) ведут себя аналогичным образом? ______________________________________ Составьте уравнение реакции глюкозы с гидроксидом меди (II) при нагревании. _______________________________________ _______________________________________ _______________________________________ _______________________________________ _______________________________________ _______________________________________ 5.Качественная реакция на крахмал К 0,5-1 см3 крахмального клейстера в пробирке добавьте каплю спиртового раствора йода. Нагрейте полученную смесь крахмального клейстера с йодом. Нанесите несколько капель спиртового раствора йода на кусочек хлеба и на срез клубня картофеля. Что вы наблюдаете? ______________________ ________________________________________ Какие изменения происходят? ________________________________________ Восстанавливается ли прежняя окраска при охлаждении? ____________________________ Объясните наблюдаемое явление. ___________ ________________________________________ Что вы наблюдаете? ______________________ ___________________________________________ ________________________________________ ________________________________________ ________________________________________ Общий вывод:_________________________________________________________________ _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________ ___________________________________________________________________________________________________________________________________________________________________________________________________ Условия выполнения задания 1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время 2. Максимальное время выполнения задания: ____90_______ мин. 3. Вы можете воспользоваться учебником, конспектом лекций Шкала оценки образовательных достижений: |
