Лабораторные работы по химии для 1 курса. Лабораторная работа 1 Моделирование построения Периодической таблицы химических элементов
 Скачать 484.57 Kb. Скачать 484.57 Kb.
|
|
Лабораторная работа №1 Моделирование построения Периодической таблицы химических элементов. Цель работы: изучить структуру и состав периодической таблицы химических элементов; умение давать характеристику элементов по месту их нахождения в таблице. закрепить представление о строении вещества. Ход работы Используя ранее полученные знания при изучении тем: «Основные понятия и законы химии», «Периодический закон и периодическая система химических элементов Д.И. Менделеева в свете учения о строении атома» студентам предлагается выполнить несколько вариантов заданий. Задание № 1 Воспользуйтесь учебником О.С.Габриелян, И.Г.Остроумова Химия тема: «Периодический закон и периодическая система химических элементов Д.И. Менделеева в свете учения о строении атома», ответьте на вопросы: Что Менделеев считал главной характеристикой атома при построении периодической системы? _________________________________________________________________________________________________________________________________________________________________________________________________________ Сколько вариантов имеет периодическая система элементов? _________________________________________________________________________________________________________________________________________________________________________________________________________ Изучите длинный и короткий вариант таблицы Менделеева. Напишите, чем они отличаются? _________________________________________________________________________________________________________________________________________________________________________________________________________ *Предложите свою структуру периодической системы таблицы Менделеева (задание выполняется в свободной форме на отдельном листе). Задание № 2. Теоретическая часть Зная формулы веществ, состоящих из двух химических элементов, и валентность одного из них, можно определить валентность другого элемента. Наприме: дана формула оксида меди Cu2O, необходимо определить валентность меди Валентность кислорода постоянная и равна II, а на один атом кислорода приходится 2 атома меди. Следовательно, валентность меди равна I. Валентность Примеры формул соединений I II III I и II II и III II и IV III и V II, III и VI II, IV и VI С постоянной валентностью H, Na, K, Li O, Be, Mg, Ca, Ba, Zn Al, B С переменной валентностью Cu Fe, Co, Ni Sn,Pb P Cr S H2O, Na2O MgO, CaO Al2O3 Cu2O, CuO FeO, Fe2O3 SnO, SnO2 PH3, P2O5 CrO, Cr2O3, CrO3 H2S, SO2, SO3 Определить валентности следующих элементов: А) SiH4, CrO3, H2S, CO2, SO3, Fe2O3, FeO Б) CO, HCl, HBr, Cl2O5, SO2, РН3, Cu2O, B) Al2O3, P2O5, NO2, Mn2O7,Cl2O7, Cr2O3, Г) SiO2, B2O3, SiH4, N2O5,MnO, CuO, N2O3. ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Задание № 3. Теоретическая часть Относительная молекулярная масса - сумма всех относительных атомных масс входящих в молекулу атомов химических элементов. Мr = Аr1 * i1+ Ar2* i2+ Аr3 * i3… Где Мr – относительная молекулярная масса вещества Аr1 , Ar2, Аr3 … – относительные атомные массы элементов входящих в состав этого вещества i1, i2, i3… – индексы при химических знаках химических элементов. Пример: Вычислить относительную молекулярную массу молекулы серной кислоты (H2SO4) Последовательность действий Выполнение действий 1. Записать молекулярную формулу серной кислоты. H2SO4 2. Подсчитать по формуле относительную молекулярную массу серной кислоты, подставив в формулу относительные атомные массы элементов и их индексы Mr (H2SO4 ) = Ar (H)· n + Ar (S)· n + Ar (O)· n = 1·2 + 32 + 16?4=98 3. Записать ответ. Ответ: Mr (H2SO4 ) = 98. Определить относительную молекулярную массу веществ: A) Cu2O, KNO3, Na2Si03, Н3РО4 Б) A12(S04)3, H2SO4 , K2S, Mg(OH)2 B) SO3, CaCO3, H2SO3, NH4OH Г) PO3, Zn(OH)2, H2SiO3, AlCl3 ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Задание № 4. Теоретическая часть «Атом» - греч «неделимый». Атомы, тем не менее, имеют сложное строение. В центре – атомное ядро, имеющее чрезвычайно малые размеры по сравнению с размерами атома. В состав ядра входят положительные частицы – протоны (р+) и нейтральные частицы – нейтроны (n0). Таким образом, ядро атома заряжено положительно. Протоны – частицы с положительным зарядом +1 и относительной массой 1. Нейтроны – электронейтральные частицы с относительной массой 1. Положительный заряд атома равен числу протонов. Число протонов в ядре соответствует порядковому номеру химического элемента в периодической сиситеме Электронная оболочка атома окружает положительно заряженное ядро и состоит из отрицательных частиц – электронов е-. Электроны – частицы с отрицательнымзарядом -1 и относительной массой 1/1837 от массы протона. Так как в целом масса всех электронов ничтожно мала, ее можно пренебречь. Значит, практически вся масса атома сосредоточена в ядре и представляет собой сумму масс протонов и нейтронов. Массовое число – суммарное число протонов и нейтронов, округленно равно значению относительной атомной массе химического элемента (Ar). Число нейтронов в ядре равно разности между массовым числом и числом протонов. N = A – Z N – число нейтронов A – массовое число Z – число протонов. Атом в целом электронейтрален. Число электронов, движущихся вокруг ядра, равно числу протонов в ядре. Определить число протонов, нейтронов и электронов и заряд ядра атома для следующих элементов, заполнив таблицу: А) I, Na, CI, Са, Al Б) S, P, C, K, Ne B) F, O, B, Ba, Si Г) H, N, Zn, Kr, As Элемент е- р+ n0 Заряд ядра Задание № 5. Например: Найти массовые отношения элементов в оксиде серы (IV) SO2. Последовательность действий Выполнение действий 1.Записать формулу для вычисления массовых отношений m(эл.1) : m(эл.2) = Ar (эл.1) ·n1 : Ar (эл.2) ·n2 2.Вычислить массовые соотношения серы и кислорода, подставив соотношения атомных масс m(S): m(O) = 32: 16×2=32 : 32 2. 3. Сократить полученные числа на 32 m(S) : m(O) = 1: 1 Найти массовые отношения между элементами по химической формуле сложного вещества: А) Са(ОН)2, CuNO3 Б) Na3P04, , H2SiO3 В) Na2Si03. Н3РО4 Г) H2SO3 , KNO3 Задание № 6. Распределить вещества по классам неорганических соединений: А) кислоты Б) основания В) соли Г) оксиды. и дайте им названия: Cu2O, KNO3, Na2Si03, Н3РО4, A12(S04)3, H2SO4 , K2S, Mg(OH)2 , SO3, CaCO3, H2SO3, NH4OH , PO3, Zn(OH)2, H2SiO3, AlCl3 , CO2 , H2S ,NaOH , K2O , Fe(OH)3 , H2CO3 , N2O3 , Cu(OH)2 ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Условия выполнения задания 1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время 2. Максимальное время выполнения задания: ____90_______ мин. 3. Вы можете воспользоваться учебником, конспектом лекций Шкала оценки образовательных достижений: Критерии оценки: Выполнение работы более 90% –оценка «5», 70-90% - оценка «4», 50 -70% - оценка «3», Менее 50% - оценка «2». Лабораторная работа №2-3 Приготовление суспензии карбоната кальция в воде. Получение эмульсии моторного масла. Ознакомление со свойствами дисперсных систем. Цель: получить дисперсные системы и исследовать их свойства практически познакомиться со свойствами различных видов дисперсных систем; провести эксперимент, соблюдая правила техники безопасности. Оборудование и реактивы: дистиллированная вода; вещества и растворы: карбонат кальция, масло, раствор глицерина, мука, желатин фарфоровая чашка; пробирки, штатив. Теоретическая часть Чистые вещества в природе встречаются очень редко, чаще всего встречаются смеси. Смеси разных веществ в различных агрегатных состояниях могут образовывать гомогенные(растворы) и гетерогенные(дисперсные ) системы. Дисперсными- называют гетерогенные системы , в которых одно вещество - дисперсная фаза ( их может быть несколько) в виде очень мелких частиц равномерно распределено в объеме другого -дисперсионной среде. Среда и фазы находятся в разных агрегатных состояниях – твердом, жидком и газообразном. По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делятся 2 группы : Грубодисперсные (взвеси) с размерами частиц более 100 нм. Это непрозрачные системы, в которых фаза и среда легко разделяются отстаиванием или фильтрованием. Это- эмульсии , суспензии , аэрозоли. Тонкодисперсные- с размерами частиц от 100 до 1 нм . Фаза и среда в таких системах отстаиванием разделяются с трудом. Это : золи (коллоидные растворы- "клееподобные" ) и гели (студни). Коллоидные системы прозрачны и внешне похожи на истинные растворы, но отличаются от последних по образующейся “светящейся дорожке” – конусу при пропускании через них луча света. Это явление называютэффектом Тиндаля. При определенных условиях в коллоидном растворе может начаться процесс коагуляции. 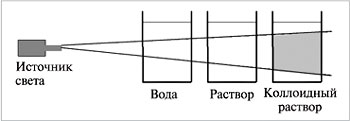 ^ Коагуляция – явление слипания коллоидных частиц и выпадения их в осадок . При этом коллоидный раствор превращается в суспензию или гель. Гели или студни представляют собой студенистые осадки, образующиеся при коагуляции золей. Со временем структура гелей нарушается (отслаивается) – из них выделяется вода. Это явление синерезиса Различают 8 типов дисперсных систем.(д/с + д/ф) Г+Ж→аэрозоль (туман, облака, карбюраторная смесь бензина с воздухом в ДВС Г+ТВ→аэрозоль(дым, смог, пыль в воздухе) Ж+Г→пена (газированные напитки, взбитые сливки) Ж+Ж→эмульсия (молоко, майонез, плазма крови, лимфа, цитоплазма) Ж+ТВ→золь, суспензия (речной и морской ил, строительные растворы, пасты) ТВ+Г→твердая пена(керамика, пенопласт, поролон, полиуретан, пористый шоколад) ТВ+Ж→гель(желе, желатин, косметические и медицинские мази, помада) ТВ+ТВ→твердый золь (горные породы, цветные стекла) Ход работы Опыт Результат Опыт №1 Приготовление суспензии карбоната кальция в воде. В стеклянную пробирку влить 4-5мл воды и всыпать 1-2 ложечки карбоната кальция. Пробирку закрыть резиновой пробкой и встряхнуть несколько раз. Наблюдения: *Внешний вид и видимость частиц:_____________________________ ____________________________________ ____________________________________ *Способность осаждаться и способность к коагуляции ___________ ____________________________________ ____________________________________ Опыт №2 Приготовление эмульсии масла в воде и изучение ее свойств В стеклянную пробирку влить 4-5мл воды и 1-2 мл масла, закрыть резиновой пробкой и встряхнуть несколько раз. Изучить свойства эмульсии. Добавить 2-3 капли глицерина. Наблюдения: *Внешний вид и видимость частиц: _________________________________ _________________________________ _________________________________ *Способность осаждаться и способность к коагуляции _________________________________ _________________________________ _________________________________ *Внешний вид после добавления глицерина _______________________ ________________________________ ________________________________ Опыт №3 Приготовление коллоидного раствора и изучение его свойств В стеклянный стакан с горячей водой внести 1-2 ложечки муки (или желатина), тщательно перемешать. Пропустить через раствор луч света фонарика на фоне темной бумаги Наблюдения: *Внешний вид и видимость частиц _________________________________ _________________________________ _________________________________ *Способность осаждаться и способность к коагуляции__________ _________________________________ _________________________________ _________________________________ *Наблюдается ли эффект Тиндаля _________________________________ _________________________________ _________________________________ Общий вывод:_________________________________________________________________ _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Условия выполнения задания 1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время 2. Максимальное время выполнения задания: ____90_______ мин. 3. Вы можете воспользоваться учебником, конспектом лекций Шкала оценки образовательных достижений: |
