гуов. химияя. Закон сохранения массы веществ ( М. В. Ломоносов 1756 г.)
 Скачать 0.8 Mb. Скачать 0.8 Mb.
|
|
1. Основные законы химии. 1) Закон сохранения массы веществ ( М.В. Ломоносов; 1756 г.): масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции. 2) Закон постоянства состава. • любое сложное вещество независимо от способа его получения имеет постоянный качественный и количественный состав; 3) Закон кратных отношений (Дальтон, 1803 г.): если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие целые числа. Закон свидетельствовал о том, что элементы входят в состав соединений лишь определенными порциями, подтвердил атомистические представления. Наименьшее количество элемента, вступающее в соединение, - это атом. Следовательно, в соединение может вступать только целое число атомов, а не дробное. Например, массовые соотношения С:О в оксидах СО2и СО равны 12:32 и 12:16. Следовательно, массовое отношение кислорода, связанное с постоянной массой углерода в СО2и СО, равно 2:1. 4) Закон объемных отношений (закон Гей-Люссака): объемы вступающих в реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов реакции как небольшие целые числа. 5) Закон Авогадро (1811 г.): в равных объемах любых газов, взятых при одной и той же температуре и при одинаковом давлении, содержится одно и то же число молекул. Постоянная Авогадро NA = 6,02*1023 моль-1 – число структурных единиц в одном моле вещества. 6) Уравнение состояния идеального газа – Менделеева-Клапейрона: PV=mRT/M, где Р – давление газа, Па; V – объем газа, м3; m – масса вещества, г; М – его молярная масса, г/моль; Т – абсолютная температура, К; R – универсальная газовая постоянная, равная 8,314 Дж/моль*К. 7) Закон парциальных давлений (закон Дальтона): Давление смеси газов, химически не взаимодействующих друг с другом, равно сумме составляющих давлений газов, составляющих смесь. 8) Закон эквивалентов. Имеет несколько формулировок: 1. массы участвующих в реакции веществ пропорциональны их молярным массам эквивалента: m1 / m2 = M Э1/ M Э2 = …; 2. все вещества реагируют между собой в эквивалентных количествах, т.е. количества молей эквивалента веществ, участвующих в реакции, равны между собой: νэ1=νэ2= …; m1 / M Э1= m2 / M Э2=… .. 3. для реагирующих веществ, находящихся в растворе, закон эквивалентов записывают следующим образом: СЭ1*V1=CЭ2*V2, где СЭ1, СЭ2 – нормальные концентрации или молярные концентрации эквивалента первого и второго растворов, моль/л; V1 и V2 – объемы реагирующих растворов, л. 2. Закон эквивалентов, моль эквиваленты и моль-эквивалентные массы и объемы веществ различных классов химических соединений. Массы элементов, соединяющихся друг с другом, пропорциональны их эквивалентам: где mA, mВ – массы взаимодействующих веществ А и В; ЭА и ЭВ – эквиваленты этих веществ. Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях ионного обмена равноценна одному атому или одному иону водорода, а в окислительно-восстановительных реакциях одному электрону. Массу одного моля эквивалента элемента называют молярной массой эквивалента MЭ(X). Значение эквивалента веществ зависит от того, в какой конкретной реакции участвует это вещество. Молярная масса эквивалента химического элемента (MЭ(X)), а также простых или сложных веществ рассчитывается по формуле где M(X) – молярная масса; вал – суммарная валентность. Для простых веществ суммарная валентность определяется произведением валентности атома химического элемента и числа атомов. Так, молярная масса эквивалента алюминия составляет MЭ(AI) = 27/3 = 9г моль-1. Молярные массы эквивалента кислорода и водорода следует запомнить, они равны соответственно MЭ(О) = 16/2=8г моль-1, МЭ(Н) = 1/1 = 1 г моль-1. Молярные массы эквивалента сложных веществ вычисляются по их химическим формулам с учетом происходящих химических реакций. К сложным веществам относятся оксиды, гидроксиды, соли. Суммарная валентность оксидов равна произведению валентности кислорода (2) на количество атомов кислорода в молекуле. Суммарная валентность гидроксидов определяется их кислотностью, которая равняется числу замещенных гидроксильных групп. Суммарная валентность кислот равняется основности данных соединений, которая определятся числом замещенных атомов водорода. Суммарная валентность соли равняется произведению валентности катиона и количества катионов в молекуле, или валентности аниона и количества анионов в молекуле. Молярная масса эквивалентов сложных веществ может быть определена как сумма молярных масс эквивалентов элементов или условных частиц, образующих данное вещество. Мэ (оксиды) = Мэ (О) + Мэ (элемента) = 8 + Мэ (элемента), т.к. Мэ кислорода величина постоянная, равна 8г моль-1. Мэ (кислота) = Мэ (Н) + Мэ (кислотного остатка) = 1 + Мэ (кислотного остатка), т.к. Мэ водорода величина постоянная, 1г моль-1 Мэ (гидроксиды) = Мэ (OH-) + Мэ (металла) = 17 + Мэ (металла), т.к. Мэ “OH” групп величина постоянная, равна 17г моль-1. Мэ (соли) = Мэ (катиона) + Мэ (кислотного остатка). 3. Химическая термодинамика, стандартные условия. Термодинамика – это наука, изучающая явления, которые сопровождаются взаимными превращениями теплоты и работы. Термодинамика является макроскопической теорией. Химическая термодинамики использует термодинамические методы для решения задач химии, например, исследования теории разных видов химических и фазовых равновесий и свойств веществ в растворах. Химическая термодинамика – это наука которая применяет общие термодинамические соотношения к явлениям, в которых процессы обмена энергией сопровождаются изменениями химического состава вступающих в химическую реакцию тел. Основной физической величиной, которая подлежит рассмотрению в термодинамике, является энергия. Основным законом термодинамики является вариация закона сохранения энергии. Спецификой макроскопических систем, рассматриваемых в термодинамике, является то, нельзя провести непосредственное измерение энергии макроскопической системы. Разные методы в физике дают возможность определить изменение энергии отдельных частиц системы (атомов, молекул, ионов). Не существует способов прямого измерения энергии как единого целого. Изменение энергии макросистемы определяют как теплоту или работу. Существование внутренней энергии макросистемы (U), как физической величины было установлено в середине XIX века, после открытия первого начала термодинамики. Позднее появилась необходимость применять и другие, не измеряемые величины такие как: энтропия, энтальпия, химический потенциал и т.п. Каждая подобная величина определена как функция измеряемых величин, поэтому все выводы термодинамики можно проверить экспериментально. Для описания свойств систем в термодинамике используют термодинамические переменные, которые называют термодинамическими параметрами. Термодинамические параметры — это физические величины, используя которые описывают явления, которые связаны с превращениями теплоты и работы. Термодинамические параметры являются макроскопическими величинами, отражающими свойства больших совокупностей молекул. На основе первого начала термодинамики составляют уравнения теплового баланса. Второе и третье начала термодинамики служат для анализа фазового и химического равновесия. Основные законы химической термодинамики Первый закон термодинамики, которой отображает обмен энергией между системой и окружающей средой в форме работы и теплоты. Это одни из видов законов сохранения энергии. Формулировок первого начала термодинамики несколько, запишем один из них для закрытой системы:   Q=A+(U2-U1) Q=A+(U2-U1)где Q – количество теплоты, подведенное к системе;  – работа системы; – работа системы;  – изменение внутренней энергии системы. – изменение внутренней энергии системы.Энтальпией (H) называют термодинамическую функцию, которая характеризует энергетическое состояние системы в изобарно — изотермических условиях (P=const T=const). Энтальпия отражает тепловые изменения в системе, а теплота в окружающей среде. Количество теплоты, которое поглощается или выделяется в ходе химической реакции при P=const T=const равно изменению энтальпии системы (энтальпия реакции). Закон Гесса для химических реакций говорит о том, что: величина теплового эффекта изобарных или изохорных процессов зависит только от начального и конечного состояний системы и не зависит от хода процесса. Закон Гесса применяют для вычисления тепловых эффектов химических реакций. 4. Термодинамические функции и их физический смысл. Понятия энтальпии, энтропии и энергии Гиббса веществ и процессов, информационные значения и особенности применения. Функции состояния термодинамической системы ― внутренняя энергия (U), энтальпия (H), энтропия (S), энергия Гиббса (G). Энергия (E) ― количественная мера интенсивности различных форм взаимо- действия и перемещения частиц в термодинамической системе (кДж/моль). - Для описания энергетического состояния термодинамической системы используется одна из функций состояния ― внутренняя энергия (U, кДж/моль). Первое начало термодинамики ― энергия не создается и не уничтожается, а только превращается из одного вида в другой в эквивалентных количествах (закон сохранения и превращения энергии). В изолированной системе внутренняя энергия (U) постоянна, т.е. ∆U = 0. -Энтальпия (H) ― функция состояния термодинамической системы, изменение которой (изменение теплосодержания∆H) представляет собой тепловой эффект процесса (Qp), протекающего при постоянном давлении (p = const, изобарный процесс). ∆H = Qp ∆fH0298 (вещество, состояние), ∆rH0298 (вещество, состояние), ∆сH0298 (вещество, состояние), кДж/моль (f ― formation, r ― reaction, c ― combustion; г ― газ, ж ― жидкость, т ― твердое вещество). ∆rH < O ― экзотермический процесс; ∆rH > O ― эндотермический процесс - Энтропия (S) ― функция состояния термодинамической системы, характеризующая степень (меру) упорядоченности частиц в системе. Увеличение энтропии (∆S > O, Дж/моль·K) увеличивает неупорядоченность расположения частиц. Любая система стремится к переходу в наиболее вероятное состояние (т.е к увеличению беспорядка). S(газ) > S(ж) > S(тв) Возможность самопроизвольного протекания процесса в изолированных системах определяется изменением энтропии (∆S), а в закрытых и открытых (неизолированных) системах― изменением энергии Гиббса (∆G). Второе начало термодинамики для изолированных систем ― самопроизвольномогут совершаться только необратимые процессы, для которых энтропия системы (S) возрастает, т.е. ∆S > O. Для неизолированных систем нужно учитывать также изменение энергии. -Энергия Гиббса (G) ― обобщенная функция состояния термодинамической системы, учитывающая (а) изменение энергетики и (б) неупорядоченности системы при постоянном давлении и температуре (p, T = const, изобарно-изотермический процесс). ∆G = ∆H ─ T∆S ∆G0 = ∆H0 ─ T∆S0 ∆fG0298 (в-во, состояние), ∆rG0298 (в-во, состояние), ∆сG0298 (в-во, состояние) ∆rG < O ― экзэргоническая реакция;∆rG > O ― эндэргоническая реакция; ∆rG = 0 ― химическое равновесие. Критерий возможности протекания процесса в неизолированных системах: ∆G < O. Для стандартных физиологических условий (pH = 7, T = 310 K) ∆G0’310 8 Второе начало термодинамики для неизолированных систем ― самопроизвольномогут совершаться процессы, для которых при постоянной температуре и давлении энергия Гиббса системы (G) 5. Самопроизвольные процессы и возможность их термодинамической оценки. Самопроизвольно могут протекать только те процессы, которые приводят к понижению свободной энергии системы; система приходит в состояние равновесия, когда свободная энергия достигает минимального значения. Поведение всякой термодинамической системы в общем случае определяется одновременным действием двух факторов – энтальпийного, отражающего стремление системы к минимуму тепловой энергии, и энтропийного, отражающего противоположную тенденцию – стремление системы к максимальной неупорядоченности. 6. Скорость химических реакций и зависимости скорости от разных факторов. Химические реакции протекают с различными скоростями: с малой скоростью — при образовании сталактитов и сталагмитов, со средней скоростью — при варке пищи, мгновенно — при взрыве. Очень быстро проходят реакции в водных растворах, практически мгновенно. Под скоростью химической реакции понимается изменение количеств реагирующих веществ (или продуктов реакции) в единицу времени. Скорость химической реакции зависит от многих факторов. Основными из них являются: природа и концентрация реагирующих веществ, давление (в реакциях с участием газов), температура, действие катализаторов и поверхность реагирующих веществ в случае гетерогенных реакций. 7. Закон действия масс. Закон действующих масс – скорость химической реакции пропорциональна произведению концентраций реагирующих веществ. Для одностадийной гомогенной реакции типа aА + bВ → продукты реакции этот закон выражается уравнением: 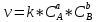 , где v – скорость химической реакции, C – концентрации веществ (моль/л), k – коэффициент пропорциональности, называемый константой скорости реакции. Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1 моль/л или их произведение равно единице. Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации. , где v – скорость химической реакции, C – концентрации веществ (моль/л), k – коэффициент пропорциональности, называемый константой скорости реакции. Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1 моль/л или их произведение равно единице. Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации. 8. Обратимые и необратимые процессы, химическое равновесие и условие равновесия. Обратимая реакция — химическая реакция, которая при одних и тех же условиях может идти в прямом и в обратном направлениях. Необратимой называется реакция, которая идет практически до конца в одном направлении. Условия необратимости реакции – образование осадка, газа или слабого электролита. Химическое равновесие — состояние системы, в котором скорость прямой реакции равна скорости обратной реакции. Условием равновесия системы с химической реакцией является равенство полных химических потенциалов исходных веществ и продуктов 9. Константа скорости и константа равновесия Константа скорость реакции – это скорость реакции при C=1 моль/л она зависит от: • Природы реагирующих в-в. • От температуры. • От присутствия в системе катализаторов. Константа скорость реакции не зависит от концентрации реагирующих в-в. Количественной характеристикой химического равновесия является константа химического равновесия. Отношение констант скорости прямой и обратной реакции называется константой равновесия данной химической реакции: К=К1/К2. 10. Зависимость константы равновесия от температуры. Чем больше по абсолютной величине тепловой эффект химической реакции, тем сильнее влияет температура на величину константы равновесия. Если реакция не сопровождается тепловым эффектом, то константа равновесия не зависит от температуры. 11. Принцип Ле-Шателье. Влияние разных факторов на состояние равновесия. Сдвиги равновесия. Принцип Ле Шателье — Брауна Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1885 году французским ученым Ле-Шателье. Факторы влияющие на химическое равновесие: 1) температура При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции. 2) давление При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся. 3) концентрация исходных веществ и продуктов реакции При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при понижении концентрации продуктов реакции-в сторону исходных веществ. 12. Особенности химического равновесия для гомогенных и гетерогенных систем. При некоторой температуре энтальпийный и энтропийный факторы уравниваются, две противоположные тенденции уравновешивают друг друга, т.е. Н = ТS. В этом случае соблюдается уравнение G = 0, которое является термодинамическим условием химического равновесия. Химические реакции, протекающие на границе раздела фаз, называются гетерогенными химическими реакциями. Если скорости прямой и обратной гетерогенных реакций становятся одинаковыми, то наступает химическое равновесие в гетерогенной системе, называемое гетерогенным химическим равновесием. Условием этого равновесия является равенство энергии Гиббса реакции нулю, т.е. G = 0. 13. Квантовые числа и их физический смысл. Квантовое число- называют допустимые уровни энергии электорона определяется значением целого числа(n) Главное квантовое число n характеризует энергию электронной орбитали. Главное квантовое число принимает значения 1, 2, 3, 4, 5, 6, 7∞, обозначаемые также буквами K, L, M, N , O, P, Q. Главное квантовое число характеризует также удаленность максимума электронной плотности от ядра. Орбитальное квантовое число l принимает значения от 0 до (n-1) и характеризует форму граничной поверхности атомной орбитали. Обозначения: 0-s; 1-p; 2-d; 3-f и т.д. Орбитальное квантовое число характеризует также энергию электронов подуровня в пределах данного энергетического уровня. Магнитное квантовое число m характеризует ориентацию орбитали в пространстве и может принимать значения от +l до –l, Спиновое квантовое число С характеризует собственное вращение электрона вокруг своей оси и может принимать два значения - +1/2 и -1/2. Характеризуют положение электронов в атоме, их атомные орбитали: удаленность от ядра, энергию электрона, форму орбиталей, пространственную ориентацию орбиталей, веретенообразное вращение электрона вокруг собственной оси - "спин". Принцип Паули(на всякий случай)- с помощью него можно посчитать какое макс. число электоронов может находиться на различных энерг. уровнях и подуровнях в атоме. 14. Электронные семейства и электронные аналоги. В зависимости от того, какой подуровень последним заполняется электронами, все элементы делятся на четыре типа – электронные семейства: s – элементы; заполняется электронами s – подуровень внешнего уровня. К ним относятся первые два элемента каждого периода. p – элементы; заполняется электронами р – подуровень внешнего уровня. Это последние шесть элементов каждого периода (кроме I и VII). d – элементы; заполняется электронами d – подуровень второго снаружи уровня, а на внешнем уровне – один или два электрона. f – элементы; заполняется электронами f – подуровень третьего снаружи уровня, а на внешнем уровне остается два электрона. Они расположены в 6м и 7м периодах периодической системы. В периодической системе s – элементов 14, p – элементов 30, d – элементов 38, f – элементов 28. Атомы элементов с одинаковым заполнением внешнего энерг. уровня носит название электронных аналогов.Например: Элементы с одинаковым строением внешнего и предвнешнего энерг. уровней называют полными. Например : 15. Принципы заполнения электронами энергетических уровней и подуровней Электронные оболочки заполняются по принципу возрастания энергии системы. Сначала заполняется уровень, расположенный ближе всего к ядру, а затем остальные, в порядке увеличения расстояния от него. Порядок заполнения электронами орбиталей атома определяется тремя законами природы: Принцип наименьшей энергии- электроны заполняют орбитали в порядке возрастания энергии орбиталей.1S, 2S,2P,3S,3P,4S… Принцип Пауля- на одной орбитали не может быть больше двух электронов Принцип Хунда- в пределах подуровня электроны сначала заполняют свободные орбитали (по одному), и после этого образуют электронные пары. Первый уровень состоит из одной s-орбитали, а остальные из s-, p-, d- и f-подуровней, которые имеют 1, 3, 5 и 7 орбиталей. На каждой из них может находиться максимум 2 электрона. Таким образом, они могут содержать не более 2, 6, 10 и 14 электронов соответственно. 16. Взаимосвязь химических свойств с энергетическими характеристиками электронов наружного уровня. Химические свойства атомов определяются в основном свойствами электронов, находящихся на внешнем энергетическом уровне. Именно эти электроны участвуют в химических реакциях. Важнейшие энергетические характеристики атомов следующие: • удержание принадлежащих атому электронов — энергия ионизации; • присоединение новых электронов — сродство к электрону; • способность к поляризации химической связи — электроотрицательность. Поляризация в химии — это пространственное разделение электрических зарядов разного знака в рамках единой структурной единицы: атома, молекулы, иона. Энергия ионизации Е, — минимальная энергия, которую необходимо затратить для того, чтобы оторвать от свободного атома, находящегося в основном состоянии, один электрон с образованием положительного иона (катиона). Чем меньше эта энергия, тем легче атом окисляется, соответственно, тем лучшим восстановителем он является. Сродство к электрону ЕА — минимальная энергия, которая выделяется или затрачивается при присоединении электрона к свободному атому, находящемуся в основном состоянии, с образованием отрицательного иона (аниона). В отличие от отрыва электрона, всегда требующего затраты (поглощения) энергии, присоединение электрона может сопровождаться как выделением (положительное сродство), так и поглощением (отрицательное сродство) энергии. При положительном сродстве к электрону атом может быть окислителем. Электроотрицательность х (греч. буква «хи») — способность данного атома смещать в направлении своего ядра электронные орбитали, участвующие в образовании ковалентной химической связи. Данный атом при этом приобретает в молекуле частичный отрицательный заряд. Электроотрицателыюсть атома химического элемента не является постоянной и меняется в разных соединениях этого элемента. Однако относительные величины электроотрицательностей атомов элементов в любой шкале сохраняются (электроотрицательность фтора всегда больше, чем натрия). Существует несколько шкал электроотрицателыюстей. В качестве примера укажем шкалу электроотрицательности по Малликену:  В ней электроотрицательность принимается как полусумма энергии ионизации и сродства к электрону. Смысл этой шкалы состоит в том, что чем сильнее атом удерживает электрон на внешнем энергетическом уровне (чем больше Е,) и чем больше энергии выделяется при присоединении электрона к атому (чем больше ЕЛ), тем более он способен смещать в сторону своего ядра электроны химической связи. 17. Характеристики s- , р- , d- и f- элементов S-блок в периодической таблице элементов – электронная оболочка, включающая в себя первые 2 слоя s-элементов (водород, гелий, щелочные и щелочноземельные металлы). За исключением гелия – все s-элементы – сильные восстановители P-блок – электронная оболочка атомов, валентные электроны которых с наивысшей энергией занимают p-орбиталь (неметаллы, полуметаллы и металлы). Неметаллы имеют сильную электроотрицательность. Металлы – умеренно активные, их активность повышается к низу таблицы D-блок –электронная оболочка атомов, валентные электроны которых занимают d-орбиталь. Иногда называются переходными металлами F-блок– электронная оболочка атомов, валентные электроны которых с наивысшей энергией занимают f-орбиталь. Элементы, у которых электроны на 4f обритали – лантаноиды, 5f – актиноиды. 18. Процессы электролиза и законы Фарадея, электроды растворимые и инертные; число Фарадея. Электролизом называют процессы, протекающие на электродах под действием электрического тока, подаваемого от внешнего источника тока через электролиты. При электролизе на электродах непрерывно протекают окислительно-восстановительные реакции. На катоде (К(-)) происходит процесс восстановления, на аноде (А(+)) – процесс окисления. Продукты этих реакций или откладываются на электродах, или вступают во вторичные реакции (взаимодействуют между собой, с молекулами растворителя или с веществом электрода), или накапливаются в растворе у электродов. Течение первичных анодных и катодных реакций подчиняется законам Фарадея. |
