гуов. химияя. Закон сохранения массы веществ ( М. В. Ломоносов 1756 г.)
 Скачать 0.8 Mb. Скачать 0.8 Mb.
|
|
Первый закон Фарадея: масса вещества m, выделяемая на электроде электрическим током, пропорциональная количеству электричества Q, прошедшему через электролит: m = kQ, но Q =It (9.16) где I – сила тока, А; t – время пропускание тока, с. m = kIt (9.17) k – коэффициент пропорциональности, равный количеству вещества, выделяемого при прохождении одного кулона (Кл) электричества (электрохимический эквивалент). Второй закон Фарадея: массы различных веществ, выделенных одним и тем же количеством электричества, пропорциональных их химическим эквивалентам (Мэ): Для выделения 1 грамма эквивалента вещества требуется пропустить через электролит одно и тоже количество электричества, равное приблизительно 96500 Кл (число Фарадея). Следовательно: Подставив последнее уравнение в (9.17), получим формулу, объединяющую оба закона Фарадея. 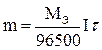 (9.18) (9.18)Соотношение (9.18) используют в расчетах процессов при электролизе. При практическом проведении электролиза всегда некоторая часть электрической энергии затрачивается на побочные процессы. Важной характеристикой рентабельности установки для проведения электролиза (электролизера) является выход по току (h, %): h = 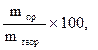 (9.19) (9.19)где mпр – масса фактически выделенного вещества; mтеор – масса вещества, которая должна была выделиться в соответствии с законом Фарадея. На процесс электролиза существенно влияет плотность тока, то есть сила тока, приходящаяся на единицу рабочей поверхности электрода. Постоянная Фарадея F ≈ 96500 Кл 19. Первичные источники (батарейки) и топливные элементы как примеры превращения химической энергии в электрическую. В современных химических источниках тока используются: в качестве восстановителя (материал анода) — свинец Pb, кадмий Cd, цинк Zn и другие металлы; в качестве окислителя (материал катода) — оксид свинца(IV) PbO2, гидроксооксид никеля NiOOH, оксид марганца(IV) MnO2 и другие; в качестве электролита — растворы щелочей, кислот или солей[2]. Топливные элементы К топливам, которые можно использовать для подобных элементов, относятся наряду с природными видами топлива такими, как уголь и углеводороды, также и вещества, которые могут быть из них получены простым путем: спирты, альдегиды, окись углерода и водород. 20. Окислительно-восстановительные процессы при реакции металлов с водой, водными растворами кислот и щелочей. Окислителем в воде является ион Н+. Окислительные свойства системы 2H+ + 2e или 2H2O + 2e зависят в соответствии с уравнением Нернста от рН раствора (для Т=298К и В нейтральной водной среде рН=7 и т.е. стоящими в ряду стандартных окислительно-восстановительных потенциалов металлов левее Cd. Однако большинство из них покрыты защитными оксидными пленками, нерастворимыми в воде, которые и «пассивируют» металлы. Поэтому активно взаимодействуют с водой только щелочные (IA группа) и щелочно-земельные металлы. Продуктами реакции являются молекулярный водород и растворимые гидроксиды металлов. 2Me + 2nH2O → 2Me(OH)n + nH2 Me: Li, Na, K, Rb, Cs, Fr (IA – подгруппа) Ca, Sr, Ba, Ra (IIA – подгруппа) Взаимодействие металлов с водными растворами щелочей С водными растворами щелочей взаимодействуют металлы, оксиды и гидроксиды которых растворимы в щелочах, и выполняется условие протекания окислительно-восстановительных реакции К ним относятся «амфотерные» металлы : Be, Al, Ga, Sn, Pb, Zn. Продуктами реакции являются молекулярный водород и гидроксокомплексы 2Me + 2nH2O + (8–2n)OH- → 2[Me(OH)4]n-4 + nH2 Например: Zn + 2H2O + 2NaOH → Na2[Zn(OH)4] + H2 21. Титриметрические и весовой методы количественного анализа. Титриметрический (весовой) анализ - метод количественного анализа, основанный на точном измерении объема реагента Т, затраченного на реакцию с определяемым веществом Х. Другими словами, это процесс, основанный на титровании. Титрование - процесс определения вещества Х постепенным прибавлением небольших количеств вещества Т до момента, когда все вещество Х прореагировало. 22. Дисперсные системы. Классификация систем по разным признакам. Дисперсными называют системы, состоящие из множества малых частиц, распределенных в жидкой, твердой или газообразной среде. 1) грубо-дисперсные (грубые взвеси, суспензии, эмульсии, порошки) с радиусом частиц 10-4 - 10-7 м; 2) коллоидно-дисперсные (золи) с размером частиц 10-7 - 10-9 м; 3) молекулярные и ионные растворы с размером частиц менее 10-9 м.  23. Коллоидная химия и наносистемы в современной промышленности. Первыми объектами изучения коллоидной химии являлись клееподобные вещества – желатин, пектин, казеин и другие высокомолекулярные соединен. В коллоидной химии изучаются дисперсные системы, в которых частиц дисперсной фазы имеют размер 10-9 - 10-7 м (1-100 нм). Это коллоидные системы. Дисперсные системы с одинаковыми по размеру частицами называются монодисперсными, с различными по размеру частицами – полидисперсными. 24. Строение частиц дисперсной фазы; мицеллы; агрегативная и кинетическая устойчивости дисперсных систем. Дисперсной системой называется гетерогенная система, в которой одна из фаз представлена мелкими частицами, равномерно распределенными в объеме другой однородной фазы.Всяка дисперсная система состоит из дисперсной фазы идисперсионной среды. Дисперсионную фазу составляет мелкораздробленные частицы, равномерно распределенные в дисперсной системе. Дисперсионную среду составляет однородная непрерывная фаза, в которой распределены частицы дисперсной фазы. Мицеллой лиофобной системы называется гетерогенная микросистема, которая состоит из микрокристалла дисперсной фазы, окруженного сольватированными ионами стабилизатора. Мицеллы — частицы в коллоидных системах, состоящие из нерастворимого в данной среде ядра очень малого размера, окружённого стабилизирующей оболочкой адсорбированных ионов и молекул растворителя.  25. Водные растворы; способы выражения концентрации растворов. Водный раствор — разновидность раствора, в котором растворителем служит вода Способы выражения: Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе раствора. Для бинарного раствора, состоящего из растворённого вещества и растворителя  Молярная концентрация или молярность – это количество молей растворённого вещества в одном литре раствора V  Титр – содержание вещества в граммах в 1 мл раствора  Мольная доля растворённого вещества – безразмерная величина, равная отношению количества растворенного вещества n к общему количеству веществ в растворе  Объёмная доляφ компонента раствора определяется как отношение объёма данного компонента Х к общему объёму раствора V. Объёмная доля – безразмерная величина, её выражают в долях от единицы:  26. Растворы электролитов и неэлектролитов. Физические свойства растворов. Вещества, распадающиеся в растворах или расплавах на ионы, а поэтому проводящие электрический ток, называют электролитами. Вещества, которые в тех же условиях на ионы не распадаются и не проводят электрический ток, называют неэлектролитами. К электролитам относятся кислоты, основания и соли, к неэлектролитам — большинство органических соединений. Коллигативные свойства растворов электролитов: Главное свойство электролитов — способность к электролитической диссоциации, то есть к распаду молекул при взаимодействии с молекулами воды (или других растворителей) на заряженные ионы. Коллигативные свойства растворов неэлектролитов: относительное понижение давления насыщенного пара растворителя над раствором (I закон Рауля); понижение температуры замерзания (II закон Рауля); повышение температуры кипения (II закон Рауля); осмотическое давление раствора (закон Вант-Гоффа). 27 Количественные характеристики растворов, информирующие об их свойствах. Количественные характеристики растворов: 1) массовая доля растворённого вещества, которая равна отношению массы растворённого вещества к массе раствора; 2) молярная концентрация, показывающая число молей растворённого вещества в 1 литре раствора. 28.Сильные и слабые электролиты, константы диссоциации электролитов и их ин формационные значения. Слабые электролиты в водном растворе диссоциируют частично, т.к. их диссоциация является обратимым равновесным процессом, что и отражается знаком обратимости в уравнениях диссоциации Сильные электролиты в водных растворах полностью диссоциируют на ионы. Их диссоциация происходит необратимо: К слабым электролитам относятся: 1. Слабые кислоты: H2CO3, H2S, H3BO3, HCN, HNO2, H3PO4, H2SO3, H2SiO3 и большинство органических кислот. 2. Слабые основания и амфотерные гидроксиды металлов: Be(OH)2, Mg(OH)2, Fe(OH)2,Zn(OH)2, гидроксид аммония NH4OH, а также органические основания – амины (CH3NH2 ) и амфолиты (H3N+CH2COO-) . 3. Очень слабым электролитом является вода, a = 2 ∙10-9. к водным растворам сильными электролитами являются: 1. Сильные кислоты: HCl, HBr, HY, H2SO4, HNO3, HСlO4, HMnO4 2. Сильные основания (щелочи): гидроксиды щелочных (группа IA) и щелочноземельных металлов (г руппа IIA периодической системы, кроме гидроксидов Be(OH)2, Mg(OH)2). 3. Большинство растворимых солей(исключения: Fe (SCN)3, Mg(CN)2, HgCI2, Hg(CN)2 и др.) 29. Ионное произведение воды, рН и информационные значения этой величины. Вода является практически незаменимым растворителем в экспериментальной и прикладной химии, поэтому необходимо изучение ее свойств. Остановимся на таких понятиях как ионное произведение воды и водородный показатель pH. При определенных условиях, вода может вести себя как акцептор протонов (в присутствии кислоты) или как донор протонов (в присутствии основания). Интересной особенностью воды является то, что она может подвергаться процессу самодиссоциации (автоионизации), т.е. быть одновременно и донором и акцептором протонов по отношению к самой себе. 2H2O ↔ H3O+ + OH— Эта реакция – самопроизвольная диссоциация, осуществляется в небольшой степени. Ее можно упростить, если H3O+ заменить на H+ H2O ↔ H+ + OH— Запишем выражение для константы равновесия, опираясь на закон действия масс: K = [H+]·[OH—]/[H2O] Концентрацию воды, принято исключать из данного выражения, вследствие ее практически постоянного значения в разбавленных растворах. Получаем новую константу равновесия KН2О, которая называется ионным произведением воды: KН2О = [H+]·[OH—] При температуре 25ºС ионное произведение воды KН2О = 1·10-14 и остается постоянным в водных растворах кислот, щелочей, солей или других соединений. KН2О = [H+]·[OH—] = 1·10-14 При повышении температуры ионное произведение воды сильно возрастает. Полученное выражение применимо не только к чистой воде, но и к растворам. Если осуществляется условие [H+] = [OH—], то раствор называется нейтральным, но обычно эти величины не совпадают, тогда при увеличении одного показателя, другой должен уменьшаться, так, чтобы их произведение оставалось постоянным (1·10-14) Водородный показатель pH — это отрицательный логарифм концентрации ионов водорода. Для определения характера среды раствора существует много методов, самый простой из них – применение индикаторов. 30. Амфотерные электролиты и особенности их химического поведения. Амфотерность электролиты — способность некоторых соединений проявлять как кислотные, так и основные свойства. К амфотерным относятся две группы веществ: 1. вещества, у которых и кислотные, и основные свойства определяются одной и той же функциональной группой – ОН. К таким веществам можно отнести Zn(OH)2, Al(OH)3: 2. вещества, у которых кислотные и основные свойства определяются наличием разных функциональных групп. К таким вещества относятся аминокислоты типа NH2RCOOH. В водных растворах жирные аминокислоты полностью или частично переходят в форму: NH3+RCOO- - это ион, несущий одновременно и положительный и отрицательный заряд. Такие ионы называют амфиионы или внутренние соли или цвиттерионы. В биохимии при исследовании белков необходимы условия, когда концентрации положительных и отрицательных ионов одинаковы. Для этого измеряют pH раствора аминокислоты, добавляя либо кислоту, либо основание, что позволит добавлять I или II ступень диссоциации. Значение pH раствора амфолита (аминокислоты) становится таким, что в растворе образуется одинаковое количество положительных и отрицательных ионов. 31.Химическая реакция веществ с водой; гидролиз солей. . 1. Вода реагирует с металлами и неметаллами. 1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода: 2Na + 2H2O → 2NaOH + H2 с магнием реагирует при кипячении: Mg + 2H2O → Mg(OH)2 + H2 алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид: 2Al + 6H2O = 2Al(OH)3 +3H2 металлы, расположенные в ряду активности от Al до Н, реагируют с водяным паром при высокой температуре, образуя оксиды и водород: Fe + 4Н2O → Fe3O4 + 4Н2 металлы, расположенные в ряду активности от после Н, не реагируют с водой: Ag + Н2O ≠ 2. Вода реагирует с оксидами щелочных и щелочноземельных металлов, образуя щелочи (с оксидом магния – при кипячении): Н2O + СаО = Са(OH)2 3. Вода взаимодействует с кислотными оксидами (кроме SiO2): P2O5 + 3H2O = 2H3PO4 4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком: Например, сульфид алюминия разлагается водой: |
