гуов. химияя. Закон сохранения массы веществ ( М. В. Ломоносов 1756 г.)
 Скачать 0.8 Mb. Скачать 0.8 Mb.
|
|
Al2S3 + 6H2O → 2Al(OH)3 + 3H2S 5. Бинарные соединения металлов и неметаллов, которые не являются кислотами и основаниями, разлагаются водой. Например, фосфид кальция разлагается водой: Са3Р2 + 6Н2О → 3Са(ОН)2 + 2РН3↑ 6. Бинарные соединения неметаллов также гидролизуются водой. Например, фосфид хлора (V) разлагается водой: PCl5 + 4H2O → H3PO4 + 5HCl 6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.). Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах растворимых солей. Движущей силой процесса является взаимодействие ионов вещества с водой, приводящее к образованию слабого электролита в ионном или молекулярном виде. Различают обратимый и необратимый гидролиз солей[3][4]: 1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону). Раствор имеет слабощелочную среду, реакция протекает обратимо. {\displaystyle {\mathsf {Na_{2}CO_{3}+H_{2}O\rightleftharpoons NaHCO_{3}+NaOH}}}  {\displaystyle {\mathsf {CO_{3}^{2-}+H_{2}O\rightleftharpoons HCO_{3}^{-}+OH^{-}}}}  Гидролиз по второй ступени протекает в ничтожной степени: {\displaystyle {\mathsf {HCO_{3}^{-}+H_{2}O\rightleftharpoons H_{2}CO_{3}+OH^{-}}}}  2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону). Раствор имеет слабокислую среду, реакция протекает обратимо. {\displaystyle {\mathsf {CuCl_{2}+H_{2}O\rightleftharpoons CuOHCl+HCl}}}  {\displaystyle {\mathsf {Cu^{2+}+H_{2}O\rightleftharpoons CuOH^{+}+H^{+}}}}  Гидролиз по второй ступени протекает в ничтожной степени: {\displaystyle {\mathsf {CuOH^{+}+H_{2}O\rightleftharpoons Cu(OH)_{2}+H^{+}}}}  3. Гидролиз соли слабой кислоты и слабого основания. Равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта образуют осадок или газ: {\displaystyle {\mathsf {Al_{2}S_{3}+6H_{2}O\rightarrow 2Al(OH)_{3}\downarrow +3H_{2}S\uparrow }}}  {\displaystyle {\mathsf {2Al^{3+}+3S^{2-}+6H_{2}O\rightarrow 2Al(OH)_{3}\downarrow +3H_{2}S\uparrow }}}  4. Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален. В растворе протекает следующая реакция: 32. Особенности химического поведения солей разной природы при взаимодействии с водой. Влияние реакции на значение рН. Химическое обменное взаимодействие ионов растворенной соли с составными частями воды, приводящее к образованию слабодиссоциирующих продуктов (кислот, оснований, кислых анионов, основных катионов) и сопровождающееся изменением рН среды, называется гидролизом соли. Из определения следует, что гидролизу подвергаются не все соли: если между ионами соли и составными частями воды связывания не происходит, то это означает отсутствие гидролиза. Пример: 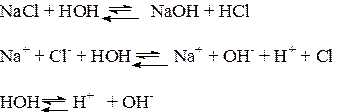 Практически идет обратная реакция - нейтрализация, с образованием слабого электролита Н2О. В этом состоит сходство гидролиза с другими обменными реакциями электролитов - кислот, оснований, солей. Отличия реакций солей с водой от их реакций с кислотами и щелочами связаны с электролитическими особенностями воды. Как кислоты, вода образует при диссоциации Н+ - ионы, как щелочи – ОН- - ионы, но и те и другие присутствуют в чистой воде в очень небольшой концентрации (10-7 моль/л). Поэтому гидролиз ионов соли происходит, во-первых, обратимо, кроме отдельных случаев, во вторых, для многозарядных ионов - ступенчато. При составлении уравнений реакций гидролиза следует помнить, что во избежание распространенной ошибки нельзя использовать более одной молекулы воды на один ион соли: Водоро́дный показа́тель[1] (pH, от лат. pondus Hydrogenii[2] — «вес водорода»; произносится «пэ-аш») — мера определения кислотности водных растворов. Ассоциирована с концентрацией ионов водорода, что эквивалентно активности ионов водорода в сильно разбавленных растворах. Для водных растворов (при стандартных условиях), водородный показатель составляет: pH < 7 соответствует кисло́тному раствору; pH = 7 соответствует нейтра́льному раствору, иногда относят к кислотному; pH > 7 соответствует осно́вному раствору Водородный показатель может быть определён с помощью кислотно-основных индикаторов, измерен потенциометрическим pH-метром или вычислен по формуле как величина, противоположная по знаку и равная по модулю десятичному логарифму активности водородных ионов, выраженной в молях на литр: {\displaystyle {\mbox{pH}}=-\lg \left[{\mbox{H}}^{+}\right]}  Точное измерение и регулирование pH необходимо в различных отраслях химии, биологии, наук о материалах, технологий, медицины и агрономической химии[⇨]. 33. Современные представления о строении атома. Взаимосвязь химических свойств с энергетическими характеристиками электронов наружного уровня. Современная модель атома основана на модели Резерфорда — Бора. Она дополнена представлениями о строении ядра и о свойствах электронов. Согласно современной, квантово-механической модели атом состоит из ядра, образованного протонами и нейтронами, и движущихся вокруг ядра электронов, обладающих свойствами и частицы, и волны. Если проанализировать электронное строение атомов, связывая его с положением химического элемента в Периодической таблице Д.И. Менделеева, то можно сделать следующие выводы: Число электронов на внешнем энергетическом уровне у элементов главных подгрупп равно номеру группы. Химические свойства определяются не всеми электронами, а только теми, которые обладают наибольшей энергией — так называемыми валентными. Число валентных электронов равно номеру группы. Число валентных электронов определяет принадлежность элемента к металлам или неметаллам, свойства образованных этим элементом соединений и его валентность в этих соединениях. Атомы элементов со сходными свойствами имеют сходное строение внешних электронных уровней, например: щелочные металлы содержат на внешнем уровне один электрон, углерод и кремний — четыре, галогены — семь. С увеличением порядкового номера элемента число валентных электронов периодически повторяется, что обусловливает периодическое изменение свойств элементов и их соединений. электрон имеет двойственную природу, обладая свойствами как частицы, так и волны. Область пространства вокруг ядра, где электрон находится с наибольшей вероятностью, называется электронной орбиталью. Электроны в атоме располагаются слоями в соответствии с их энергией, образуя энергетические уровни (электронные слои). Число энергетических уровней в атоме равно номеру периода, в котором находится элемент. Максимальное число электронов, которое может содержаться на электронном уровне, равно:N=2n , где n — номер уровня. Число электронов на внешнем энергетическом уровне у элементов главных подгрупп равно номеру группы. Число валентных электронов равно номеру группы. Атомы элементов со сходными свойствами имеют сходное строение внешних электронных уровней. 34. Периодическая система и таблица элементов Д. И. Менделеева. Взаимосвязи со значениями квантовых чисел. Главное квантовое число определяет размеры электронного облака. В атоме есть электронные слои или оболочки, отвечающие определенным значение главного квантового числа. Для энергетических уровней в атоме соответствующих значениям n’ приняты следующие буквенные обозначения:1-K ;2-L;3-M;4-N;5-O;6-P;7-Q Произвольной не может быть форма электронного облака. Она определяется другим квантовым числом- орбитальное квантовое число L’ ( принимает целые численные значения) L’=n-1 1: 0; 2:0-1; 3:0,1,2 Состояние электрона характеризуется различными значениями L’ принятого показывать энергетическим подуровнем 0-S; 1-p;2-d;3-f При данном значении n наименьшей энергией обладает S, затем p, затем d, затем f электроны. Состояние электрона в атоме отвечающие определённым значением m и L’ записываются следующим образом: сначала цифрой указываются значения n а затем маленькими буквами под уровень. Электронное облако не имеет резко очерченных в пространстве границ из уравнений Шрейденгера следует что и ориентация электронного облака не может быть правильной. Пространственное расположение определяется значением n .Третье n называется магнитное квантовое число (m). Оно может принимать любые целые значения как положительные так и отрицательные . Для s электронов когда L’ = 0 возможно только одно значение m = 0. Для p электрона m = -1; 0 ;+ 1 при L’ = 2 m = -2 ;-1; 0 ;+ 1 ;+ 2 Состояние электрона в атоме характеризующееся определённым значением квантовых чисел то есть определённым размером, формой ,ориентацией электронного облака- атомная электронная орбиталь. Исследования атомных спектров привело к следующему : Электрон характеризуется ещё одним квантовым числом- спином(s), который характеризуется вращением электрона вокруг своей оси Спин электрона имеет 2 значения: +1/2 или -1/2 Таким образом, 4 квантовых числа n,L’,m,s полностью определяют состояние электрона в атоме. 35. Протоны, нейтроны, электроны, порядковый номер в таблице Д. И. Менделеева и заряды ядер, число электронов, периодичность свойств. Протон— элементарная частица, имеющая положительный электрический заряд и входящая в состав ядра каждого атома. Протоны - это частица с положительным зарядом плюс один и относительная массой = 1. Протон обозначается Латинской буквой p+ нейтроны - это электронейтральные незаряженные частицы с относительной массой = 1.Нейтрон обозначается Латинской буквой n0. Заряд ядра = число протонов Электрон -Элементарная частица имеющая наименьший отрицательный заряд. движение электрона в атоме описывается законами квантовой механики . электроны вращаются вокруг ядра со скоростью света, поэтому точную определить нахождение электрона в атоме невозможно ,поэтому используется понятие орбиталь или электронное облако. На каждой орбитали может располагаться не более двух электронов с антипараллельными спинами. Электрон обладает постоянным отрицательным зарядом E = 1, 6 х 10 -19 кулонов Электрон обозначается буква е- масса электронов составляет 9,1 *10-31 кг Порядковый номер показывает число протонов в ядре атома заряд ядра Z атома этого элемента в этом заключается его физический смысл число электронов в атоме равно числу протонов так как атом электронейтрален Сумма протонов Z и нейтронов N в ядре составляет массовое число А = Z + N Порядковый номер элемента совпадает с зарядом ядра Z атома то есть определяет число протонов. Порядковый номер определяет и число электронов N в атоме N = Z Порядковый номер показывает заряд ядра атома Z общее количество электронов в атоме E - количество протонов P + количество нейтронов которое вычисляется разностью относительной атомной массы и порядковым номером Порядковый номер элемента - это заряд ядра его атома заряд ядра численно совпадает с порядковым номером элемента и обозначается буквой Z Ядра с одинаковым Z но различными а называются изотопами. Ядра которые при одинаковом а имеют разные Z называются изобарами Число электронов в атоме равно порядку номеру Z элементов в таблице Менделеева Периодический закон: свойства элементов периодически изменяются потому что периодически возобновляются сходные электронные конфигурации атомов при последовательном возрастании значений главного квантового числа Периодичность свойств химических элементов: заряд ядра, структура внешней электронной оболочки, размеры атома, энергия ионизации, энергия сродства к электрону, электроотрицательность 36. Химическая связь и современные модели химической связи. Химическая связь - Это взаимодействие атомов обуславливающие устойчивость молекулы или кристаллы как целого химическая связь определяется взаимодействием между заряженными частицами основные характеристики химической связи - Это прочность длина полярность устойчивость Современная теория химической связи базируется на трёх основных методах: метод валентных связей описывает химическую связь чисто качественно, трактуя образования её как возникновение общей пары электронов. Метод молекулярных орбиталей описывает химическую связь количественно; базируется на рассмотренных принципах построения электронных орбиталей метод отталкивания электронных пар позволяет получить представление о пространственной конфигурации молекул 37. Модели ковалентной, ионной и металлической химических связей. 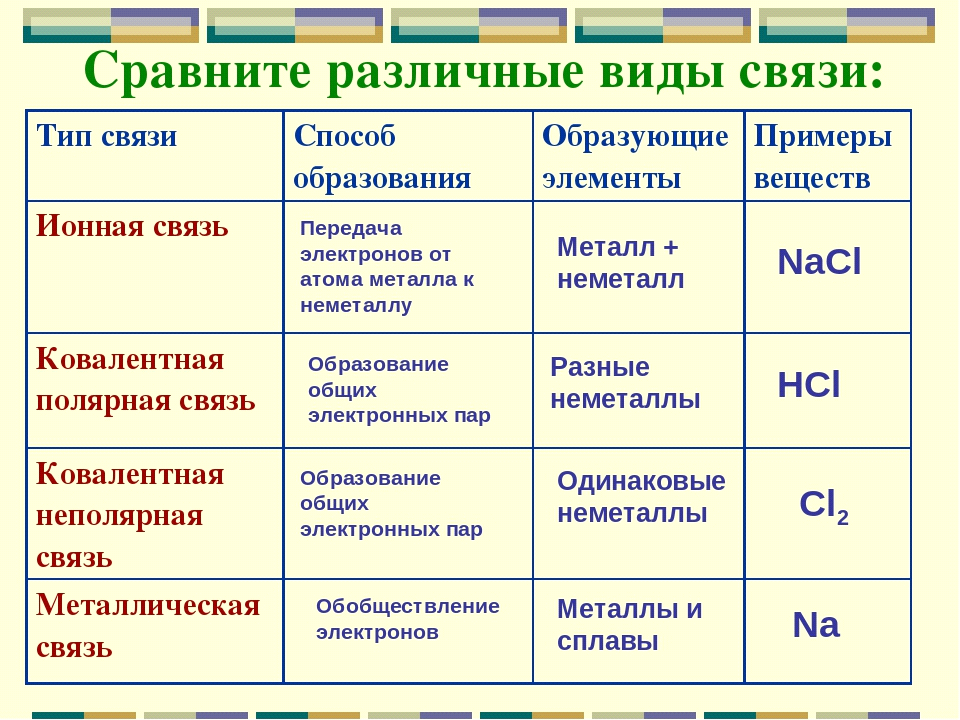 Ионная связь — сильная химическая связь, возникающая в результате электростатического притяжения катионов и анионов. Коавлентная связь- химическая связь, образованная перекрытием (обобществлением) пары валентных (находящихся на внешней оболочке атома) электронных облаков. Металли́ческая связь — химическая связь между атомами в металлическом кристалле, возникающая за счёт перекрытия (обобществления) их валентных электронов. 38. Обменный и донорно-акцепторный механизмы образования ковалентной химической связи. 1) Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару. 2) Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь. При перекрывании двух орбиталей образуются области пространства, в которых электронная плотность повышена вследствие того, что в них могут находиться оба электрона, принадлежавшие разным атомам. Если область максимального перекрывания атомных орбиталей лежит на оси, соединяющей ядра атомов, то в этом случае говорят об образовании σ–связи. Если же область расположена не на оси, а симметрично относительно нее, в этом случае связь называют π–связью. Ковалентные связи насыщены в том смысле, что общая электронная пара связывает только два взаимодействующих атома и не оказывает существенного влияния на образование других связей теми же атомами. Кратность связи – число электронных пар, обобществлённых двумя соседними атомами молекулы в результате ковалентной химической связи. 39. Электрохимические системы. Взаимосвязь энергии химических процессов и электрической. Электрохимическими процессами называют процессы взаимного превращения химической и электрической форм энергии. К электрохимическим процессам относятся: Возникновение разности потенциалов и, следовательно, постоянного электрического тока в результате протекания химической реакции. Устройства, в которых реализуется это явление, называют химическими источниками тока (например, гальванические элементы, аккумуляторы). Химические процессы, протекающие при пропускании постоянного электрического тока через электролит. Это явление называют электролизом, а устройства, в которых оно реализуется – электролизерами. Электрохимический процесс может быть обратимым, т.е. протекать в одном или другом направлении в зависимости от условий (примером такой обратимости являются заряжение и разряд аккумулятора). Взаимодействия атомов и молекул с поверхностями твердых тел в рамках молекулярных моделей принято подразделять на два типа. Взаимодействие типа физической адсорбции имеет место, когда молекула удерживается у поверхности силами Ван-дер-Ваальса, т. е. не происходит перераспределения электрического заряда в системе. Полуэмпирический подход к расчету взаимодействий адсорбент—адсорбат основан на методе атом-атомных потенциалов, согласно которому энергия межмолекулярного взаимодействия представляется в виде суммы энергий парных взаимодействий атомов, а параметры атом-атомных потенциалов определяют исходя из опытных данных. Другой тип взаимодействия атомов и молекул с поверхностями твердых тел представляет хемосорбция. В этом случае происходит перераспределение заряда в системе и образуется химическая связь между поверхностью и субстратом. Хемосорбция представляет наибольший интерес с точки зрения гетерогенного катализа, поскольку катализ имеет донорно-акцепторный механизм 40. Информационное значение ряда напряжений (ряда активности) металлов. Электрохимический ряд активности металлов — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов. 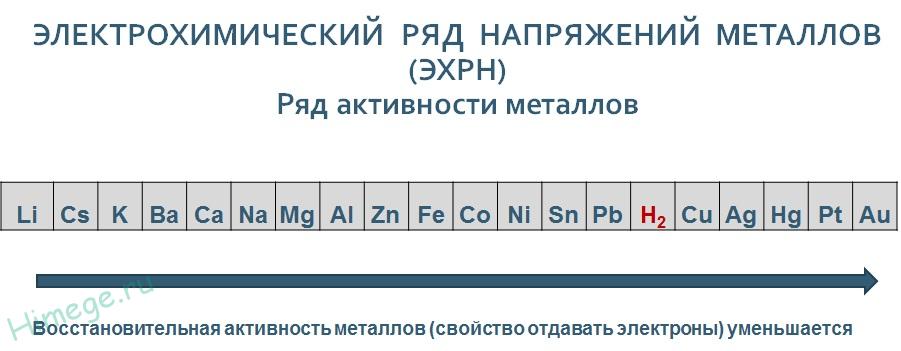 Восстановительная активность металлов (свойство отдавать электроны) уменьшается, а окислительная способность их катионов (свойство присоединять электроны) увеличивается в указанном ряду слева направо. 41. Формула Нернста и ее применение. Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар. |
