гуов. химияя. Закон сохранения массы веществ ( М. В. Ломоносов 1756 г.)
 Скачать 0.8 Mb. Скачать 0.8 Mb.
|
|
П  рименение – расчёт электродвижущей силы (ЭДС) и потенциалов отдельных полуреакций. рименение – расчёт электродвижущей силы (ЭДС) и потенциалов отдельных полуреакций.42. Принцип работы химического источника тока в виде гальванического элемента. Анодные и катодные процессы. Электродвижущая сила гальванического элемента. Гальванический элемент — химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока. Гальванический элемент состоит из ионпроводящего электролита и двух разнородных электродов (полуэлементов), процессы окисления и восстановления в гальваническом элементе пространственно разделены. Положительный полюс гальванического элемента называется катодом, отрицательный - анодом. Электроны выходят из элемента через анод и движутся во внешней цепи к катоду. Электродвижущая сила (ЭДС) элемента равна разности потенциалов правого и левого электродов: E 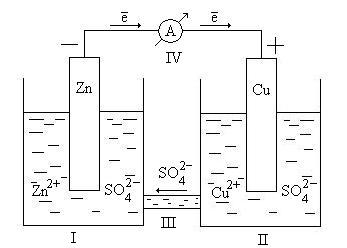 = EП - EЛ. = EП - EЛ.Если ЭДС элемента положительна, то реакция (так, как она записана в элементе) протекает самопроизвольно. Если ЭДС отрицательна, то самопроизвольно протекает обратная реакция. 43. Электрохимическая коррозия; анодный и катодные процессы и защита от коррозии. Электрохимическая коррозия относится к наиболее часто встречающимся процессам постепенного разрушения металла. Если говорить о типах электрохимической коррозии, то называют 3 разновидности: щелевые поражения; питтинги; межкристаллическое повреждение. Повреждение металла проводится двумя механизмами – гомогенным и гетерогенным. Гомогенный. Первоначально затрагивается поверхностный слой металлического изделия. Постепенно металл начинает растворяться под действием актов – катодного или анодного. На протяжении определенного времени происходит миграция катода и анода. Со временем процесс ускоряется. Особенность гомогенного механизма в том, что затрагивает как твердые, так и жидкие металлы. Меняется только скорость течения. Гетерогенный. У большинства твердых металлов не наблюдается гомогенной поверхности. Это связано с тем, что в самом материале состав кристаллической решетки может отличаться. Также как и в описанном выше случае, формируется анодный и катодный процессы, металл начинает постепенно разрушаться. При работе гальванического элемента одновременно протекает два электродных процесса: Анодный - ионы металла переходят в раствор электролита Fe → Fe2+ + 2e Происходит реакция окисления. Катодный - избыточные электроны ассимилируются молекулами или атомами электролита, которые при этом восстанавливаются. На катоде проходит реакция восстановления. Коррозия металла происходит именно на аноде. Способы защиты: На стадии производства стали в ее состав могут вводиться легирующие добавки, которые предотвращают появление очагов всех (или некоторых) видов коррозии. Таким элементом является, хром Конструктивные - Заключаются в защите поверхности металла с помощью нетонкослойных покрытий – панелей, резиновых прокладок, заслонов Пассивные - На металлическое изделие наносится тонкослойное покрытие, которое выполняет чисто барьерные характеристики, то есть процесс защиты заключается в предотвращении контакта металла с наружной средой. Активные – цинкование 44. Химическая идентификация веществ. Качественный и количественный анализы. Химическая идентификация (обнаружение) - это установление вида и состояния фаз, молекул, атомов, ионов и других основных частиц вещества на основе составления экспериментальных и соответствующих справочных данных для известных веществ. Идентификация является целью качественного анализа. При идентификации обычно определяется: цвет, фазовое состояние, плотность, вязкость, растворимость, температуры кипения, замерзания и фазового перехода. Качественный анализ характеризуется пределом обнаружения (обнаруженным минимумом) сухого вещества, т.е. минимальным количеством надежно идентифицируемого вещества и предельной концентрацией раствора. Определение содержания (концентрации, массы и т.п.) компонентов в анализируемом веществе называется количественным анализом. С помощью количественного анализа выявляют массовые соотношения компонентов в анализируемом образце, концентрацию вещества в растворе или газе. При количественном анализе измеряют те или иные химические, физико-химические и физические параметры анализируемого образца, которые зависят от его состава или содержания того или иного компонента. 45. Методы инструментального количественного анализа. Инструментальные методы анализа — количественные аналитические методы, для выполнения которых требуется электрохимическая оптическая, радиохимическая и иная аппаратура. К инструментальным методам анализа обычно относят: • электрохимические методы — потенциометрию, полярографию, кондуктометрию и др.; • методы, основанные на испускании или поглощении излучения,— эмиссионный спектральный анализ, фотометрические методы, рентгеноспектральный анализ и др.; • масс-спектральный анализ; • методы, основанные на измерении радиоактивности. 46. Электрохимические методы анализа веществ. Электрохимические методы анализа - это совокупность методов качественного и количественного анализа, основанных на электрохимических явлениях, происходящих в исследуемой среде или на границе раздела фаз и связанных с изменением структуры, химического состава или концентрации анализируемого вещества. Виды электрохимического анализа: Полярография (тип вольтамперометрии) - это особый вид измерений, который относится к общей категории вольтамперометрии линейной развертки, где электродный потенциал изменяется линейным образом от начального потенциала к конечному потенциалу. Амперометрия - это обнаружение ионов в растворе на основе электрического тока или изменения электрического тока. Кондуктометрия - это метод анализа, основанный на измерении электропроводности анализируемого раствора. Потенциометрия - это совокупность методов физико-химического анализа, основанных на измерении электрохимического потенциала электрода, функционально связанного с концентрацией определяемого вещества, называемого потенциалопределяющим. Кулономентрия - это метод анализа, основанный на измерении ко-личества электричества, израсходованного на электропревращение (восстановлении или окислении) определяемого вещества при элек-тролизе его раствора. 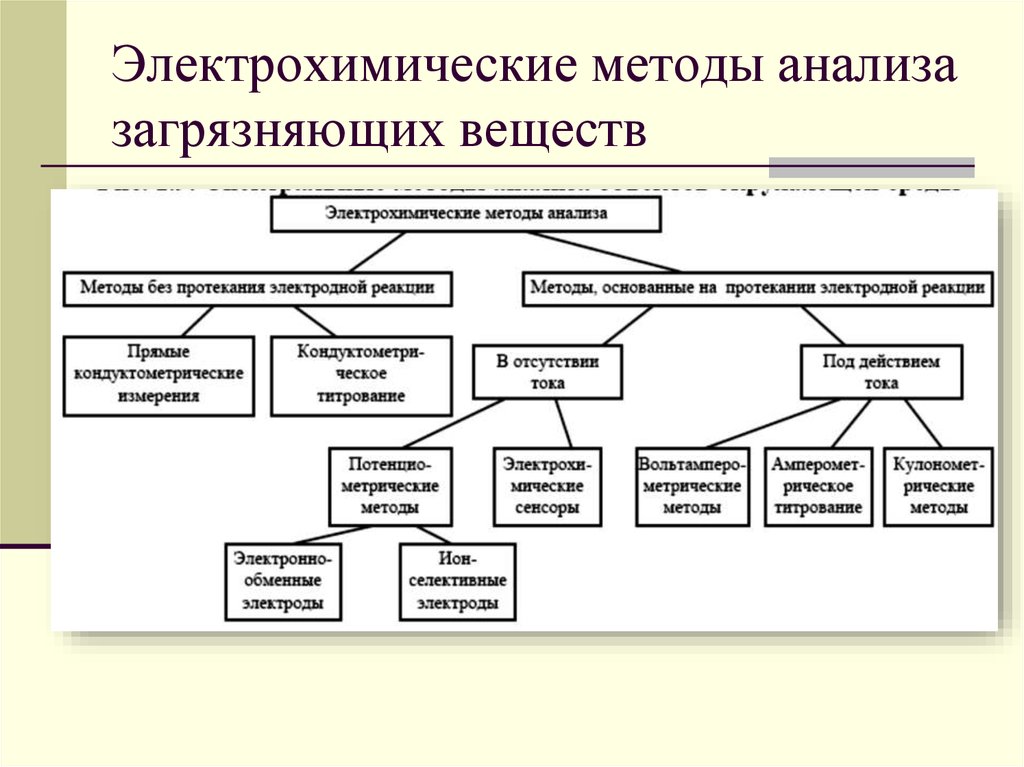 47. Коагуляция дисперсных систем электролитами разной природы. Коагуляция — это процесс уменьшения степени дисперсности и числа частицдисперсной системы путём слипания первичных частиц. В результате коагуляции обычно происходит выпадение (седиментация) дисперсной фазы или хотя бы изменение свойств первичной дисперсной системы. Коагуляция коллоидных систем может происходить под влиянием ряда факторов – старения системы, изменения концентрации дисперсной фазы, изменения температуры, механических воздействий, света и т. д. Но наиболее важное теоретическое и практическое значение имеет коагуляция при добавлении электролитов. Коагуляцию способны вызвать все электролиты, существенно лишь, чтобы концентрация этих электролитов в системе была достаточно велика для того, чтобы сжать двойной электрический слой и этим понизить энергетический барьер, препятствующий слипанию частиц при их столкновении. Коагулирующим действием в электролите обладают не все ионы, а только те, которые имеют заряд, одинаковый с зарядом противоиона мицеллы (или, что то же, заряд, противоположный по знаку заряду коллоидной частицы). Таким образом, для золей с отрицательно заряженными частицами коагулирующими ионами являются катионы, а для золей с положительными частицами – анионы. Для начала коагуляции необходимо превысить некоторую минимальную концентрацию электролита в золе. Эта величина (g), получившая название порога коагуляции и обычно выражаемая в моль/л или мг-экв/л, очевидно, отвечает сжатию двойного электрического слоя до той степени, когда он перестает служить энергетическим барьером, предохраняющим частицы от слипания. Начало коагуляции может быть определено по разным признакам: по изменению окраски золя, появлению мути, началу выделения дисперсной фазы в осадок и т. п. Порог коагуляции зависит от концентрации золя. Величина эта является относительной характеристикой и всегда необходимо точно указывать условия, в которых проводилось определение порога коагуляции. При рассмотрении коагуляции коллоидных систем различают два предельных случая: 1) нейтрализационную коагуляцию, когда потеря устойчивости происходит в результате разрядки коллоидных частиц и уменьшения их j0-потенциала; 2) концентрационную коагуляцию, при которой потеря устойчивости связана не с падением j0-потенциала, а вызвана сжатием диффузного двойного электрического слоя. 48. Органические вещества и их классификация, высокомолекулярные соединения. Получение, свойства, применение. Органическая химия – это раздел химии, посвященный изучению строения, способов синтеза и химических превращений углеводородов и их функциональных производных. Классификация органических соединений В классификации принимаются за основу два важнейших признака: строение углеродного скелетаи наличие в молекулефункциональных групп. По строению углеродного скелета органические. соединения делятся на три большие группы. I Ациклические(алифатические) соединения, имеющие открытую углеродную цепь как неразветвлённую, так и разветвлённую. К ним относятся: Алканы СН3– СН2– СН2– СН3 Алкены СН = СН – СН2– СН3 Алкины СН = С – СН2– СН3 Алкадиены СН2= СН – СН = СН2 II Циклические соединения, которые в свою очередь делятся на карбоциклические и гетероциклические. Карбоциклические соединения- это соединения в которых углеродная цепь замкнута в цикл (кольцо). Они в свою очередь подразделяются на алициклические и ароматические. Примером алициклических углеводородов является циклогексан, а ароматических – бензол. 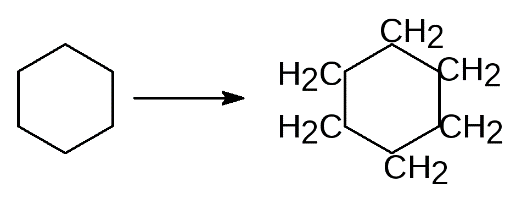 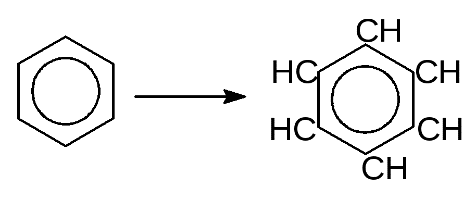 Циклогексан Бензол Гетероциклические соединения (от греческого heteros– другой), содержащие в цикле не только атомы углерода, но и атомы других элементов, чаще всего азота, кислорода, серы. Например: Р  одоначальными соединениями в органической химии признаны углеводороды, состоящие только из атомов углерода и водорода. Разнообразные органические соединения можно рассматривать как производные углеводородов, полученные введением в них функциональных групп. одоначальными соединениями в органической химии признаны углеводороды, состоящие только из атомов углерода и водорода. Разнообразные органические соединения можно рассматривать как производные углеводородов, полученные введением в них функциональных групп.Функциональной группой называют структурный фрагмент молекулы, характерный для данного класса органических соединений и определяющий его химические свойства. Например, свойства спиртов определяются наличием гидроксогруппы (- ОН), свойства аминов – аминогруппы (- NH2), карбоновых кислот наличием в молекуле карбоксильной группы (-СООН) и так далее. |
