Многоэлектронный атом. ЛР 2 отчет. Лабораторная работа 2 Многоэлектронный атом Исполнитель Сарвин И. А. Группа 211 Вариант 11 Введение
 Скачать 181.14 Kb. Скачать 181.14 Kb.
|
|
Лабораторная работа №2: «Многоэлектронный атом» Исполнитель: Сарвин И.А. Группа 2/11 Вариант 11 Введение: Многоэлектронный атом – это система из ядра с зарядом Zē и некоторого числа электронов Nē. В этой системе существует 2 вида кулоновских взаимодействий: притяжение между ядром и электронами и отталкивание между электронами. Ядро и электроны движктся относительно центра масс, т.е. T=Tядра+Te. Т.к. масса ядра много больше массы электрона можно принять центром тяжести ядро. В начало координат помещаем центр тяжести, тогда ядро неподвижно и Tядра=0. Оператор Гамильтона в общем виде для такой системы: 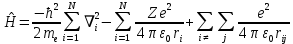 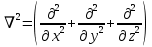 Например, для атома гелия, у которого 2 электрона, он будет выглядеть так: 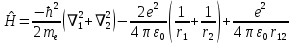 Волновая функция должна быть антисимметрична, т.е. должна менять знак при перестановке двух электронов. Джон Слейтер показал, что единственной формой построения волновой функции является определитель Слейтера. Детерминант Слейтера – это приложенная многоэлектронная волновая функция, построенная из N ортонормированных спин-орбиталей отдельных электронов. Общий вид: 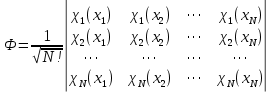 Для атома калия электронная конфигурация будет иметь вид: 1s2 2s2 2p6 3s2 3p6 4s1 Применим правило Слэтера-Зинера для расчета констант экранирования и эффективного заряда ядра. Разделим на группы: (1S)2(2S2P)8(3S2P)8(4S)1 Рассчитаем константы экранирования и эффективные заряды ядра: 1S: σ=0.3 а.е.з, тогда Zэф=19-0.3=18.7 а.е.з, 2S2P: σ=7*0.35+0.85*2=4.15 а.е.з, тогда Zэф=19-4.15=14.85 а.е.з, 3S2P: σ=7*0.35+0.85*8+2*1=11.25 а.е.з, тогда Zэф=19-11.25=7.75 а.е.з, 4S: σ=0.85*8+10*1=16.8 а.е.з, тогда Zэф=19-16.8=2.2 а.е.з. Недостатками данных расчётов является то, что функции с l>1 представляется без узловыми, что не так, а также для ns и np электронов принимается одинаковый эфективный заряд ядра, т.е. не учитывается разная проникающая способность ns и np АО. Обычно, говоря об потенциале ионизации(ПИ) и сродстве к электрону (СЭ), рассматривают энергию высшей занятой атомной орбитали. Эти величины характеризуют протекание окислительно-восстановительных процессов. Экспериментальная часть: Расчеты проводились в программе Exel, визуализация графиков осуществлялась в программе Origin. Результаты: Задание 1. Рассматриваем атом углерода. Электронная конфигурация имеет вид: С6 1s2 2s2 2p2 Запишем Гамильтониан для этого атома: 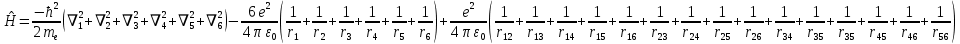 Так же можем записать определитель Слейтера: 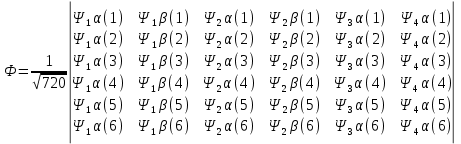 Построим графики радиальных составляющих R*(r) и радиальных функций распределения D*(r) для внутренних и внешних атомных орбиталей многоэлектронного атома. Для этого необходимо рассчитать σ – константу экранирования Zэф – эффективный заряд ядра; Zэф = Z – σ ξ – слэтеровскую экспоненту; ξ = 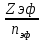 , где nэф – эффективное главное квантовое число. , где nэф – эффективное главное квантовое число.АО разделяем на группы (1S)2(2S2P)4 Тогда константы экранирования: 1s: σ=0.3 а.е.з, тогда Zэф=6-0.3=5.7 а.е.з, ξ= 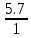 =5.7 а.е.з =5.7 а.е.з2s2p: σ=3*0.35+2*0.85=2.75 а.е.з, тогда Zэф=6-2.75=3.25а.е.з, ξ= 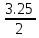 =1,625 а.е.з =1,625 а.е.зС помощью Zэф можно оценить размеры АО и ее энергию. Рассчитываем значение радиальной составляющей волновой функции по формуле: R*(r) =(2)n+1/2 ((2n)!)-1/2 (r/a0)nэф-1 exp(-r/a0) для значений r от 0 до 2 Å с шагом 0.05 Å. После рассчитываем радиальную функцию распределения по формуле: D*(r)=(R*(r))24πr2 Данные расчёты проводим как для внешних, так и для внутренних АО. Затем строим графики зависимости R*(r) и D*(r): 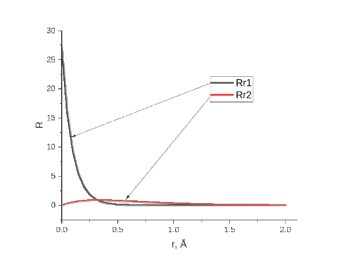 Рисунок 1 - графики радиальных составляющих 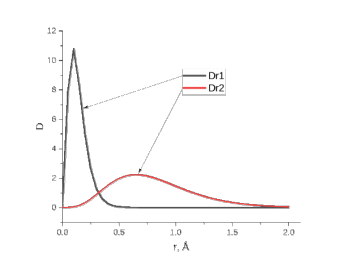 Рисунок 2 – графики радиальных функций распределения При помощи данных графиков можем узнать наиболее вероятные расстояния между электроном и ядром, на определенной АО, эти величины соответствуют максимуму радиальной функции распределения. Так, можно сказать, что: Для 1s обитали наиболее вероятное расстояние составляет 0.1 Å Для 2s2p обитали наиболее вероятное расстояние составляет 0.65 Å Явно заметно, что наиболее вероятное расстояние между электроном и ядром на внешней АО больше чем на внутренней, это связано с тем, что электроны на внешних оболочках хуже связаны с ядром, чем электроны с внутренних. Можем рассчитать эффективный размер АО и Энергию АО по формулам: rAO=(2nэф+1)nэфa0 /(2Zэф) и ЕАО= -13,6·Z2эф/n2эф Для внутренней оболочки 1s: rAO = 0.14 Å ЕАО = -441.9 эВ Для внешней оболочки 2s2p: rAO = 0.81 Å ЕАО = -35.9 эВ Формально атом бесконечно велик, но в качестве размера атома можем принять размер внешней АО, следовательно, размер атома углерода равен 81 пм. Так же видно, что энергия возрастает с увеличением расстояния электрона от ядра. Запишем атомный терм для углерода: Для этого необходимо рассчитать Орбитальное квантовое число для всех электронов в атоме: L= 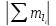 =1 =1Мультиплетность: Суммарный спин(S)=0,5+0,5=1, тогда æ=2S+1=3 Полный угловой момент: J=L-S=0 Атомный терм: 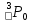 Задание 2 Имеем 2 атома F и Cl для их внешних АО рассчитаем σ – константу экранирования Zэф – эффективный заряд ядра; ξ – слэтеровскую экспоненту. F9 1s22s22p5 (1s)2(2s2p)7 2s2p: σ=6*0.35+2*0.85=3.8 а.е.з, тогда Zэф=9-3.8=5.2 а.е.з, ξ= 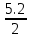 =2.6 а.е.з =2.6 а.е.зCl17 1s22s22p63s23p5 (1s)2(2s2p)8(3s3p)7 3s3p: σ=6*0.35+8*0.85+2*1=10.9 а.е.з, тогда Zэф=17-10.9=6.1 а.е.з, ξ= 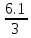 =2.03 а.е.з =2.03 а.е.зТеперь можем рассчитать значение радиальной составляющей волновой функции и радиальную функцию распределения и построить графики для двух атомов. 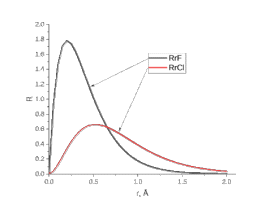 Рисунок 3 - графики радиальных составляющих для F и Cl 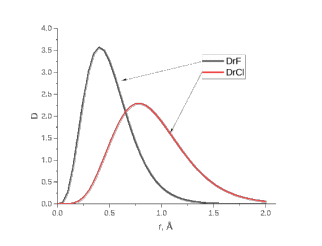 Рисунок 4 – графики радиальных функций распределения для F и Cl Наиболее вероятное расстояние между электроном и ядром на внешних АО: Для F r=0.4 Å Для Cl r=0.8 Å Видно, что наиболее вероятное расстояние между электроном и ядром для внешних АО у хлора больше, чем у фтора, это связанно с тем, что внешним у хлора является 3s3p уровень, тогда как у фтора 2s2p, а, следовательно, у хлора он находится дальше от ядра. Рассчитаем эффективный размер АО и энергию АО: Для F: rAO = 0.51 Å ЕАО = -91.9 эВ Для Cl: rAO = 0.91 Å ЕАО = -56 эВ Опять же, можем прировнять эффективней размер внешней АО с эффективным размером атома, тогда размер атома F=51пм, а атома Cl=91пм. Эффективный размер атома хлора больше чем у фтора благодаря эффекту экранирования, т.е. внутренние электроны отталкивают внешние, что увеличивает радиус атома. Задание 3 Рассмотрим элементы второго периода Периодической системы Д.И. Менделеева. Рассчитаем константы экранирования, эффективные заряды, действующие на электроны внутренних и внешних АО, энергии АО, ПИ, а также среднее расстояние электрона до ядра. Данные свели в таблицы:  Таблица 1 – Характеристики Внутренних АО  Таблица 2 – Характеристики внешних АО Из таблиц и графиков видно, что на внутренних и на внешних АО уменьшается Энергия АО и средние расстояния от электрона до ядра, а, следовательно, уменьшается и размер атома, при этом увеличивается потенциал ионизации, что говорит о увеличении окислительных свойств вдоль периода и уменьшении восстановительных. 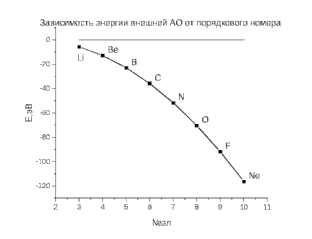 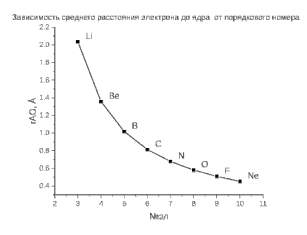 Вывод: В работе были записаны Гамильтониан и определитель Слейтера для атома углерода. Для внешних и внутренних АО проведены расчеты константы экранирования, эффективного заряд ядра, слейтеровской экспоненты, а также построены графики радиальной составляющей волновой функции и радиальной функцию распределения. Из полученных данных выяснено, что наиболее вероятное расстояние от электрона до ядра на внешней АО больше, чем на внутренней, что связано с тем, что электроны на внешних оболочках хуже связаны с ядром, чем на внутренних благодаря эффекту экранирования. Атомный терм основного состояния углерода: 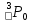 Для внешних АО Фтора и Хлора были рассчитаны константы экранирования, эффективные заряды ядра, слейтеровские экспоненты, а также построены графики радиальной составляющей волновой функции и радиальной функцию распределения. Посчитаны энергии внешних АО и эффективные размеры атомов. Видно, что наиболее вероятное расстояние электрона до ядра на внешней АО у хлора в два раза выше, так как размер атома хлора гораздо больше атома фтора, а это, в свою очередь связано с эффектом экранирования – отталкивание внешних электронов внутренними. Был исследован 2 период ПСХЭ, для внешних и внутренних оболочек атомов этого периода были рассчитаны константы экранирования, эффективные заряды ядра, энергии АО, эффективные размеры атомов а так же потенциалы ионизации. После построения зависимостей энергии внешней АО и среднего расстояния электрона до ядра от порядкового номера элемента, было выяснено: В периоде уменьшается атомные радиусы, т.к. увеличивается заряд, и притяжение электронов к ядру становится сильнее. С увеличение порядкового номера уменьшается Энергия внешних АО, при этом увеличивается ПИ - наименьшая энергия, необходимая для удаления электрона от свободного атома в его основном состоянии на бесконечность. Увеличение потенциала ионизации, говорит нам о том, что в периоде усиливаются окислительные свойства элементов, а их восстановительные свойства уменьшаются. Если сравнит табличные значения ПИ с полученными, легко заметить сильное различие в значениях (кроме лития), это может быть вызвано тем, что процессы присоединения и удаления электронов сильно зависят от электронной корреляции, которая не учитывается в однодетерминантном приближении. |
