ЛАБОРАТОРНАЯ РАБОТА 7. Лабораторная работа 7 Обмен белков и нуклеиновых кислот Цель работы изучить важнейшие свойства аминокислот и белков
 Скачать 377 Kb. Скачать 377 Kb.
|
|
Опыт 2. Высаливание белков хлоридом натрия и сульфатом магния. Принцип метода. Для высаливания белков из растворов применяются хлорид натрия, сульфат натрия, ацетат натрия, сульфат магния, ацетат калия, хлорид кальция, нитрат кальция и сульфат аммония. Некоторые из перечисленных солей высаливают белки не только при насыщении ими раствора; определенные белки высаливаются и при достаточно низких концентрациях солей. К таким солям относится сульфат аммония. Условия, при которых происходит осаждение сульфатом аммония, настолько характерны для отдельных белков (за редкими исключениями), что это свойство белков можно сравнить с растворимостью, характеризующей кристаллические вещества. Белки состоят из аминокислот и поэтому обладают амфотерными свойствами. При растворении белков в воде ион водорода,появляющийся в результате диссоциации карбоксильной группы, присоединяется к аминогруппе. Поэтому белковые молекулы несут как положительные, так и отрицательные заряды. Величина заряда определяется количеством ионогенных групп. При определённом значении рН суммарный электрический заряд молекулы белка становится равным нулю. Такое значение рН называется изоэлектрической точкой (рJ). В изоэлектрической точке растворы белков имеют минимальную устойчивость, поскольку они лишены основного стабилизирующего фактора – заряда и поэтому легко выпадают в осадок. Определить изоэлектрическую точку белка можно, определив рН, при котором раствор белка имеет наибольшее помутнение. У большинства белков изоэлектрическая точка лежит в слабокислой среде. Осаждение белков NaCl и MgSO4 - Хлорид натрия и сульфат магния в отличие от сульфата аммония осаждают глобулины из насыщенного раствора. В изоэлектрической точке глобулины этими же солями осаждаются при более низкой концентрации. Порядок выполнения работы. В 2 пробирки наливают по 5 мл 1% раствора белка, прибавляют при перемешивании до полного насыщения (когда часть кристаллов остается нерастворённой, несмотря на взбалтывание) в одну пробирку тонко измельченного хлорида натрия, в другую – сульфата магния. Через несколько минут в двух пробирках появляется осадок глобулинов. Осадки отфильтровывают и к фильтрату добавляют несколько капель разбавленной уксусной кислоты (СН3СООН) – в слабокислой среде выпадают альбумины, поскольку рН раствора альбуминов приблизится к изоэлектрической точке. В водном растворе белков их частицы являются заряженными и сильно гидратированными, что обуславливает устойчивость белковых растворов. Но при высокой концентрации солей, ионы которых тоже сильно гидратированы, происходит разрушение водных оболочек белковых молекул и снимается заряд с белковой молекулы адсорбирующимися на ней ионами соли. В результате этих двух процессов белковые растворы теряют устойчивость, частицы белка слипаются друг с другом, укрупняются и, наконец, выпадает осадок. Оформление опыта: полученные результаты опыта записать в тетрадь и сделать вывод. Опыт 3. Свертывание белков при нагревании. Принцип метода. Выпадение белков в осадок при нагревании характерно почти для всех белков (исключение составляет желатина, не свёртывающаяся при нагревании). Особенно легко и более полно происходит осаждение белка в слабокислой среде, вблизи от изоэлектрической точки. В нейтральной и сильнокислой средах осаждение белков идёт значительно хуже, а в щелочной среде вовсе не наблюдается. В щелочной среде понижается диссоциация белка по радикалам диаминокислот, молекулы его приобретают отрицательный заряд, вследствие чего остаются в растворе даже при нагревании до кипения. Добавление к раствору белка нейтральных солей (NaCl) облегчает и ускоряет свёртывание белков при кипячении вследствие наступающего дегидратирования белковых частиц. Порядок выполнения работы. В 5 пробирок наливают по 2 мл. белка: первую пробирку нагревают, осадок появляется еще до того, как жидкость закипит. Во вторую пробирку добавляют 1 каплю 1%-ного раствора уксусной кислоты (СН3СООН) и нагревают. Хлопьевидный осадок белка выпадает скорее и полнее, чем в первой пробирке вследствие того, что при подкислении рН раствора приблизится к изоэлектрической точке белка (заряд белка = 0). В третью пробирку добавляют 0,5 мл. 10%-ной уксусной кислоты (СН3СООН) и нагревают. Осадка не образуется даже при кипении. В четвертую пробирку добавляют 0,5 мл. 10%-ной уксусной кислоты (СН3СООН) и несколько капель насыщенного раствора хлорида натрия и нагревают. Осадок есть. В пятую пробирку добавляют 0,5 мл. 10% раствора щелочи и нагревают. Осадок не образуется даже при кипячении. Оформление работы. Результаты опыта и выводы записывают в таблицу. Форма записи:
Опыт 4. Осаждение белков солями тяжелых металлов. Принцип метода. Осаждение белков солями тяжелых металлов в отличие от высаливания происходит при небольших концентрациях солей. Белки при взаимодействии с солями тяжелых металлов (свинца, меди, серебра, ртути и др.) адсорбируют их, образуя солеобразные и комплексные соединения, растворимые в избытке этих солей (за исключением солей AgNO3, HgCl2), но нерастворимые в воде. Растворение осадка в избытке солей называется адсорбционной пептизацией. Данное явление происходит вследствие возникновения одноименного положительного заряда на частицах белка. Если при разбавлении осадок не растворяется, значит, реакция практически необратимая. Ионы металлов, способные образовывать нерастворимые соединения с белками, для нас являются токсичными. Таким образом, соли тяжелых металлов: Hg, Ag, Cu, Pb и т.д. вызывают необратимое осаждение белков, образуя с ними нерастворимые в воде соединения. Однако при избытке некоторых солей наблюдается растворение первоначально образовавшегося осадка. Это связано с накоплением ионов металла на поверхности денатурированного белка и появлением положительного заряда на белковой молекуле. Способность белка прочно связывать ионы тяжелого металла в виде нерастворимых осадков в воде используется как противоядие при отравлении солями ртути, меди, свинца и др. Сразу после отравления обычно применяют белки молока или яиц, пока еще эти соли находятся в желудке и не успели всосаться. Вслед за дачей белка у больного вызывают рвоту, чтобы удалить яд из организма. Положительно заряженные ионы тяжелых металлов (катионы) образуют прочные связи с отрицательно заряженными карбоксил-анионами R-групп белка и часто вызывают разрывы ионных связей. Они также снижают электрическую поляризацию белка, уменьшая его растворимость. Вследствие этого находящийся в растворе белок выпадает в осадок. Порядок выполнения работы. В 2 пробирки наливают по 1 мл. раствора белка и медленно по каплям при встряхивании прибавляют в одну 2-3 капли раствора сульфата меди, в другую ацетата свинца. В обеих пробирках выпадает хлопьевидный осадок вследствие образования малорастворимого солеобразного соединения голубого (с СuSO4) и белого (с Pb (СН3СООН)2) цвета. Оформление опыта: полученные результаты опыта записать в тетрадь и сделать вывод. Опыт 5. Осаждение белков концентрированными минеральными кислотами. Принцип метода. Концентрированные минеральные кислоты вызывают необратимые осаждения белков. Это связано как с дегидратацией белковых молекул, так и с денатурацией белка. Концентрированные минеральные кислоты вызывают денатурацию белка за счёт удаления факторов устойчивости белка в растворе (заряд и гидратная оболочка), и образуют комплексные соли белка с кислотами. Ортофосфорная кислота осадка не дает. В избытке всех минеральных кислот, за исключением азотной, выпавший осадок белка растворяется. По-видимому, это происходит в результате перезарядки молекул белка и частичного их гидролиза. При добавлении избытка азотной кислоты растворения осадка не происходит. Вот почему для определения малых количеств белка в моче при клинических исследованиях применяется азотная кислота (метод Робертса - Стольникова – Брендберга). Порядок выполнения работы. В 3 пробирки наливают по 1мл. минеральных кислот: азотной, серной и соляной. Затем осторожно по стенке пробирки пипеткой наливают по 0,5 мл. раствора белка, так, чтобы он не смешивался с кислотой. В месте соприкосновения двух жидкостей появляется белый аморфный осадок белка. При встряхивании в пробирке с азотной кислотой осадок увеличивается, в двух других пробирках осадок растворяется в избытке кислот. Оформление опыта: полученные результаты опыта записать в тетрадь и сделать вывод. Опыт 6. Осаждение белков реактивами на алкалоиды. Принцип метода. Осаждение белковых веществ общими реактивами на алкалоиды обусловлено тем, что в состав аминокислот и алкалоидов входят сходные гетероциклические группировки (индольные, имидазольные, пирролидиновые и др.). Алкалоиды являются азотистыми основаниями, содержащими в молекуле различные гетероциклы с атомами азота. В белковых молекулах также содержатся некоторые гетероциклы – имидозольные, пиролидиновые и другие, входящие в состав отдельных аминокислот. Поэтому белки обнаруживают некоторые реакции, характерные для алкалоидов. Алкалоидные реактивы образуют нерастворимые соединения с белками. Слабое подкисление органической кислотой (например, уксусной) благоприятствует реакции и, наоборот, добавление сильных минеральных кислот затормаживает этот процесс. Осадки растворяются в щелочной среде. Порядок выполнения работы. В три пробирки наливают по 1 мл 1%-го раствора белка, по 4-5 капель 1%-го раствора уксусной кислоты и по 2-3 капли: в первую пробирку – 10%-го раствора пикриновой кислоты, во вторую – насыщенного раствора танина, в третью – 5%-го раствора железосинеродистого калия K4Fe(CN)6. Наблюдают выпадение осадка. Оформление опыта: полученные результаты опыта записать в тетрадь и сделать вывод. Опыт 7. Осаждение белков спиртом Принцип метода. Продолжительный контакт белка со спиртом ведет к необратимому осаждению, денатурации, в результате этого выпадает хлопьевидный осадок белка вследствие дегидратации белковых молекул при добавлении спирта. Под денатурацией понимают утрату трехмерной конформации, присущей данной белковой молекуле. Это изменение может носить временный или постоянный характер, но и в том, и в другом случае аминокислотная последовательность белка остается неизменной. При денатурации молекула развертывается и теряет способность выполнять свою обычную биологическую функцию. Реакция осаждения белка спиртом или кратковременным действием спирта обратима при охлаждении. Если осадок быстро отделить от спирта, то белок может сохранить нативное состояние. Порядок выполнения работы. В пробирку наливают 1 мл. раствора белка, добавляют немного кристаллического хлорида натрия, приливают туда же постепенно 3-4 мл. этилового спирта. Оформление опыта: полученные результаты опыта записать в тетрадь и сделать вывод. Опыт 8. Осаждение белков фенолом и формалином. Принцип метода. Фенол и формалин вызывают необратимую денатурацию белка: образуются малорастворимые продукты конденсации, уплотняется его консистенция, резко снижается растворимость и т. д. На этом основано применение фенола и формалина для дезинфекции, так как эти вещества вызывают денатурацию белков живых клеток и, следовательно, их отмирание. 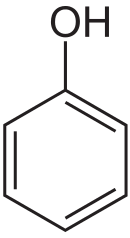 Фено́л (гидроксибензол, устаревшее карболовая кислота) C6H5OH. Формалин, водный раствор, содержащий 37-40% формальдегида и 6-15% метилового спирта (стабилизатор). Формальдегид (муравьиный альдегид, метаналь) , HCHO. Порядок выполнения работы. В две пробирки наливают по 1 мл. белка, добавляют в 1-ю столько же насыщенного водного раствора фенола, а во 2-ю – равный объем формалина. В обеих пробирках выпадает осадок белка. От действия фенола осадок выпадает быстрее. Оформление работы: наблюдают, записывают и объясняют результаты опыта. Контрольные вопросы. 1. Чем обусловлены цветные реакции на белки? 2. Как с помощью цветных реакций обнаружить в белке триптофан? 3. Как обнаружить в белке тирозин? 4. Как обнаружить в белке гуанидин? 5. Даны 2 пробирки с растворами: одна с раствором белка, другая содержит смесь аминокислот. При помощи цветных реакций определите: а) в какой пробирке содержится белок; б) какие аминокислоты содержатся в другой пробирке? 6. Что такое денатурация белка? Чем отличается денатурированный белок от нативного? 7. При каких условиях, и какие вещества вызывают необратимое осаждение белков? В какой среде белок не свертывается? Самостоятельная работа. 1. Используя материал учебника записать схемы цветныех реакции на белки и аминокислоты. 2. Изучить реакции осаждения белков, вызываемые посредством высаливания, при воздействии на них физических и химических факторов : а) обратимое осаждение; б) необратимое осаждение. Литература по теме: 1. Власова Г.А. Общая биохимия / Белгородский государственный педагогический институт. – Белгород, 1990. – 193 с. 2. Пустовалова Л.М. Практикум по биохимии. – Ростов – на – Дону: Феникс, 1999. – 544 с. 3. Кукушкин Ю.Н. Химия вокруг нас / Высшая школа, 2002. – 156 с. 4. Смульский В.М., Моногаров В.Д., Булатова М.М. Питание в подготовке спортсмена /Киев: Олимпийская литература, 2006. – 157с. 5. Тарасова Л.Ю. Биохимия. Краткий курс с упражнениями и задачами / Ростов-на-Дону: Издательский центр МарТ, 2007. – 464 с. 6. Харгривса М. Метаболизм в процессе физической деятельности / Киев: Олимпийская литература, 2008.-231 с. 7. Михайлов С.С. Спортивная биохимия. М.: Издательство "Советский Спорт", 2013. – 348 с. |
