ЛАБОРАТОРНАЯ РАБОТА 7. Лабораторная работа 7 Обмен белков и нуклеиновых кислот Цель работы изучить важнейшие свойства аминокислот и белков
 Скачать 377 Kb. Скачать 377 Kb.
|
|
Контрольные вопросы. 1. Нормы потребления белка и структура белкового питания. 2. Что такое незаменимые аминокислоты? 3. Какова роль соляной кислоты желудочного сока в переваривании белков? 4. Под влиянием каких ферментов пищеварительного тракта и через какие промежуточные продукты протекает последовательный распад белков до аминокислот? 5. Участие аминокислот в пластическом обмене (синтез белков, реакции переаминирования и декарбоксилирования). 6. Участие белков в энергетическом обмене (мобилизация, реакция окислительного дезаминирования аминокислот). 7. Конечный продукт обмена белков (где образуется, как устраняется из организма?). Лабораторная работа № 7 Свойства белков Цветные реакции на белки и аминокислоты. Значение цветных реакций состоит в том, что они дают возможность обнаружить присутствие белка в биологических жидкостях, растворах и установить аминокислотный состав различных природных белков. Эти реакции применяются как для качественного, так и для количественного определения белка и содержащихся в нем аминокислот. Некоторые реакции присущи не только белкам, но и другим веществам, например, фенол, подобно тирозину, дает розово-красное окрашивание с реактивом Миллона, поэтому проведения одной какой-либо реакции для установления наличия белка не достаточно. Существует два типа цветных реакций: 1) универсальные – биуретовая (на все белки) и нингидриновая (на все а-аминокислоты и белки); 2) специфические – только на определенные аминокислоты как в молекуле белка, так и в растворах отдельных аминокислот, например реакция Фоля (на аминокислоты, содержащие слабосвязанную серу), реакция Миллона (на тирозин), реакция Сакагучи (на аргинин) и др. При проведении цветных реакций на белки и аминокислоты необходимо предварительно составить следующую таблицу: Цветные реакции на белки (качественные реакции)
Цветные реакции на белки Опыт 1. Биуретовая реакция. Биуретовая реакция – качественная на все без исключения белки, а также продукты их неполного гидролиза, которые содержат не менее двух пептидных связей. Принцип метода. Биуретовая реакция обусловлена присутствием в белках пептидных связей (- СО – NH -), которые в щелочной среде образуют с сульфатом меди (ІІ) окрашенные в красно-фиолетовый цвет медные солеобразные комплексы. Биуретовую реакцию дают также некоторые небелковые вещества, например биурет (NH2-CO-NH-CO-NH2), оксамид (NH2CO-CO-NH2), ряд аминокислот (гистидин, серин, треонин, аспарагин). 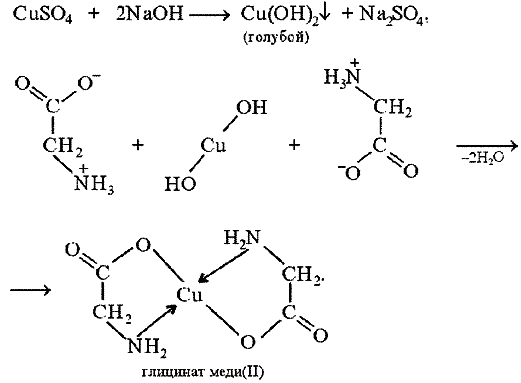 Биуретовая реакция с глицином Порядок выполнения работы. К 1 мл исследуемого 1% раствора белка добавляют равный объем 10 % раствора гидроксида натрия (NaOH) щелочи и затем 2-3 капли 1 % раствора сульфата меди (CuSO4). разбавленного, почти бесцветного раствора медного купороса. При положительной реакции появляется фиолетовая окраска с красным либо синим оттенком. Вывод: Опыт 2. Реакция на «слабосвязанную серу». Принцип метода. Это реакция на цистеин и цистин. При щелочном гидролизе «слабосвязанная сера» в цистеине и цистине достаточно легко отщепляется, в результате чего образуется сероводород, который, реагируя со щелочью, дает сульфиды натрия или калия. При добавлении ацетата свинца(II) образуется осадок сульфида свинца(II) серо-черного цвета. Порядок выполнения работы. В пробирку наливают 1 мл неразбавленного куриного белка, прибавляют 2 мл 20%-го раствора гидроксида натрия. Смесь осторожно кипятят (чтобы смесь не выбросило). При этом выделяется аммиак, который обнаруживается по посинению влажной лакмусовой бумажки, поднесенной к отверстию пробирки (не касаться стенки). Образующийся незначительный осадок растворяется при кипении, а затем добавляют 0,5 мл раствора ацетата свинца(II). Наблюдается выпадение серо-черного осадка сульфида свинца(II): 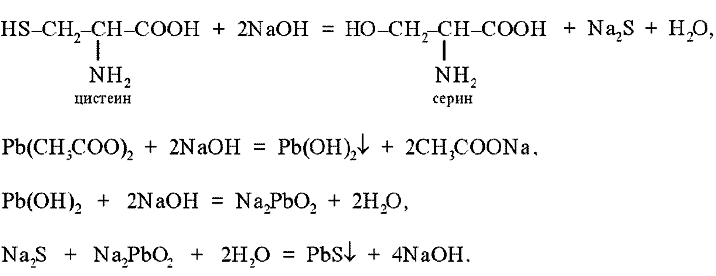 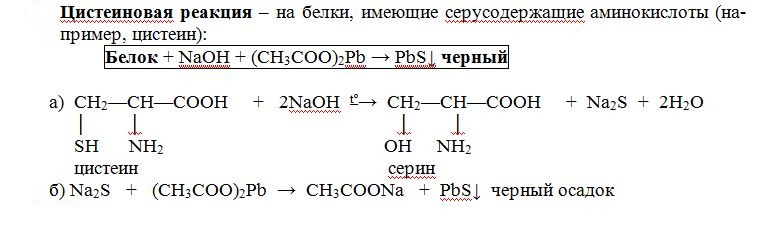 Химизм реакции: 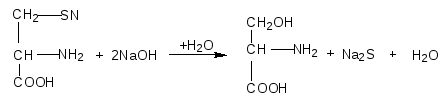
В пробирку наливают 1 мл. неразбавленного куриного белка добавляют 2 мл. концентрированного раствора щелочи, кладут несколько кипятильников. К горячему раствору добавляют раствор плюмбита натрия – образуется желто-бурое или черное окрашивание. (Плюмбит натрия готовят следующим образом: к 1 мл уксуснокислого свинца добавляют раствор щелочи по каплям до растворения образующего вначале осадка гидроксида свинца). При наличии в молекуле белка серосодержащих аминокислот (цистина, цистеина) из этих аминокислот постепенно отщепляется сера в виде иона в степени окисления – 2, наличие которого и обнаруживается ионом свинца, образующим с ионом серы черный нерастворимый сульфид свинца:  P  b(CH3COO)2 + 2NaOH Pb(OH)2 + 2 CH3COONa, b(CH3COO)2 + 2NaOH Pb(OH)2 + 2 CH3COONa,P  b(OH)2 + 2NaOH Na2PbO2 + H2O, b(OH)2 + 2NaOH Na2PbO2 + H2O, N  a2S + Na2PbO2 + 2H2O PbS + 4NaOH. a2S + Na2PbO2 + 2H2O PbS + 4NaOH.Оформление опыта: сделать вывод и написать уравнение реакции. Опыт 3. Ксантопротеиновая реакция белков. Принцип метода. Эта реакция используется для обнаружения a-аминокислот, содержащих ароматические радикалы. Тирозин, триптофан, фенилаланин при взаимодействии с концентрированной азотной кислотой образуют нитропроизводные, имеющие желтую окраску. В щелочной среде нитропроизводные этих a-аминокислот дают соли, окрашенные в оранжевый цвет. Желатин, например, не содержащий ароматических аминокислот, не дает ксантопротеиновой пробы. Порядок выполнения работы. К 1 мл 10 %-го раствора белка куриного яйца добавляют 0,5 мл концентрированной азотной кислоты. В результате коагуляции белка в содержимом пробирки образуется белый осадок или помутнение. При нагревании раствор и осадок окрашиваются в ярко-желтый цвет. При этом осадок почти полностью растворяется в результате гидролиза. После охлаждения добавляют 1–2 мл 20%-го раствора гидроксида натрия (до появления оранжевой окраски раствора). Рассмотрим механизм ксантопротеиновой реакции по радикалу тирозина: Рассмотрим механизм ксантопротеиновой реакции по радикалу тирозина: 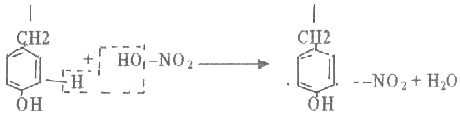 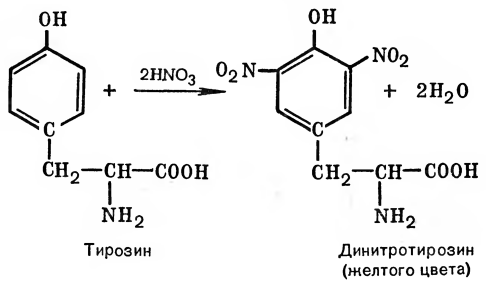 Химизм реакции: 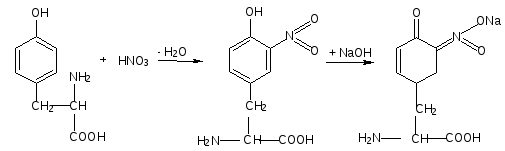
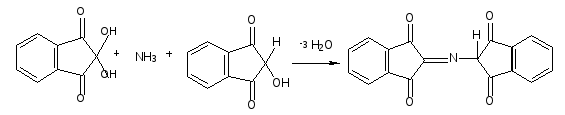
Оформление опыта: сделать вывод и написать уравнение реакции. Опыт 4. Реакция Адамкевича (на присутствие в белках триптофана). Принцип метода. Белки, содержащие триптофан, в присутствии глиоксиловой и серной кислот дают красно-фиолетовое окрашивание. Реакция основана на способности триптофана взаимодействовать в кислой среде с альдегидами глиоксиловой кислоты (являющейся примесью к концентрированной уксусной кислоте) с образованием окрашенных продуктов конденсации. Реакция протекает по уравнению: 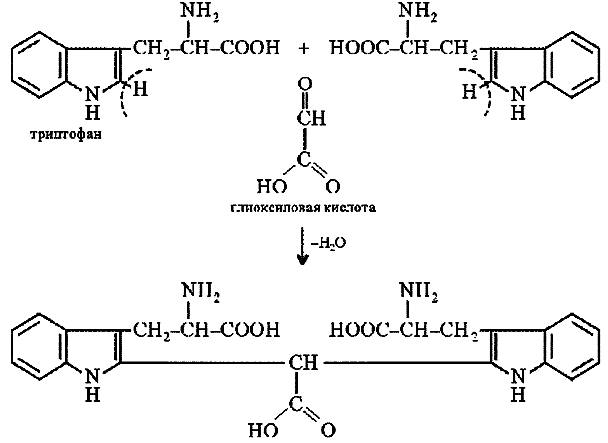 Желатин не дает этой реакции, т.к. он не содержит триптофана. Окраска возникает за счет реакции триптофана с глиоксиловой кислотой, всегда присутствующей в уксусной кислоте в виде примеси. Эту же реакцию на триптофан можно провести, используя вместо уксусной кислоты формальдегид 2,5%-ный раствор концентрированной H2SO4. Раствор перемешать и через 2-3 мин. добавить при взбалтывании 10 капель 5%-ного нитрита натрия. Развивается интенсивно-фиолетовое окрашивание, на этом основан принцип метода реакции. Порядок выполнения работы. В пробирку наливают несколько капель неразбавленного белка и прибавляют 2 мл. ледяной уксусной кислоты и несколько капель глиоксиловой кислоты. Смесь слегка нагревают до растворения образующегося осадка, охлаждают и, сильно наклонив пробирку, осторожно по стенке приливают концентрированную H2SO4 так, чтобы обе жидкости не смешивались. Через 5-10 минут на границе раздела двух слоев наблюдают образование красно-фиолетового кольца. Оформление опыта: сделать вывод и написать уравнение реакции. Опыт 5. Нингидриновая реакция. Принцип метода. a-Аминокислоты реагируют с нингидрином, образуя сине-фиолетовый комплекс (пурпур Руэманна), интенсивность окраски которого пропорциональна количеству аминокислоты. Реакция идет по схеме: 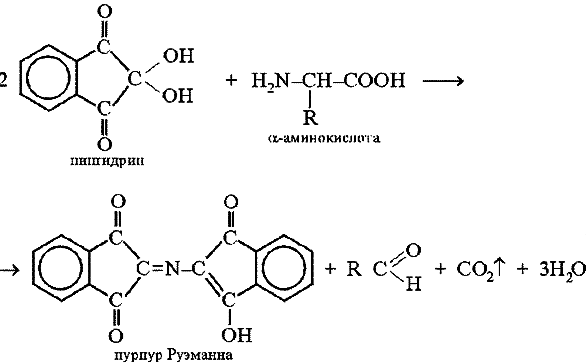 Химизм реакции: 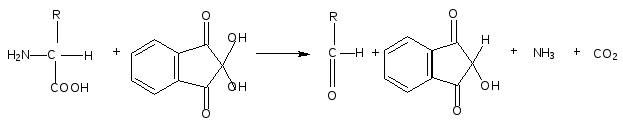
Реакция с нингидрином используется для визуального обнаружения a-аминокислот на хроматограммах (на бумаге, в тонком слое), а также для колориметрического определения концентрации аминокислот по интенсивности окраски продукта реакции. Продукт этой реакции содержит в своем составе радикал (R) исходной аминокислоты, который обусловливает различную окраску: голубую, красную, и т.д. соединений, возникающих при реакции аминокислот с нингидрином. В настоящее время нингидриновая реакция широко используется как для открытия отдельных аминокислот, так и для определения их количества. Порядок выполнения работы. В пробирку наливают 1 мл 1-10%-го разбавленного раствора белка куриного яйца и 1-2 мл 1%-го раствора нингидрина в ацетоне. Содержимое пробирки перемешивают и в течение 2-3 мин осторожно нагревают на водяной бане до появления сине-фиолетового окрашивания, свидетельствующее о присутствии в белке α-аминокислот. Оформление опыта: сделать вывод и написать уравнение реакции. Опыт 6. Реакция Сакагучи. Принцип метода. Эта реакция на аминокислоту аргинин основана на взаимодействии аргинина с a-нафтолом в присутствии окислителя. Ее механизм еще полностью не выяснен. По-видимому, реакция осуществляется по следующему уравнению: 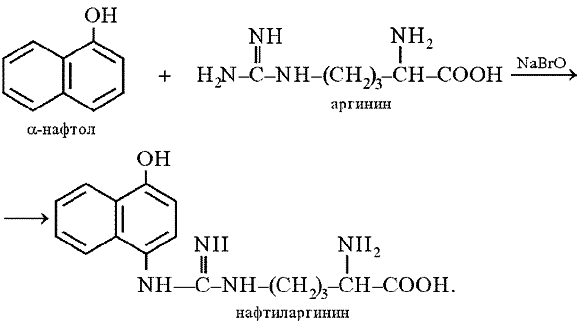 Поскольку производные хинониминов (в данном случае нафтохинона), у которых водород иминогруппы –NH– замещен на алкильный или арильный радикал, всегда окрашены в желто-красные тона, то, по-видимому, оранжево-красный цвет раствора при проведении реакции Сакагучи объясняется возникновением именно производного нафтохинонимина. Не исключена, однако, вероятность образования еще более сложного соединения за счет дальнейшего окисления оставшихся NH-групп аргининового остатка и бензольного ядра a-нафтола: Порядок выполнения работы. К 2 мл. 1%-го разбавленного раствора белка куриного яйца добавляют 2 мл. 10%-го гидроксида натрия (NaOH) и несколько капель 0,2%-ного спиртового раствора α-нафтола. Содержимое пробирки хорошо перемешивают. Затем приливают 0,5 мл. гипобромита натрия (NaBrO) или гипохлорита натрия (натрий хлорноватистокислый – NaOCl), перемешивают. Тотчас появляется красное, постепенно усиливающееся окрашивание. Немедленно добавляют 1 мл 40%-го раствора мочевины для стабилизации, быстро развивающегося оранжево-красного окрашивания. Эта реакция характерна для соединений, содержащих остаток гуанидина N  H = C –NH2, H = C –NH2, NH2 и указывает на присутствие в белковой молекуле аминокислоты-аргинина:  NH = C –NH – (CH2)3 –CH –COOH NH = C –NH – (CH2)3 –CH –COOH NH2 NH2 Оформление опыта: сделать вывод и написать уравнение реакции. Реакции осаждения белков Известно, что белки в растворе сохраняются в природном состоянии за счёт факторов устойчивости, к которым относятся заряд белковой молекулы и гидратная (водная) оболочка вокруг нее. Удаление этих факторов приводит к склеиванию этих молекул белка и выпадению в осадок. Осаждение белков может быть обратимым и необратимым в зависимости от природы используемых реактивов. Обратимое осаждение – при этом процессе под воздействием факторов осаждения белки выпадают в осадок, но после прекращения действия этих факторов белки вновь переходят в растворимое состояние и приобретают свои нативные свойства. Одним из видов обратимого осаждения белков является высаливание. Необратимое осаждение белков связано с глубокими нарушениями структуры белков (вторичной и третичной) и потерей ими нативных свойств. Такие изменения белков можно вызвать кипячением, действием концентрированных растворов минеральных и органических кислот, солями тяжелых металлов. Для высаливания белков используют соли щелочных и щелочноземельных металлов (наиболее часто в практике используют сульфат натрия и аммония). Эти соли удаляют водную оболочку (вызывают обезвоживание) и снимают заряд. Между величиной водной оболочки белковых молекул и концентрацией солей существует прямая зависимость: чем меньше гидратная оболочка, тем меньше требуется солей. Так, глобулины, имеющие крупные и тяжелые молекулы и небольшую водную оболочку, выпадают в осадок при неполном насыщении раствора солями, а альбумины как более мелкие молекулы, окруженные большой водной оболочкой, – при полном насыщении. Денатурация белка (необратимое осаждение) сводится к разрушению третичной и частично вторичной структуры белковой молекулы врезультате разрыва водородных связей и потере им биологических или нативных свойств. При необратимых реакциях осаждения белки претерпевают глубокие изменения и не могут быть растворимы в первоначальном растворителе. К необратимым реакциям относятся осаждение белка солями тяжелых металлов, минеральными и органическими кислотами, алкалоидными реактивами и осаждение при кипячении. Опыт 1. Высаливание белков сульфатом аммония. Принцип метода. Высаливание – это добавление к раствору белка нейтральных солей (Na2SO4, (NH4)2SO4). Механизм высаливания заключается во взаимодействии анионов (SO42–) и катионов (Na+, NH4+) с зарядами белка (группы NH4+ и COO–). В результате заряд исчезает, и соответственно, исчезает взаимоотталкивание молекул. Одновременно резко уменьшается гидратная оболочка. Все это приводит к «слипанию» молекул и осаждению. Насыщенным раствором сульфата аммония осаждается альбуминовая фракция белков, полунасыщенным раствором – глобулиновая фракция. Сущность реакции заключается в дегидратации молекул белка. Порядок выполнения работы. В пробирку наливают 30 капель неразведённого яичного белка и добавляют равное количество насыщенного раствора сульфата аммония. Содержимое пробирки перемешивают. При этом осаждается альбуминовая фракция белков. Получают полунасыщенный раствор сульфата аммония и также смешивают (1:1) с яичным белком, при этом глобулиновая фракция осаждается, а альбуминовая остается в растворе. Последнюю отфильтровывают, затем смешивают с порошком сульфата аммония до тех пор, пока не прекратится растворение соли, при этом выпадает осадок – альбумины. К образовавшимся осадкам (глобулинов и альбуминов) добавляют воду и наблюдают их растворение. Это доказывает, что высаливание – процесс обратимый. Оформление опыта: полученные результаты опыта записать в тетрадь и сделать вывод. |
