Лабораторная работа послед. Лабораторная работа 9 Ферментативный гидролиз крахмала Название опыта Уравнение основной реакции
 Скачать 0.86 Mb. Скачать 0.86 Mb.
|
|
Лабораторная работа №9 Ферментативный гидролиз крахмала
Лабораторная работа №10 Открытие каталазы
Ответы на вопросы 1) ФЕРМЕНТЫ (латинский fermentum брожение, бродильное начало; синоним энзимы) — специфические белки, способные во много раз ускорять химические реакции, протекающие в живых организмах, не входя при этом в состав конечных продуктов реакции, то есть являющиеся биологическими катализаторами. Все химические реакции, происходящие в микроорганизмах, в растительных и животных организмах, катализируются соответствующими ферментами. 2) По химической природе ферменты являются белками и подразделяются на простые и сложные. Простые ферменты при гидролизе расщепляются до аминокислот. Примеры простых ферментов: трипсин, уреаза, рибонуклеаза. Большинство природных ферментов относится к сложным белкам, содержащим кроме белкового компонента, называемого апоферментом, и небелковую часть - кофактор. Апофермент и кофактор отдельно друг от друга не могут обеспечивать катализ химической реакции. Объединение их дает активную молекулу фермента - холофермент. Кофакторы могут быть неорганической природы (представлены ионами металлов Zn2+, Mg2+, Fe2+, Cu2+ и др.) и органической природы (коферменты, которые в большинстве случаев в своей структуре содержат остатки водорастворимых витаминов, например тиаминпирофосфат содержит остаток витамина В1, флавинмононуклеотид и флавинадениндинуклеотид - остаток витамина В2, кофермент ацилирования - остаток витамина В3, никотинамидадениндинуклеотид и никотинамидадениндинуклеотидфосфат - остаток витамина В5, пиридоксальфосфат - остаток витамина В6). 3) Ферменты-протеины (простые). Ферменты-протеины состоят из АК, называются однокомпонентными (к ним относятся L-амилаза, альдолаза и др.) Пример использования альдолазы: 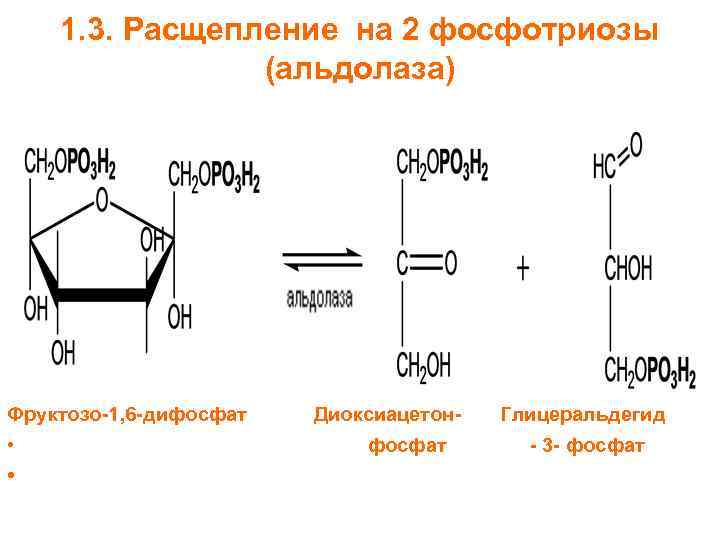 4) Ферменты-протеиды – состоят из белковой части (апофермента) и небелковой – кофермента; их называют двухкомпонентными. Примеры: Цинксодержащая карбоангидраза и различные супероксиддисмутазы, содержащие в качестве активных центров ионы меди, марганца, железа и других металлов.  5) КОФЕРМЕНТЫ (син. коэнзимы) — низкомолекулярные органические соединения биологического происхождения, необходимые в качестве дополнительных специфических компонентов (кофакторов) для осуществления каталитического действия ряда ферментов. Многие К. представляют собой производные витаминов. Примеры коферментов: Тиаминдифосфат (ТДФ): 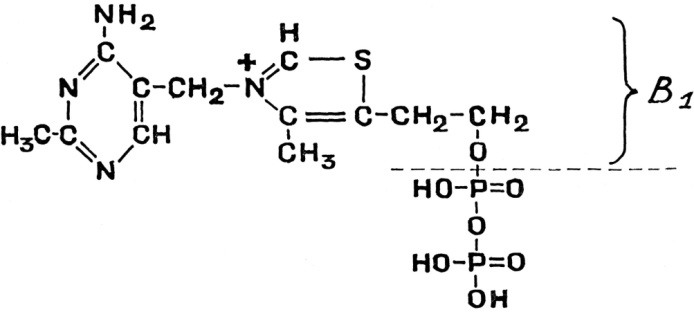 Биотин (витамин H): 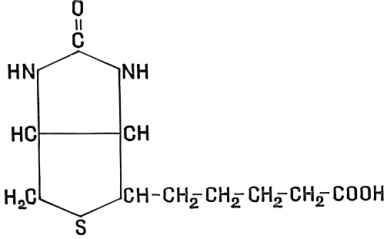 Кофермент A: 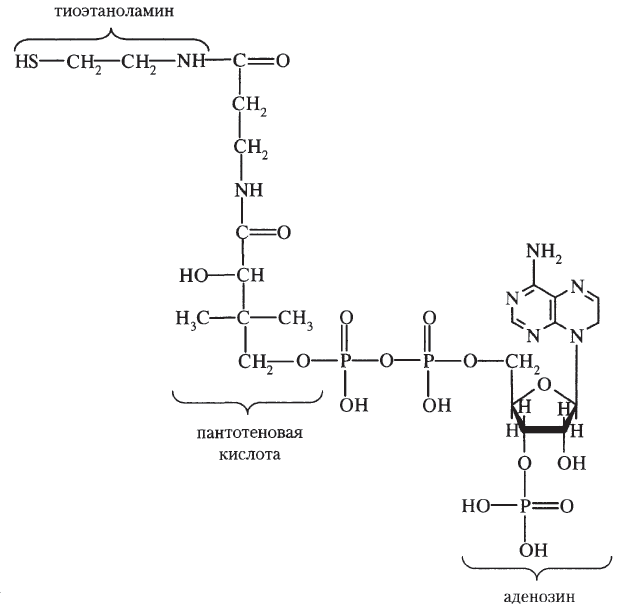 6) Кофактор — небольшое небелковое (и не производное от аминокислот) соединение (часто ион металла), которое присоединяется к функциональному участку белка и участвует в его биологической деятельности[1]. Такие белки обычно являются ферментами, поэтому кофакторы называют «молекулами-помощниками», которые участвуют в биохимических превращениях. Кофакторы классифицируются на неорганические ионы и комплексные органические молекулы, называемые коферментами. Многие двухвалентные металлы (Mg2+, Мn2+, Са2+), также выполняют роль кофакторов Гем 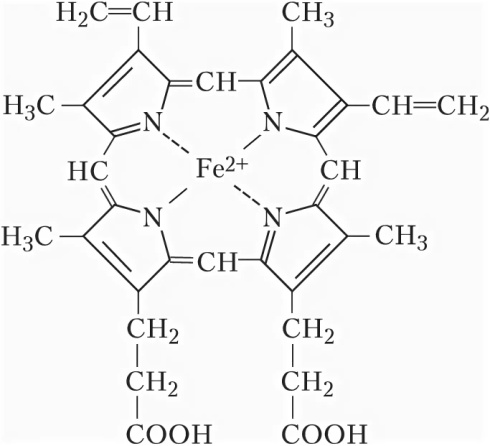 Аденозинтрифосфат 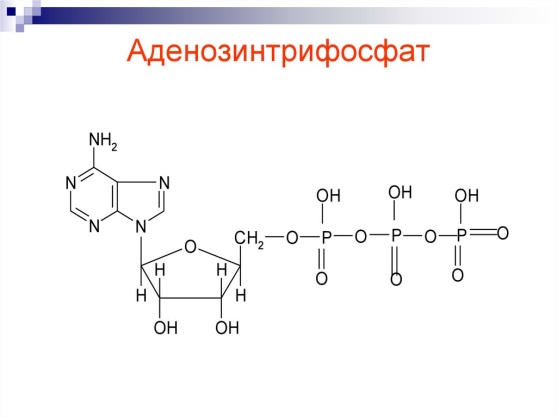 Цитидинтрифосфат 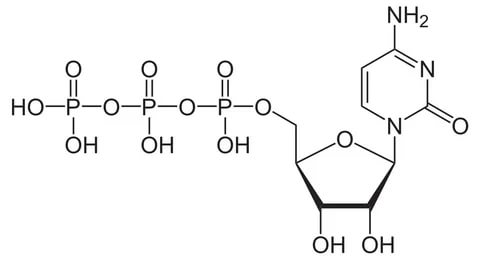 7) Ключевое различие между простетической группой и коферментом заключается в том, что протезная группа плотно связывается с ферментом, чтобы помочь ферменту, в то время как кофермент свободно связывается с ферментом, чтобы поддерживать его каталитическую функцию. Протезные группы могут быть органическими молекулами или ионами металлов, тогда как коферменты являются полностью органическими молекулами. 8) Активность ферментов может быть усилена, ослаблена или подавлена за счет влияния ряда факторов (температуры, рН, наличия активаторов и ингибиторов, концентрации субстрата и фермента). Температура. С повышением температуры скорость всех ферментативных реакций увеличивается. Оптимальная температура для действия большинства животных ферментов находится в интервале 40-50 0С, растительных __ 40-60 °С. При более высоких температурах активность снижается, и многие ферменты разрушаются уже при температуре 70-80 °С. Это явление называется тепловой инактивацией и происходит из-за тепловой денатурации белков. При низких температурах активность ферментов также снижается, но они не разрушаются. Влияние рН.Каждый фермент проявляет свое действие в определенных, довольно узких пределах значений рН. Различные ферменты отличаются друг от друга по оптимальным величинам рН. Для большинства гидролитических ферментов оптимум рН находится в интервале 3-6. Присутствие активаторов и ингибиторов. Активность ферментов зависит от наличия в реакционной среде различных соединений.Вещества, которые повышают каталитическую активность ферментов, называются активаторами. В качестве активаторов могут выступать ионы металлов (натрия, калия, магния, кальция, цинка, меди, марганца, железа) и другие вещества (ионы йода, брома, хлора, SH-группы). Концентрация субстрата и фермента. Скорость большинства ферментативных реакций прямо пропорциональна концентрации фермента (рис.14) в реакционной смеси (концентрация субстрата при этом постоянна).  Зависимость скорости реакции от концентрации субстрата (рис.15) (концентрация фермента неизменна) выражается гиперболической кривой. При низких концентрациях субстрата скорость реакции растет прямо пропорционально его концентрации, при высоких концентрациях __ не зависит от нее. Максимальной скорости реакции можно достичь в случае насыщения активных центров фермента субстратом. Зависимость скорости реакции от концентрации субстрата (рис.15) (концентрация фермента неизменна) выражается гиперболической кривой. При низких концентрациях субстрата скорость реакции растет прямо пропорционально его концентрации, при высоких концентрациях __ не зависит от нее. Максимальной скорости реакции можно достичь в случае насыщения активных центров фермента субстратом.9) Под специфичностью ферментов понимают способность каждого из них катализировать одну или несколько близких по природе химических реакций. Это одно из важнейших биологических явлений, без которого невозможен упорядоченный обмен веществ в живом организме, а следовательно, и сама жизнь. Различают два вида специфичности ферментов: Каталитическая специфичностьи субстратная специфичность. Каталитическая специфичность–это способность фермента катализировать только строго определенный тип химической реакции. Если субстрат может вступать в разные реакции, то для каждой реакции нужен свой фермент. . Таким образом, каждый фермент катализирует только одну из всех возможных реакций, в которые может вступать субстрат. Специфичность действия определяется в основном особенностями строения каталитического участка активного центра фермента. Субстратная специфичность – способность фермента действовать только на определенные субстраты. Различают две разновидности субстратной специфичности: абсолютную и относительную. Фермент, обладающий абсолютной субстратной специфичностью, катализирует превращения только одного субстрата. На другие вещества, даже очень близкие по строению к этому субстрату, фермент не действует. Примером фермента с абсолютной субстратной специфичностью является аргиназа – фермент, отщепляющий от аминокислоты аргинина мочевину. Аргинин – единственный субстрат аргиназы. Относительная (групповая) субстратная специфичность – это способность фермента катализировать превращения нескольких похожих по строению веществ. Обычно эти вещества обладают одним и тем же типом химической связи и одинаковой структурой одной из химических группировок, соединенных этой связью. Например, фермент пепсин расщепляет пептидные связи в белках любого строения. Субстратная специфичность обусловлена, главным образом, структурой адсорбционного участка активного центра фермента. 10. Под субстратной специфичностью понимается способность каждого фермента взаимодействовать лишь с одним или несколькими определенными субстратами. Различают: 1. Абсолютная субстратная специфичность:  2. Групповая субстратная специфичность:  3. В организме человека наблюдается специфичность ферментов к следующим стереоизомерам: 1) к D-сахарам; 2) цис-транс-изомерам; 3) к L-аминокислотам; 4) к α- и β-гликозидным связям. Стереоспецифичность к D-сахарам:  11.  12. Абсолютная субстратная специфичность:   13. Групповая субстратная специфичность:   14. Стереоспецифичность к D-сахарам:   У кислорода это минус в степени 15. Активный центр – участок молекулы фермента, который связывает субстраты и от которого зависит специфичность каталитического действия ферментов; активный центр содержит функциональные группы остатков аминокислот и коферментов, пространственно сближенных и определённым образом ориентированных. 16. еория Фишера (модель "жесткой матрицы", "ключ-замок") – активный центр фермента строго соответствует конфигурации субстрата и не изменяется при его присоединении. Эта модель хорошо объясняет абсолютную специфичность, но не групповую.  Схематичное представление теории Фишера |