Лабораторная работа Основные классы неорганических соединений
 Скачать 2.63 Mb. Скачать 2.63 Mb.
|
Опыт 4. Действие щелочи на металлыВ две пробирки налить по 2–3 мл концентрированного раствора щелочи. В одну из них насыпать небольшое количество цинковых опилок, в другую – алюминиевого порошка. Если реакция не идет, слегка нагреть. Когда начнется интенсивное выделение газа, поднести к отверстиям пробирок зажженную лучинку. Что наблюдается? Требования к результатам опыта 1. Составить уравнения реакций взаимодействия цинка и алюминия с раствором щелочи. 2. Сделать вывод, какие металлы реагируют со щелочами. Задачи и упражнения для самостоятельного решения 14.1. Закончить и уравнять реакции: а) Ba + H2O = …; б) Sn + NaOH + H2O = …; в) Sn + HNO3 (разб.) = …; г) Hg + H2SO4 (конц.) = …. 14.2. Закончить и уравнять реакции: а) Cd + H2SO4 (разб.) = …; б) Be + NaOH + H2O = …; в) Bi + HNO3 (конц.) = …; г) Li + H2O = …. 14.3. Какие из перечисленных металлов (Mg, Mn, Hg, Au, Al, Cd, Ag) растворяются в разбавленной H2SO4? Написать уравнения реакций. 14.4. Закончить и уравнять реакции: а) Mg + HNO3 (разб.) = …; б) Sn + KOH + H2O = …; в) Ni + H2SO4 (конц.) = …; г) W + HNO3 + HF = H2[WF8] + …. 14.5. Закончить и уравнять реакции: а) Ga + NaOH + H2O = …; б) Bi + HNO3 (разб.) = …; в) La + H2O =* …; г) Co + H2SO4 (конц.) = …. *Электродный потенциал лантана –2,55 В. 14.6. Закончить и уравнять реакции: а) Rb + H2O = …; б) W + Na2CO3 + NaNO3 в) Be + KOH + H2O = …; г) Sn + HCl = …. 14.7. Закончить и уравнять реакции: а) Pb + NaOH + H2O = …; б) Fe + O2 = …; в) Ni + HNO3 (конц.) = …; г) La + H2SO4 (разб.) =* …. * Электродный потенциал лантана –2,55 В. 14.8. Закончить и уравнять реакции: а) Ga + H2SO4 (разб.) =* …; б) Cd + HNO3 (конц.) = …; в) Sr + H2O =* …; г) Al + C * Электродный потенциал стронция –2,88 В, галлия –0,53 В. 14.9. Закончить и уравнять реакции: а) Mn + HNO3 (разб.) = …; б) Al + KOH + H2O = …; в) Ca + H2O = …; г) Fe + H2SO4 (разб.) = …. 14.10. Закончить и уравнять реакции: а) Ta + HNO3 + HF = H2[TaF7] + …; б) Cs + H2O = …; в) Ag + HNO3 (разб.) = …; г) Al + HCl = …. 14.11. Закончить и уравнять реакции: а) Zr + HNO3 + HCl = ZrCl4 + …; б) Rb + H2O = …; в) Mn + HNO3 (конц.) = …; г) Sn + KOH + H2O = …. 14.12. Закончить и уравнять реакции: а) Mo + NaNO3 + NaOH в) Ni + H2SO4 (конц.) = …; г) Mg + H2O 14.13. Закончить и уравнять реакции: а) Na + H2 = …; б) Zn + CH3COOH = …; в) Sn + H2SO4 (конц.) = …; г) Ca + HNO3 (оч. разб.) = …. 14.14. Закончить и уравнять реакции: а) Hg + HNO3 + HCl = HgCl2 + …; б) Co + HNO3 (конц.) = …; в) K + H2O = … ; г) Sc + H2SO4 (разб.) =* …. * Электродный потенциал скандия –2,01 В. 14.15. Какие из перечисленных металлов (Cu, Ca, Hg, Au, Fe, Cr, Ag, Al) растворяются в HCl? Написать уравнения реакций. 14.16. Закончить и уравнять реакции: а) Nb + HNO3 + HF = H2[NbF7] + …; б) Li + N2 = …; в) Pb + KOH + H2O = …; г) Fe + HNO3 (разб.) = …. 14.17. Закончить и уравнять реакции: а) V + KOH + O2 в) Ag + H2SO4 (конц.) 14.18. Закончить и уравнять реакции: а) Pt + HNO3 + HCl = H2[PtCl6] + …; б) Fe + H2SO4 (конц.) в) Al + S 14.19. Закончить и уравнять реакции: а) Fe + Cl2 = …; б) Be + KOH + H2O = …; в) Cd + HNO3 (разб.) = …; г) Sn + H2SO4 (разб.) = …. 14.20. Закончить и уравнять реакции: а) Ca + H2 = …; б) Mn + HCl = …; в) Mo + Na2CO3 + NaNO3 Лабораторная работа 15 Комплексные соединения Цель работы: получить представление о комплексных соединениях, их строении, комплексообразователях, лигандах, координационном числе, научиться составлять уравнения реакций с участием комплексных соединений. Задание: получить комплексные соединения меди, ртути, серебра; проделать окислительно-восстановительные реакции и реакции обмена с участием комплексных соединений. Выполнить требования к результатам опытов, оформить отчет, решить задачу. Теоретическое введение Соединения, в состав которых входят комплексные ионы, способные существовать как в кристаллах, так и в растворах, называются комплексными. Комплексные соединения могут быть получены при взаимодействии нейтральных молекул: Fe(CN)3 + 3KCN = K3[Fe(CN)6]; BF3 + KF = K[BF4]. В молекуле комплексного соединения один атом или ион, обычно положительно заряженный, занимает центральное место и называется комплексообразователем. В непосредственной близости к нему расположены или координированы противоположно заряженные ионы или нейтральные молекулы, называемые лигандами. Комплексообразователь и лиганды образуют внутреннюю сферу комплексного соединения. Число лигандов, расположенных вокруг комплексообразователя, называется координационным числом. Чаще всего координационное число равно 6, 4 и 2. В формулах комплексных соединений внутреннюю сферу обозначают квадратными скобками. Все остальные ионы, не вошедшие во внутреннюю сферу, составляют внешнюю сферу. При растворении в воде комплексные электролиты диссоциируют на внутреннюю и внешнюю сферу: [Ag(NH3)2]Cl ↔ [Ag(NH3)2]+ + Cl‾. Наряду с этим происходит и другой процесс, хотя в значительно меньшей степени: [Ag(NH3)2]+ ↔ Ag+ + 2NH3. Здесь диссоциация протекает обратимо и равновесие резко сдвинуто влево. Константа диссоциации комплексного иона 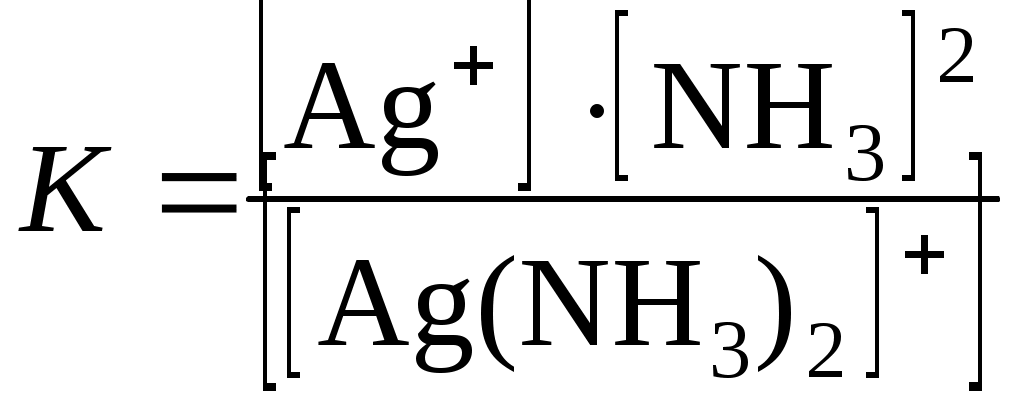 называется константой нестойкости (Кн). Она характеризует устойчивость комплекса. Чем меньше константа нестойкости, тем прочнее комплексный ион в растворе. |
