Лабораторная работа Основные классы неорганических соединений
 Скачать 2.63 Mb. Скачать 2.63 Mb.
|
Лабораторная работа 2Определение молярной массы эквивалентов цинкаЦель работы: изучить понятия «эквивалент», «молярная масса эквивалентов» и закон эквивалентов. Задание: провести реакцию взаимодействия цинка с соляной кислотой и определить объем выделившегося водорода. На основании полученных данных вычислить массу водорода и молярную массу эквивалентов цинка. Выполнить требования к результату работы, оформить отчет, решить задачу. Теоретическое введение Эквивалент (Э) – это реальная или условная частица вещества, соответствующая одному иону водорода в кислотно-основных или ионообменных реакциях, или одному электрону в окислительно-восстановительных реакциях. Под реальной частицей понимают реально существующие соединения (NaOH, H2SO4, H2O), под условной – доли этих реальных частиц (½ H2SO4, ½ H2O). Эквивалент – безразмерная величина, состав которой выражают с помощью знаков и формул. Например, Э (NaOH) = NaOH; Э (H2SO4) = ½ H2SO4; Э (MgCl2) = ½ MgCl2; Э (Са) = ½ Са. Единицей количества вещества эквивалентов является моль. Моль эквивалентов – это количество вещества, содержащего 6,02×1023 эквивалентов. Масса одного моля эквивалентов называется молярной массойэквивалентов(Mэк)и выражаетсяв г/моль. При определении молярной массы эквивалентов необходимо исходить из конкретной реакции, в которой участвует данное вещество. Молярная масса эквивалентов вещества В, участвующего в окислительно-восстановительной реакции, рассчитывается по формуле где МВ – молярная масса вещества В; nē – число электронов, присоединенных одной молекулой окислителя или отданных одной молекулой восстановителя. Например, в реакции Mg0 + 2H+Cl = Mg+2Cl2 + H20 степень окисления магния изменяется от 0 до +2. Следовательно, магний теряет 2 электрона, т.е. одному электрону эквивалентна условная частица ½ атома Mg: Э (Mg) = ½ Mg ; Мэк (Mg) = У водорода степень окисления меняется от +1 до 0, а т.к. молекула водорода состоит из двух атомов, то число принятых электронов будет равно 2. Таким образом, одному электрону эквивалентна условная частица ½ молекулы Н2: Э (Н2) = ½ Н2 ; Мэк (Н2) = Закон эквивалентов: массы реагирующих друг с другом веществ пропорциональны их молярным массам эквивалентов: Выполнение работыОпределение молярной массы эквивалентов цинка проводится в приборе, изображенном на рисунке. 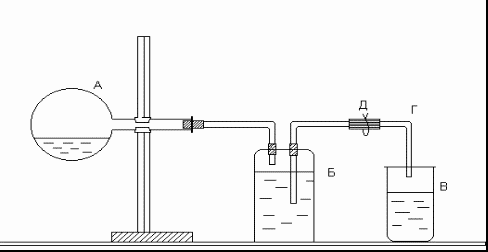 Рис. Прибор для определения молярной массы эквивалентов цинка Прибор состоит из трех частей: колбы А, двугорлой склянки Вульфа Б и приемника В. Отверстия двугорлой склянки закрываются резиновыми пробками, через которые проходят стеклянные трубки: короткая, оканчивающаяся сразу под пробкой, и длинная, доходящая почти до дна склянки. Короткая стеклянная трубка соединяется резиновой трубкой с колбой А, а длинная − со стеклянной трубкой Г, опущенной в приемник В. Работу следует выполнять в следующем порядке. В колбу налить 10–15 мл соляной кислоты. Закрепить колбу в горизонтальном положении. Получить у преподавателя навеску цинка и поместить ее в сухое горло колбы. Закрыть колбу резиновой пробкой и проверить герметичность прибора. Для этого открыть зажим Д и с помощью резиновой груши вдуть воздух в прибор через стеклянную трубку Г. В приборе создается избыточное давление, вследствие чего вода из трубки Г вытекает. Когда давление внутри прибора станет равным атмосферному, вода из трубки перестанет течь. Закрыть зажим Д. Если вода из трубки Г не уходит, прибор герметичен. Воду из приемника вылить и поставить его под трубку Г. Наклонить колбу так, чтобы навеска цинка упала в кислоту, и открыть зажим. Водород, выделившийся при взаимодействии металла с кислотой, вытесняет воду из склянки Б в приемник В. Когда весь металл растворится, закрыть зажим, осторожно вынуть из приемника трубку Г (следить, чтобы из нее не вылилась вода) и измерить мерным цилиндром объем воды в приемнике. Этот объем равен объему водорода, выделившегося при взаимодействии цинка с кислотой. Записать показания барометра и термометра. Требования к результатам работы Исходные данные и результаты расчетов занести в табл. 2.1. |
