Лабораторная работа Основные классы неорганических соединений
 Скачать 2.63 Mb. Скачать 2.63 Mb.
|
Таблица 2.1Данные опыта и результаты расчетов
Вычислить (все вычисления пояснить словами): 1. Массу выделившегося объема водорода, пользуясь уравнением Менделеева – Клапейрона: где P – парциальное давление водорода, кПа; V – объем выделившегося водорода, л; m – масса водорода, г; M – молярная масса водорода, г/моль; Т – температура опыта, К; R – универсальная газовая постоянная, равная 8,314 Дж/(моль·К). В нашем опыте водород собирается над водой, содержит водяной пар, поэтому для вычисления парциального давления водорода нужно из величины атмосферного давления вычесть величину давления насыщенного водяного пара при температуре опыта (табл. 2.2): Р = Р1 – Р2. 2. Молярную массу эквивалентов цинка Мэк.пр.(Zn) по закону эквивалентов: 3. Теоретическое значение молярной массы эквивалентов цинка Мэк,т.(Zn): Мэк,т.(Zn) = 4. Относительную ошибку опыта Е (%): Таблица 2.2 Давление насыщенного водяного пара при различных температурах
Примеры решения задач Пример 2.1. Рассчитать эквивалент и молярную массу эквивалентов H2S и NaOH в реакциях: H2S + 2NaOH = Na2S + 2H2O; (1) H2S + NaOH = NaHS + H2O. (2) Решение. Молярная масса эквивалентов кислоты или основания, участвующихв кислотно-основной реакции, рассчитывается по формуле Мэк (кислоты, основания) = где М – молярная масса кислоты или основания; n – для кислот – число атомов водорода, замещенных в данной реакции на металл; для оснований – число гидроксильных групп, замещенных в данной реакции на кислотный остаток. Значение эквивалента и молярной массы эквивалентов вещества зависит от реакции, в которой это вещество участвует. В реакции H2S + 2NaOH = Na2S + 2H2O (1) оба иона водорода молекулы H2S замещаются на металл и, таким образом, одному иону водорода эквивалентна условная частица ½ H2S. В этом случае Э (H2S) = ½ H2S, а Мэк (H2S)= В реакции H2S + NaOH = NaHS + H2O (2) в молекуле H2S на металл замещается только один ион водорода и, следовательно, одному иону Э (H2S) = H2S, а Мэк (H2S) = Эквивалент NaOH в реакциях (1) и (2) равен NaOH, так как в обоих случаях на кислотный остаток замещается одна гидроксильная группа. Молярная масса эквивалентов NaOH равна Мэк (NaOH) = 40 г/моль. Таким образом, эквивалент H2S в реакции (1) равен ½ H2S, в реакции (2) − 1 H2S, молярные массы эквивалентов H2S равны соответственно 17 (1) и 34 (2) г/моль; эквивалент NaOH в реакциях (1) и (2) равен NaOH, молярная масса эквивалентов основания составляет 40 г/моль. Пример 2.2. Рассчитать эквивалент и молярную массу эквивалентов оксидов P2O5 и CaO в реакции P2O5 + 3CaO = Ca3(PO4)2. Решение. Молярная масса эквивалентов оксида рассчитывается по формуле Мэк (оксида) = где М – молярная масса оксида; n – число катионов соответствующего оксиду основания или число анионов соответствующей оксиду кислоты; |c.o.| – абсолютное значение степени окисления катиона или аниона. В реакции P2O5 + 3CaO = Ca3(PO4)2 эквивалент P2O5, образующего два трехзарядных аниона (РО4)3-, равен 1/6 P2O5, а Мэк (P2O5) = Пример 2.3. Вычислить эквивалент и молярную массу эквивалентов фосфора в соединениях РН3, Р2О3 и Р2О5. Решение. Чтобы определить молярную массу эквивалентов элемента в соединении, можно воспользоваться следующей формулой: Мэк (элемента) = где МА – молярная масса элемента; |c.o.| – абсолютное значение степени окисления элемента. Степень окисления фосфора в РН3, Р2О3, Р2О5 соответственно равна –3, +3 и +5. Подставляя эти значения в формулу, находим, что молярная масса эквивалентов фосфора в соединениях РН3 и Р2О3 равна 31/3 = 10,3 г/моль; в Р2О5 – 31/5 = 6,2 г/моль, а эквивалент фосфора в соединениях РН3 и Р2О3 равен 1/3 Р, в соединении Р2О5 – 1/5 Р. Пример 2.4. Рассчитать молярную массу эквивалентов соединений фосфора РН3, Р2О3 и Р2О5. Решение. Молярная масса эквивалентов химического соединения равна сумме молярных масс эквивалентов составляющих его частей: Мэк (РН3) = Мэк (Р) + Мэк (Н) = 10,3 + 1 = 11 г/моль; Мэк (Р2О3) = Мэк (Р) + Мэк (О) = 10,3 + 8 = 18,3 г/моль; Мэк (Р2О5) = Мэк (Р) + Мэк (О) = 6,2 + 8 = 14,2 г/моль. Пример 2.5. На восстановление 7,09 г оксида металла со степенью окисления +2 требуется 2,24 л водорода при нормальных условиях. Вычислить молярные массы эквивалентов оксида и металла. Чему равна молярная масса металла? Решение. Задача решается по закону эквивалентов. Так как одно из реагирующих веществ находится в газообразном состоянии, то удобно воспользоваться следующей формулой:  , ,где Vэк (газа) – объем одного моля эквивалентов газа. Для вычисления объема моля эквивалентов газа необходимо знать число молей эквивалентов (υ) в одном моле газа: υ = Подставив в формулу 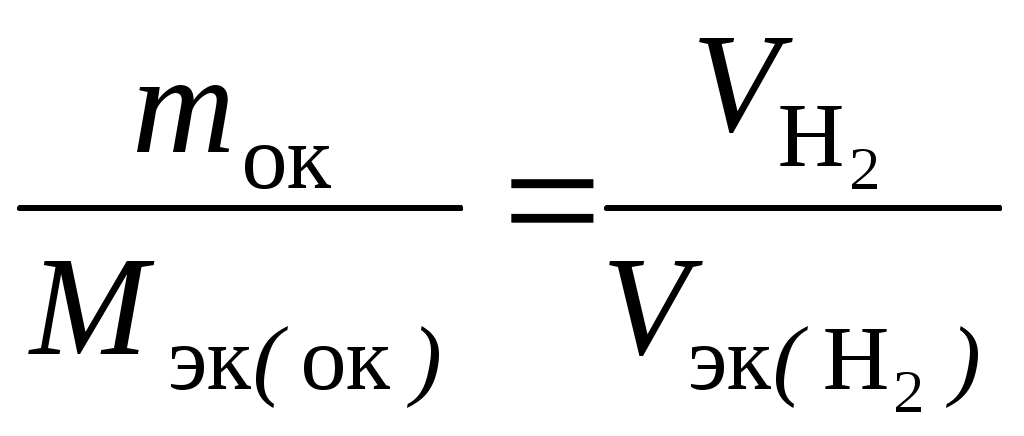 численные значения, находим, что Мэк (оксида) = численные значения, находим, что Мэк (оксида) =Молярная масса эквивалентов химического соединения равна сумме молярных масс эквивалентов составляющих его частей. Оксид – это соединение металла с кислородом, поэтому молярная масса эквивалентов оксида представляет собой сумму Мэк (оксида) = Мэк (металла) + Мэк (кислорода). Отсюда Мэк (металла) = Мэк (оксида) − Мэк (кислорода) = 35,45 – 8 = 27,45 г/моль. Молярная масса эквивалентов элемента (Мэк) связана с атомной массой элемента (МА) соотношением: Мэк (элемента) = Таким образом, Мэк (оксида) = 35,45 г/моль; Мэк (металла) = 27,45 г/моль; МА (металла) = 54,9 г/моль. Пример 2.6. При взаимодействии кислорода с азотом получено 4 моль эквивалентов оксида азота (IV). Рассчитать объемы газов, вступивших в реакцию при нормальных условиях. Решение. По закону эквивалентов число молей эквивалентов веществ, вступающих в реакцию и образующихся в результате реакции, равны между собой, т.е. υ (О2) = υ (N2) = υ (NO2). Так как получено 4 моль эквивалентов оксида азота (IV), то, следовательно, в реакцию вступило 4 моль эквивалентов О2 и 4 моль эквивалентов N2. Азот изменяет степень окисления от 0 (в N2) до +4 (в NО2), и так как в его молекуле 2 атома, то вместе они отдают 8 электронов, поэтому Мэк (N2) = 3,5 г/моль N2 – х х = Так как в реакцию вступило 4 моль эквивалентов N2, то их объем составляет V (N2) = 2,8·4 = 11,2 л. Зная, что моль эквивалентов кислорода при нормальных условиях занимает объем 5,6 л, рассчитываем объем 4 моль эквивалентов О2, вступивших в реакцию: V (O2) = 5,6∙4 = 22,4 л. Итак, в реакцию вступило 11,2 л азота и 22,4 л кислорода. Пример 2.7. Определить молярную массу эквивалентов металла, если из 48,15 г его оксида получено 88,65 г его нитрата. Решение. Учитывая, что Мэк (оксида) = Мэк (металла) + Мэк (кислорода), а Мэк (соли) = Мэк (металла) + Мэк (кислотного остатка), подставляем соответствующие данные в закон эквивалентов: 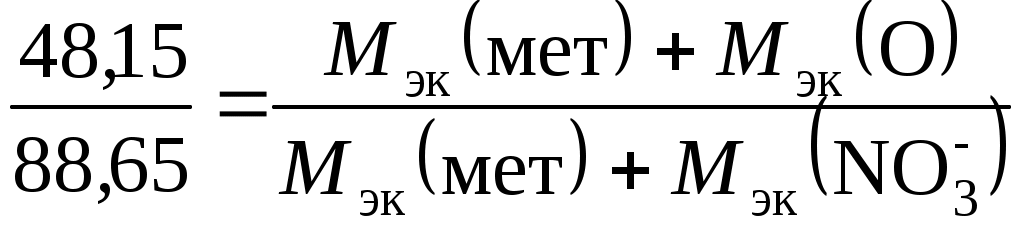 ; ; отсюда Мэк (металла) = 56,2 г/моль. Пример 2.8. Вычислить степень окисления хрома в оксиде, содержащем 68,42 % (масс.) этого металла. Решение. Приняв массу оксида за 100 %, находим массовую долю кислорода в оксиде: 100 – 68,42 = 31,58 %, т.е. на 68,42 частей массы хрома приходится 31,58 частей массы кислорода, или на 68,42 г хрома приходится 31,58 г кислорода. Зная, что молярная масса эквивалентов кислорода равна 8 г/моль, определим молярную массу эквивалентов хрома в оксиде по закону эквивалентов: 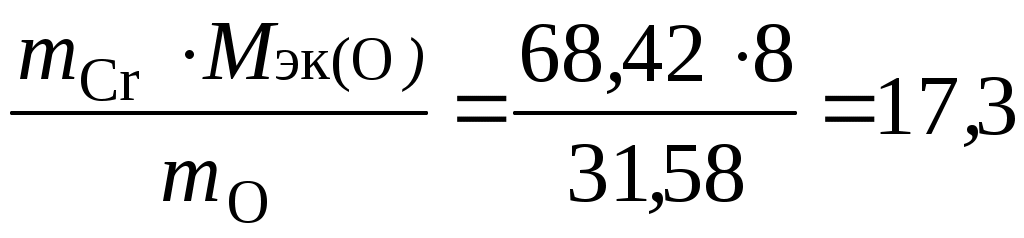 г/моль. г/моль.Степень окисления хрома находим из соотношения  , , отсюда |c. o.| = Задачи и упражнения для самостоятельного решения2.1. При взаимодействии 6,75 г металла с серой образовалось 18,75 г сульфида. Рассчитать молярные массы эквивалентов металла и его сульфида. Молярная масса эквивалентов серы равна 16 г/моль. (Ответ: 9 г/моль; 25 г/моль). 2.2. Вычислить степень окисления золота в соединении состава: 64,9 % золота и 35,1 % хлора. Молярная масса эквивалентов хлора 35,45 г/моль. (Ответ: 3). 2.3. Вычислить молярные массы эквивалентов и эквиваленты Р2О5 в реакциях, идущих по уравнениям: Р2О5 + 3MgO = Mg3(PO4)2; P2O5 + MgO = Mg(PO3)2. (Ответ: 23,7 г/моль; 71 г/моль). 2.4. Сколько моль эквивалентов металла вступило в реакцию с кислотой, если при этом выделилось 5,6 л водорода при нормальных условиях? (Ответ: 0,5 моль). 2.5. На нейтрализацию 0,943 г фосфористой кислоты Н3РО3 израсходовано 1,291 г КОН. Вычислить молярную массу эквивалентов кислоты. (Ответ: 41 г/моль). 2.6. Определить молярную массу эквивалентов металла и назвать металл, если 8,34 г его окисляются 0,68 л кислорода при нормальных условиях. Металл окисляется до степени окисления +2. (Ответ: 68,7 г/моль). 2.7. Вычислить степень окисления свинца в оксиде, в котором на 1 г свинца приходится 0,1544 г кислорода. (Ответ: 4). 2.8. Вычислить эквивалент и молярную массу эквивалентов Al(OH)3 в каждой из следующих реакций, выраженных уравнениями: Al(OH)3 + 3HCl = AlCl3 + 3H2O; Al(OH)3 + 2HCl = AlOHCl2 + 2H2O; Al(OH)3 + HCl = Al(OH)2Cl + H2O. 2.9. Для получения гидроксида железа (III) смешали растворы, содержащие 0,2 моль эквивалентов щелочи и 0,3 моль эквивалентов хлорида железа (III). Сколько граммов гидроксида железа (III) получилось в результате реакции? (Ответ: 7,13 г). 2.10. Из 1,3 г гидроксида металла получается 2,85 г его сульфата. Вычислить молярную массу эквивалентов этого металла. (Ответ: 9 г/моль). 2.11. При взаимодействии 22 г металла с кислотой выделилось при нормальных условиях 8,4 л водорода. Рассчитать молярную массу эквивалентов металла. Сколько литров кислорода потребуется для окисления этого же количества металла? (Ответ: 29,33 г/моль; 4,2 л.). 2.12. Вычислить степень окисления мышьяка в соединении его с серой, в котором на 1 г мышьяка приходится 1,07 г серы. Молярная масса эквивалентов серы 16 г/моль. (Ответ: 5). 2.13. Вычислить эквивалент и молярную массу эквивалентов Н3РО4 в каждой из следующих реакций, выраженных уравнениями: Н3РО4 + КОН = КН2РО4 + Н2О; Н3РО4 + 2КОН = К2НРО4 + 2Н2О; Н3РО4 + 3КОН = К3РО4 + 3Н2О. 2.14. При взаимодействии водорода и азота получено 6 моль эквивалентов аммиака. Какие объемы водорода и азота вступили при этом в реакцию при нормальных условиях? (Ответ: 67,2 л; 22,4 л.) 2.15. При пропускании сероводорода через раствор, содержащий 2,98 г хлорида металла, образуется 2,2 г его сульфида. Вычислить молярную массу эквивалентов металла. (Ответ: 39 г/моль). 2.16. Молярная масса эквивалентов металла равна 56,2 г/моль. Вычислить массовую долю металла в его оксиде. (Ответ: 87,54 %). 2.17. Определить эквивалент и молярную массу эквивалентов азота, кислорода, углерода в соединениях NH3, H2O, CH4. 2.18. Рассчитать молярную массу эквивалентов металла, если при взаимодействии 7,2 г металла с хлором было получено 28,2 г соли. Молярная масса эквивалентов хлора равна 35,45 г/моль. (Ответ: 12,15 г/моль). 2.19. На нейтрализацию 9,797 г ортофосфорной кислоты израсходовано 7,998 г NaOH. Вычислить эквивалент, молярную массу эквивалентов и основность Н3РО4 в этой реакции. На основании расчета написать уравнение реакции. (Ответ: ½ H3РО4; 49 г/моль; 2). 2.20. 0,43 г металла при реакции с кислотой вытеснили при нормальных условиях 123,3 мл водорода. 1,555 г этого же металла вступают во взаимодействие с 1,415 г некоторого неметалла. Рассчитать молярную массу эквивалентов неметалла. (Ответ: 35,5 г/моль). Лабораторная работа 3 Определение теплоты реакции нейтрализации Цель работы: изучить основные понятия термохимии (экзо- и эндотермические реакции, тепловой эффект, энтальпия, энтальпия образования вещества), закон Гесса и следствие из закона Гесса. Задание: провести реакцию нейтрализации и определить повышение температуры. На основании полученных данных рассчитать изменение энтальпии и тепловой эффект реакции. Выполнить требования к результатам работы, оформить отчет, решить задачу. Теоретическое введение Химические реакции сопровождаются выделением или поглощением энергии (чаще всего теплоты). Реакции, протекающие с выделением теплоты, называются экзотермическими, а с поглощением теплоты – эндотермическими. Количество теплоты, которое выделяется или поглощается при химической реакции, называется тепловым эффектом реакции. Тепловой эффект химической реакции обычно относят к молю продукта реакции и большей частью выражают в килоджоулях. Тепловой эффект реакции, протекающей при постоянном давлении, равен изменению энтальпии системы ΔН. При экзотермической реакции энтальпия системы уменьшается (ΔН < 0), а при эндотермической – энтальпия системы увеличивается (ΔН > 0). Если исходные вещества и продукты реакции находятся в стандартном состоянии, то в этом случае энтальпию реакции называют стандартной и обозначают ΔН°. Определение тепловых эффектов может быть осуществлено опытным путем с помощью калориметра или путем вычислений. В основе термохимических расчетов лежит закон Гесса: тепловой эффект химической реакции (т. е. изменение энтальпии ΔН) зависит только от начального и конечного состояния участвующих в реакции веществ и не зависит от промежуточных стадий процесса. Часто в термохимических расчетах применяют следствие из закона Гесса: энтальпия химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов. Например, стандартная энтальпия реакции nА + mВ → рС + qD рассчитывается по формуле ΔН°х.р. = (рΔfН °С + qΔfН°D) − (nΔfН°А + mΔfН°B), где ΔfН° – стандартная энтальпия образования вещества, кДж/моль. Стандартной энтальпией образования веществаназываетсястандартная энтальпия реакции образования 1 моль данного вещества из простых веществ. Выполнение работы Любая реакция нейтрализации сильной кислоты щелочью сводится к процессу Н+ + ОН‾ → Н2О. Для определения теплового эффекта реакции можно воспользоваться упрощенным калориметром, состоящим из трех стаканов – внешнего и двух внутренних. В сухой внутренний стакан калориметра с помощью мерного цилиндра налить 25 мл 1 н. раствора щелочи. В другой сухой стакан налить 25 мл 1 н. раствора серной кислоты. Опустить в раствор щелочи термометр. Записать температуру и, не вынимая термометр из стакана, быстро влить кислоту в щелочь. Осторожно помешивая раствор термометром, отметить и записать максимальную температуру. Эту температуру считать конечной. Требования к результатам работы Полученные данные занести в табл. 3.1. Таблица 3.1 Данные опыта и результаты расчетов
Вычислить (все вычисления пояснить словами): 1. Изменение энтальпии реакции ∆Н по формуле ΔH = −V∙ρ∙c∙ΔТ, где V – общий объем раствора, мл; ρ– плотность раствора, г/мл; с – теплоемкость раствора, Дж/(г∙К); ΔТ – разность между конечной и начальной температурами. Принять плотность раствора после нейтрализации равной 1г/мл, а теплоемкость его − равной теплоемкости воды, т. е. 4,18 Дж/(г∙К). 2. Тепловой эффект реакции нейтрализации ∆Н°нейтр.практ. в расчете на 1 моль эквивалентов кислоты. Так как 1 моль эквивалентов кислоты содержится в 1 л (1000 мл) раствора, а для реакции было взято 25 мл, то ΔHнейтр.практ. = 3. Теоретическое значение изменение энтальпии реакции нейтрализации ∆Н°нейтр. теор для уравнения Н+ + ОН‾ → Н2О. Энтальпии образования (Δf Н°) для Н+, ОH‾ и Н2О соответственно равны 0; –230,2 и –285,8 кДж/моль. 4. Относительную ошибку опыта Е (%): При решении задач этого раздела следует пользоваться табл. Б. 1. Пример 3.1. Вычислить тепловой эффект и написать термохимическое уравнение реакции горения ацетилена, в результате которой образуются пары воды и диоксид углерода. Сколько теплоты выделится при сгорании 10 л ацетилена при нормальных условиях? Решение. Реакция горения ацетилена протекает по уравнению С2Н2 (г) + 5½О2 (г) = 2СО2 (г) + Н2О (г). Пользуясь следствием из закона Гесса и справочными данными из табл. Б.1, вычисляем тепловой эффект реакции: DH°х.р. = [2(–393,5) + (–241,8)] − [226,8 + 5½∙0] = –1255,6 кДж. Термохимическими называются уравнения химических реакций, в которых указано изменение энтальпии. Изменение энтальпии (тепловой эффект) записывают в правой части уравнения после запятой. Термохимическое уравнение реакции горения ацетилена имеет вид: С2Н2 (г) + 5½О2 (г) = 2СО2 (г) + Н2О (г), DH°х.р.= –1255,6 кДж. Тепловой эффект обычно относят к одному молю вещества. Следовательно, при сжигании 1 моль С2Н2 выделяется 1255,6 кДж. Однако по условию задачи сжигается 10 л ацетилена, что составляет 10/22,4 = 0,446 моль С2Н2, где 22,4 л/моль – мольный объем любого газа при нормальных условиях. Таким образом, при сгорании 0,446 моль (10 л) С2Н2 выделится 0,446×(1255,6) = 560 кДж теплоты. Пример 3.2. Реакция идет по уравнению Fe2O3 (к) + 2Al (к) = 2Fe (к) + Al2O3 (к). При восстановлении 48 г Fe2O3 выделяется 256,1 кДж теплоты. Вычислить тепловой эффект реакции и стандартную энтальпию образования Fe2O3. Решение.Число молей Fe2O3, содержащихся в 48 г Fe2O3, составляет 48/160 = 0,3 моль, где 160 г/моль – молярная масса Fe2O3. Так как тепловой эффект относят к 1 моль вещества, то тепловой эффект данной реакции равен –256,1/0,3 = = –853,7 кДж. Запишем термохимическое уравнение этой реакции: Fe2O3 (к) + 2Al (к) = 2Fe (к) + Al2O3 (к), DH°х.р. = –853,8 кДж. Формула для расчета теплового эффекта данной реакции имеет вид: После подстановки справочных данных из табл. Б. 1 получаем: Таким образом, тепловой эффект реакции равен –853,8 кДж, а | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
