Лабораторная работа Основные классы неорганических соединений
 Скачать 2.63 Mb. Скачать 2.63 Mb.
|
Химическое равновесиеЦель работы: изучить понятия «химическое равновесие», «смещение равновесия», факторы, влияющие на смещение равновесия, закон действия масс для обратимых процессов. Задание: проделать опыты и определить, как влияет изменение концентрации реагирующих веществ и температуры на смещение равновесия. Выполнить требования к результатам опытов, оформить отчет, решить задачу. Теоретическое введение Химическим равновесием называется такое состояние реагирующей системы, при котором скорость прямой реакции равна скорости обратной реакции. Закон действия масс для обратимых процессов: в состоянии химического равновесия при постоянной температуре отношение произведения концентраций продуктов реакции к произведению концентраций исходных веществ есть величина постоянная. Она называется константой равновесия и обозначается Кс. Для реакции nА + mВ рС + qD константа равновесия имеет вид где [A], [B], [C], [D] – равновесные концентрации реагирующих веществ; n, m,p, q – коэффициенты перед веществами А, В, C, D. Химическое равновесие остается неизменным до тех пор, пока условия равновесия (концентрация, температура, давление), при которых оно установилось, сохраняются постоянными. При изменении условий равновесие нарушается. Через некоторое время в системе вновь наступает равновесие, характеризующееся новым равенством скоростей прямой и обратной реакций и новыми равновесными концентрациями всех веществ. Переход системы из одного равновесного состояния в другое называется смещением равновесия. При увеличении концентрации исходных веществ и уменьшении концентрации продуктов реакции равновесие смещается в сторону прямой реакции. При увеличении концентраций продуктов реакции и понижении концентраций исходных веществ равновесие смещается в сторону обратной реакции. Например, в реакции 2СО + О2 2СО2 увеличение концентраций СО, О2 (исходные вещества) или уменьшение концентрации СО2 (продукт реакции) приводит к смещению равновесия вправо. Увеличение концентрации СО2 или понижение концентраций исходных веществ СО, О2 смещает равновесие влево. При повышении температуры равновесие смещается в направлении эндотермической, при понижении – в направлении экзотермической реакции. Например, в равновесной системе N2 + O2 2NO, ∆Н°х.р. = 180,5 кДж, прямая реакция эндотермическая, поэтому повышение температуры приводит к смещению химического равновесия в сторону прямой реакции, а понижение температуры – в сторону обратной реакции. Выполнение работыОпыт 1. Влияние изменения концентрации на смещение равновесия Для опыта удобно воспользоваться реакциейFeCl3 + 3KSCN Fe(SCN)3 + 3KCl. Из веществ этой системы только роданид железа (III) Fe(SCN)3 окрашен в красный цвет. Поэтому всякое изменение его концентрации можно легко заметить по изменению интенсивности окраски раствора, что позволяет сделать вывод о направлении смещения равновесия системы при изменении концентрации реагирующих веществ. Смешать в пробирке равные объемы разбавленных растворов хлорида железа (III) и роданида калия. Полученный раствор разлить поровну в 4 пробирки. Оставить одну пробирку для сравнения, а в трех других изменить концентрации реагирующих веществ. Для этого добавить в первую пробирку несколько капель концентрированного раствора роданида калия, во вторую – несколько капель концентрированного раствора хлорида железа (III), в третью – кристаллического хлорида калия. Сравнить окраску в трех пробирках с контрольной. Требования к результатам опыта 1. Сделать вывод о направлении смещения равновесия и изменении концентрации каждого из компонентов в каждой пробирке. 2. Сформулировать правило смещения равновесия при изменении концентрации реагирующих веществ. 3. Написать выражение константы равновесия для данной реакции. Опыт 2. Влияние изменения температуры на смещение равновесияПрибор, состоящий из двух шаров, заполнен смесью оксида азота (IV) и его димером. Чистый оксид азота (IV) существует при температуре выше 140 °С. Ниже этой температуры NO2 частично полимеризуется по уравнению 2NO2 N2O4, ΔH° = –23 кДж. NO2 – газ бурого цвета, N2O4 – бесцветен. Изменение температуры позволяет судить о смещении равновесия в системе по изменению интенсивности окраски газов. Один шар прибора опустить в стакан с холодной, а второй – в стакан с горячей водой. Наблюдать изменение интенсивности окраски газов в шарах. Требования к результатам опыта 1. Сделать вывод о направлении смещения равновесия в данной реакции при нагревании и охлаждении. 2. Сформулировать правило смещения равновесия при изменении температуры. 3. Написать выражение константы равновесия для данной реакции. Примеры решения задач Пример 6.1. При некоторой температуре в системе N2 (г) + 3Н2 (г) 2NH3 (г) равновесные концентрации составляли (моль/л): [N2] = 1,5; [H2] = 1,7; [NH3] = 2,6. Вычислить константу равновесия этой реакции и исходные концентрации азота и водорода. Решение. Константа равновесия данной реакции выражается уравнением 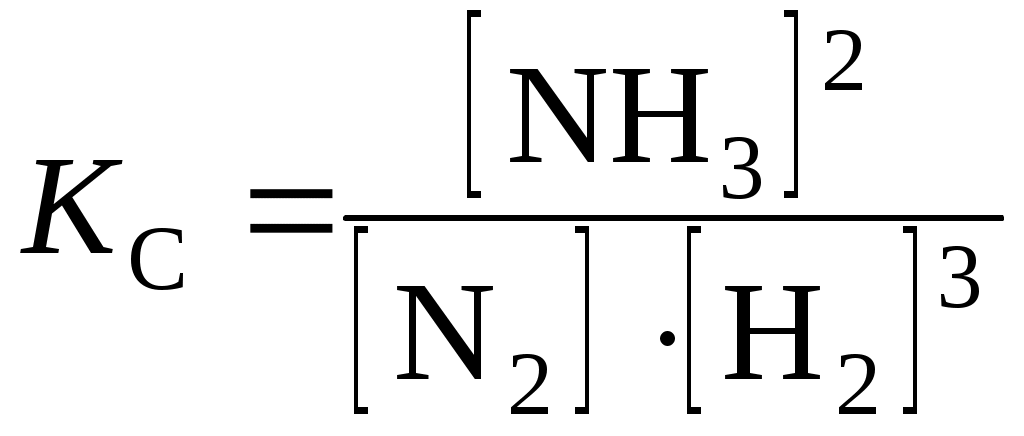 . .Подставляя данные задачи, получаем Исходные концентрации азота и водорода находим на основе уравнения реакции. Согласно уравнению реакции на образование 2 моль NH3 расходуется 1 моль N2. По условию задачи образовалось 2,6 моль NH3, на что израсходовалось 1,3 моль N2. Учитывая равновесную концентрацию азота, находим его исходную концентрацию: По уравнению реакции на образование 2 моль NH3 необходимо 3 моль H2, а для получения 2,6 моль NH3 требуется 3×2,6/2 = 3,9 моль H2. Исходная концентрация водорода Пример 6.2. Реакция протекает по уравнению А + В D + F. Определить равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В, соответственно, равны 2 и 1,2 моль/л, а константа равновесия реакции КС = 1. Решение. Так как все вещества в данной реакции реагируют в одинаковых соотношениях, обозначим изменение концентрации всех реагирующих веществ через x. К моменту установления равновесия образовалось хмоль D и х моль F и соответственно [D] = x; [F] =x. По уравнению реакции на столько же уменьшились концентрации А и В, т. е. [A] = 2 – x; [B] = 1,2 –x. Подставим равновесные концентрации в выражение константы равновесия: Отсюда равновесные концентрации равны: [D] = 0,75 моль/л; [F] = 0,75 моль/л; [A] = 2 – 0,75 = 1,25 моль/л; [B] = 1,2 – 0,75 = 0,45 моль/л. Пример 6.3. Реакция протекает по уравнению 2SO2 + O2 2SO3. В каком направлении сместится химическое равновесие, если объем системы уменьшить в 3 раза? Решение. До изменения объема скорости прямой и обратной реакций выражались уравнениями: При уменьшении объема в 3 раза концентрация каждого из реагирующих веществ увеличится в 3 раза. После увеличения концентрации скорость прямой реакции стала т. е. возросла в 27 раз; а скорость обратной – Пример 6.4. В какую сторону сместится химическое равновесие реакции А + В D, если повысить температуру на 30 °С? Температурные коэффициенты скорости прямой (γ1) и обратной (γ2) реакции равны соответственно 2 и 3. Решение. При повышении температуры на 30° скорость прямой реакции возрастет в Пример 6.5. Как изменятся скорости прямой и обратной реакции, если в системе 2NO (г) + О2 (г) 2NO2 (г) уменьшить давление в 2 раза? Произойдет ли при этом смещение равновесия? Если да, то в какую сторону? Решение. До уменьшения давления выражения для скорости прямой и обратной реакции имели вид При уменьшении давления в 2 раза концентрации каждого из реагирующих веществ уменьшаются в 2 раза, так как общий объем системы увеличивается в 2 раза. Тогда В результате уменьшения давления скорость прямой реакции уменьшилась в 8 раз, а скорость обратной – в 4 раза. Таким образом, скорость обратной реакции будет в 2 раза больше, чем прямой, и смещение равновесия произойдет в сторону обратной реакции, т. е. в сторону разложения NO2. Пример 6.6. В каком направлении сместится равновесие реакции COCl2 ↔ СО + Cl2, ∆H°х.р. = +112,5 кДж а) при повышении давления; б) с понижением температуры; в) при уменьшении концентрации хлора? Решение. а). При повышении давления равновесие смещается в сторону реакции, идущей с уменьшением числа молекул газа, при понижении давления – в сторону реакции, идущей с увеличением числа молекул газа. В левой части приведенной реакции 1 молекула (COCl2), а в правой – 2 (1 СО и 1 Cl2), поэтому при повышении давления равновесие смещается в сторону обратной реакции. б). При понижении температуры равновесие смещается в сторону экзотермической реакции, при повышении температуры – в сторону эндотермической. В нашем примере прямая реакция эндотермическая (∆H°х.р. > 0), а обратная – экзотермическая, следовательно, при понижении температуры равновесие сместится в сторону обратной реакции. в). При увеличении концентрации исходных веществ и уменьшении концентрации продуктов реакции равновесие смещается в сторону продуктов реакции. При уменьшении концентрации хлора (продукта реакции) равновесие сместится в сторону прямой реакции, т.е. в сторону образования продуктов реакции. Задачи и упражнения для самостоятельного решения 6.1. При нагревании диоксида азота в закрытом сосуде до некоторой температуры равновесие реакции 2NO2 2NO + O2 установилось при следующих концентрациях (моль/л): [NO2] = 0,4; [NO] = 1; [O2] = 0,5. Вычислить константу равновесия для этой температуры и исходную концентрацию диоксида азота. (Ответ: 3,125; 1,4 моль/л). 6.2. Реакция протекает по уравнению АВ А + В. При некоторой температуре из 1 моль АВ, находящегося в закрытом сосуде емкостью 20 л, разлагается 0,6 моль АВ. Определить константу равновесия. (Ответ: 0,045). 6.3. Константа равновесия реакции N2O4 2NO2 равна 0,16 при 375 К. Равновесная концентрация NO2 равна 0,09 моль/л. Вычислить равновесную концентрацию N2O4. (Ответ: 0,051 моль/л). 6.4. Рассчитать равновесную концентрацию О3 и константу равновесия в реакции 3О2 (г) 2О3 (г), если начальная масса О2 равна 24 г, а равновесная концентрация О2 равна 0,6 моль/л. (Ответ: 0,1 моль/л; 0,046). 6.5. Используя справочные данные табл. Б. 1, рассчитать ΔН°х.р. реакции, протекающей по уравнению 2NO2 (г) 2NO (г) + O2 (г) и определить, в какую сторону сместится равновесие при охлаждении системы. 6.6. Рассчитать равновесные концентрации газообразных веществ в гетерогенной системе FeO (к) + CO (г) Fe (к) + CO2 (г), если начальная концентрация СО составляла 2 моль/л, константа равновесия КС = 0,6. (Ответ: 1,25; 0,75 моль/л.). 6.7. При состоянии равновесия в системе N2 + 3H2 2NH3 концентрации веществ были (моль/л): [N2] = 0,3; [H2] = 0,9; [NH3] = 0,4. Рассчитать, как изменятся скорости прямой и обратной реакции, если концентрации всех участвующих в реакции веществ увеличить в 4 раза. В каком направлении сместится равновесие? (Ответ: 256; 16). 6.8. Вычислить константу равновесия для гомогенной системы CO (г) + H2O (г) СO2 (г) + H2 (г), если равновесные концентрации реагирующих веществ (моль/л): [CO] = 0,004; [H2O] = 0,064; [CO2] = 0,016, [H2] = 0,016. Чему равны исходные концентрации воды и СО? (Ответ: 1; 0,08 моль/л; 0,02 моль/л). 6.9. В начальный момент протекания реакции NiO (к) + Н2 (г) Ni (к) + H2O (г) концентрации были равны (моль/л): (Ответ: 0,33; 1,87 моль/л). 6.10. В реакторе при некоторой температуре протекает реакция СО2 + Н2 СО + Н2О. Определить константу равновесия, если в начальный момент 6.11. Определить, в какую сторону произойдет смещение равновесия реакции CO2 (г) + 4Н2 (г) СН4 (г) + 2Н2О (г), ∆Н°х.р. = –165 кДж при следующих воздействиях: а) увеличении давления; б) повышении концентрации СО2; в) понижении температуры. 6.12. В гомогенной системе установилось равновесие 2H2S + 3O2 2SO2 + 2H2O. Константа равновесия КС = 3∙105. Исходные вещества или продукты реакции будут преобладать в равновесной смеси веществ? Вычислить равновесную концентрацию диоксида серы, если равновесные концентрации веществ, участвующих в реакции, равны (моль/л): [H2S] = 0,02; [O2] = 0,30; [H2O] = 0,40. (Ответ: 4,5 моль/л). 6.13. Рассчитать КС реакции PCl5 (г) PCl3 (г) + Cl2 (г) при 500 К, если к моменту равновесия разложилось 54 % PCl5, а исходная концентрация PCl5 была равна 1 моль/л. (Ответ: 0,634). 6.14. После смешивания газов А и В в системе А (г) + В (г) С (г) +D (г) устанавливается равновесие при следующих концентрациях: [B] = 0,5 моль/л; [C] = 0,2 моль/л. Константа равновесия реакции равна 4×10-2. Найти исходные концентрации вещества А и В. (Ответ: 2,2; 0,7 моль/л). 6.15. Система С (графит) + СО2 (г) 2СО (г), DН°х.р. = 172,5 кДж находится в состоянии равновесия. Как повлияет на равновесие системы: а) повышение температуры; б) понижение давления; в) понижение концентрации СО2? 6.16. При некоторой температуре равновесные концентрации в системе 2SO2 + O2 2SO3 составляли (моль/л): [SO2] = 0,04; [O2] = 0,06; [SO3] = 0,02. Определить константу равновесия и исходные концентрации SO2 и O2. (Ответ: 4,17; 0,06 моль/л; 0,07 моль/л). 6.17. Реакция протекает по уравнению NO + Cl2 NOCl2, DН < 0. Какие изменения а) температуры; б) давления; в) концентраций участвующих в реакции веществ способствуют увеличению выхода продукта реакции? 6.18. Константа равновесия реакции FeO (к) + СО (г) Fe (к) + СО2 (г) при некоторой температуре равна 0,5. Найти равновесные концентрации СО и СО2, если начальные концентрации этих веществ составляли (моль/л): 6.19. Система N2 (г) + 3Н2 (г) 2NH3 (г); DН°х.р. = –92,4 кДж находится в состоянии равновесия. Определить, в каком направлении сместится равновесие: а) с ростом температуры; б) при повышении давления; в) при понижении концентрации NH3. 6.20. Найти константу равновесия реакции N2O4 2NO2, если начальная концентрация N2O4 составляла 0,08 моль/л, а к моменту наступления равновесия разложилось 50 % N2O4. (Ответ: 0,16). Лабораторная работа 7 Определение концентрации раствора кислоты Цель работы: изучить способы выражения концентрации растворов, научиться рассчитывать концентрацию растворов. Задание: приготовить приблизительно 0,1 н. раствор соляной кислоты и установить нормальность и титр кислоты. Выполнить требования к результатам работы, оформить отчет, решить задачу. Теоретическое введение Один из методов определения концентрации растворов – объемный анализ. Он сводится к измерению объемов реагирующих веществ, концентрация одного из которых известна. Такое измерение производится постепенным прибавлением одного раствора к другому до окончания реакции. Этот процесс называется титрованием. Окончание реакции определяется с помощью индикатора. При определении объемов растворов целесообразно использовать следующие способы выражения концентрации растворов: Молярная концентрация эквивалентов вещества В или нормальность (сэк (В) или н.) – отношение количества эквивалентов растворенного вещества к объему раствора: где nэк (В) – количество эквивалентов вещества В, моль; mB – масса вещества В, г; Мэк (В) – молярная масса эквивалентов вещества В, г/моль; Vр – объем раствора, л. Массовая доля растворенного вещества В (ωВ) – отношение (обычно – процентное) массы растворенного вещества к массе раствора: где mB – масса вещества В, г; mр – масса раствора, г. Если выражать массу раствора через его плотность (ρ) и объем (Vр), то Титр раствора вещества В (ТВ) показывает массу растворенного вещества, содержащуюся в 1 мл (см3) раствора: где mB – масса растворенного вещества В, г; Vp – объем раствора, мл. Титр также можно рассчитать по формуле где Мэк (В) – молярная масса эквивалентов вещества В, г/моль; сэк(В) – молярная концентрация эквивалентов, моль/л. Выполнение работы Опыт 1. Приготовление приблизительно 0,1 н. раствора соляной кислоты (Проводить в вытяжном шкафу!). Налить в цилиндр концентрированный раствор соляной кислоты и ареометром определить его плотность. По измеренной плотности по табл. Б. 2 найти массовую долю (%) кислоты в растворе. Рассчитать массу кислоты, необходимую для приготовления 250 мл 0,1 н. раствора HCl по формуле где сэк – молярная концентрация эквивалентов, моль/л; m – масса кислоты, г; Мэк(HCl) – молярная масса эквивалентов кислоты, г/моль; V – объем кислоты, л. Полученную величину (m) пересчитать на объем, который требуется для приготовления 250 мл 0,1 н. раствора кислоты по формуле где V– объем кислоты, мл; m – масса кислоты,г; ω – массовая доля в % HCl, найденная по табл. Б. 2; ρ – плотность кислоты, г/мл, измеренная ареометром. Пипеткой отобрать рассчитанный объем раствора кислоты, перенести его в мерную колбу, разбавить водой до метки и хорошо перемешать. Опыт 2. Установление нормальности и титра кислоты Отмерить пипеткой 10 мл приготовленного раствора кислоты, перенести его в коническую колбу, добавить 1–2 капли фенолфталеина. В бюретку налить 0,1 н. раствор NaOH. Оттитровать раствор кислоты. Для этого медленно приливать из бюретки щелочь в колбу с раствором кислоты, непрерывно перемешивая его в процессе титрования. Место, в которое падают капли щелочи, окрашивается в розовый цвет, исчезающий при взбалтывании.. Титрование проводить до тех пор, пока от одной капли щелочи раствор примет неисчезающую окраску. Появление окраски означает, что кислота полностью нейтрализована щелочью. Первое титрование – ориентировочное. Повторить титрование еще три раза. Расхождение между последними тремя титрованиями не должно превышать 0,1 мл. Требования к результату опыта Данные опыта занести в табл. 7.1: Таблица 7.1 Данные опыта и результаты расчетов
Вычислить: 1. Молярную концентрацию эквивалентов раствора кислоты по закону эквивалентов: сэк (HCl)∙V(HCl) = сэк (NaOH)∙V(NaOH), откуда где сэк (HCl) и сэк (NaOH) – молярные концентрации эквивалентов растворов; V(HCl) и V(NaOH) – объемы реагирующих растворов. 2. Титр раствора НСl по формуле Примеры решения задач Пример 7.1. Водный раствор содержит 354 г H3PO4 в 1 л. Плотность раствора ρ = 1,18 г/мл. Вычислить: а) массовую долю (%) H3PO4 в растворе; б) молярную концентрацию; в) молярную концентрацию эквивалентов; г) моляльность; д) титр; е) молярные доли H3PO4 и Н2О. Решение. а). Для расчета массовой доли воспользуемся формулой б). Молярная концентрация вещества В или молярность (сВ или М) – отношение количества растворенного вещества к объему раствора: где nB – количество вещества В, моль; mB – масса вещества В, г; МВ– молярная масса вещества В, г/моль; Vр– объем раствора, л. Молярная масса H3PO4 равна 98 г/моль. Молярную концентрацию раствора находим из соотношения (1): в). Молярную концентрацию эквивалентов рассчитываем по формуле г). Моляльная концентрация вещества В или моляльность (сm(B)) – отношение количества растворенного вещества к массе растворителя: где nВ – количество вещества В, моль; mB – масса вещества В,г; mS – масса растворителя, г; МВ − молярная масса вещества В, г/моль. Для определения моляльности по формуле (2) необходимо рассчитать массу растворителя в растворе. Масса раствора составляет 1,18∙1000 = 1180 г. Масса растворителя в растворе mS = 1180 – 354 = 826 г. Моляльная концентрация раствора равна д). Титр раствора можно рассчитать по формулам: е). Молярная (мольная) доля вещества В (хВ), безразмерная величина – отношение количества данного вещества к суммарному количеству всех веществ, составляющих раствор, включая растворитель. Если раствор состоит из одного растворенного вещества и растворителя, то молярная доля вещества (хВ) равна а молярная доля растворителя (xS) где nB – количество растворенного вещества, моль; nS – количество вещества растворителя, моль. Сумма молярных долей всех веществ раствора равна единице. В 1 л раствора содержится 3,61 моль H3PO4 (см. пункт б). Масса растворителя в растворе 826 г, что составляет Молярные доли H3PO4 и Н2О рассчитываем по формулам (3) и (4): Пример 7.2. Сколько миллилитров 50 %-го раствора HNO3, плотность которого 1,32 г/мл, требуется для приготовления 5 л 2 %-го раствора, плотность которого 1,01 г/мл? Решение. При решении задачи пользуемся формулой Сначала находим массу азотной кислоты в 5 л 2 %-го раствора: Чтобы ответить на вопрос задачи, надо определить, в каком объеме раствора с массовой долей HNO3 50 % содержится 101 г HNO3: Таким образом, для приготовления 5 л 2 %-го раствора HNO3 требуется 153 мл 50 %-ного раствора HNO3. Пример 7.3. На нейтрализацию 50 мл раствора Решение. Так как вещества взаимодействуют между собой в эквивалентных количествах, то можно написать VA∙н. (А) = VB∙н. (B); 50∙н. (кислоты) = 25∙0,5, отсюда н. (кислоты) = Следовательно, для реакции был использован 0,25 н. раствор кислоты. Задачи и упражнения для самостоятельного решения 7.1. В одном литре раствора содержится 10,6 г карбоната натрия Na2CO3. Рассчитать молярную концентрацию, молярную концентрацию эквивалентов и титр раствора. (Ответ: 0,1 М; 0,2 н.; 10,6∙10-3 г/мл) 7.2. Вычислить молярную концентрацию и молярную концентрацию эквивалентов 20 %-го раствора хлорида кальция плотностью 1,178 г/мл. (Ответ: 2,1 М; 4,2 н.). 7.3. Сколько моль HNO3 содержится в 250 мл раствора с массовой долей кислоты 30 % и плотностью, равной 1,18 г/мл? (Ответ: 1,40 моль). 7.4. Водный раствор содержит 5 г CuSO4 в 45 г воды. Вычислить массовую долю (%) CuSO4 в растворе, а также моляльность и мольные доли CuSO4 и Н2О. (Ответ: 10 %; 0,694 моль/кг; 0,012; 0,988). 7.5. Вычислить титры растворов: а) 0,05 М NaCl; б) 0,004 н. Ca(OH)2; в) 30 %-го КОН, ρ = 1,297 г/мл. (Ответ: а) 0,00292; б) 0,148∙10‾3; в) 0,389 г/мл). 7.6. Чему равна нормальность 30 %-го раствора NaOH плотностью 1,328 г/мл? К 1 л этого раствора прибавили 5 л воды. Получился раствор плотностью 1,054 г/мл. Вычислить массовую долю (%) NaOH в полученном растворе. (Ответ: 9,96 н.; 6,3 %). 7.7. В 1 кг воды растворили 666 г КОН, плотность раствора равна 1,395 г/мл. Вычислить массовую долю КОН в полученном растворе, молярность и мольные доли щелочи и воды. (Ответ: 40 %; 9,96 моль/л; 0,176; 0,824). 7.8. Какой объем 2 М раствора К2СО3 надо взять для приготовления 1 л 0,25 н. раствора? (Ответ: 62,5 мл). 7.9. Из 600 г 5 %-го раствора сульфата меди упариванием удалили 100 г воды. Чему равна массовая доля CuSO4 в оставшемся растворе? (Ответ: 6 %). 7.10. Какой объем 50 %-го КОН (ρ = 1,538 г/мл) требуется для приготовления 3 л 6 %-го раствора (ρ = 1,048 г/мл)? (Ответ: 245,3 мл). 7.11.Какая масса гидроксида натрия потребуется для приготовления 2 л 0,5 М раствора? (Ответ: 40 г). 7.12. Вычислить моляльную и молярную концентрацию эквивалентов 20,8 %-го раствора HNO3 плотностью 1,12 г/мл. (Ответ: 4,17 моль/кг; 3,7 моль/л) 7.13. Сколько миллилитров 0,2 М раствора Na2CO3 требуется для реакции с 50 мл 0,5 М раствора CaCl2? (Ответ: 125 мл). 7.14. Плотность 15 %-го раствора Н2SO4 1,105 г/мл. Вычислить молярность, моляльность и молярную концентрацию эквивалентов раствора серной кислоты. (Ответ: 1,69 моль/л; 1,8 моль/кг; 3,38 моль/л). 7.15. Рассчитать массы медного купароса CuSO4 ∙ 5Н2О и воды, необходимые для приготовления 500 г 2 %-го раствора сульфата меди. Определить молярную концентрацию и молярную концентрацию эквивалентов, если плотность раствора равна 1,015 г/мл. (Ответ: 7.16. При растворении 18 г Н3РО4 в 282 мл воды получили раствор фосфорной кислоты, плотность которого 1,031 г/мл. Вычислить молярную, моляльную, молярную концентрацию эквивалентов полученного раствора и его титр. (Ответ: 0,63моль/л; 0,65 моль/кг; 1,89 моль/л.; 0,062 г/мл). 7.17. На нейтрализацию 20 мл раствора, содержащего в 1 л 12 г щелочи, израсходовано 24 мл 0,25 н. раствора кислоты. Вычислить молярную массу эквивалентов щелочи. (Ответ: 40 г/моль). 7.18. На нейтрализацию 31 мл 0,16 н. раствора щелочи требуется 217 мл раствора H2SO4. Вычислить нормальность и титр раствора H2SO4. (Ответ: 0,023 н.; 1,127∙10‾3 г/мл). 7.19. Смешали 10 мл 10 %-го раствора HNO3 (ρ = 1,056 г/мл) и 100 мл 30 %-го раствора HNO3 (ρ = 1,184 г/мл). Вычислить массовую долю HNO3 в полученном растворе. (Ответ: 28,36 %). 7.20. Вычислить массовую долю (%) нитрата серебра в 1,4 М растворе, плотность которого 1,18 г/мл. (Ответ: 20,2 %). Лабораторная работа 8 |
