Лекция 1(II). Лекция 1 (II). Классификация металлов и сплавов
 Скачать 105.51 Kb. Скачать 105.51 Kb.
|
|
Лекция 1 (II). Классификация металлов и сплавов Металлы – один из классов конструкционных материалов, характеризующийся определённым набором свойств.
Данные свойства обусловлены особенностями строения металлов. Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, имеющие определенную температуру плавления и упорядоченное расположение частиц в определенных точках пространства. Этот порядок определяется понятием кристаллическая решётка. Другими словами, кристаллическая решетка это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело. В узлах кристаллической решетки металлов располагаются положительно заряженные ионы, связь между которыми осуществляют перемещающиеся по всему объему кристалла электроны, называемые электронным газом. Таким образом, пластичность, теплопроводность и электропроводность обеспечиваются наличием «электронного газа». Элементарная ячейка – элемент объёма из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл. Элементарная ячейка характеризует особенности строения кристалла. Основными параметрами кристалла являются: размеры рёбер элементарной ячейки. a, b, c – периоды решётки – расстояния между центрами ближайших атомов. В одном направлении выдерживаются строго определёнными. углы между осями ( координационное число (К) указывает на число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома в решетке. базис решетки количество атомов, приходящихся на одну элементарную ячейку решетки. плотность упаковки атомов в кристаллической решетке – объем, занятый атомами, которые условно рассматриваются как жесткие шары. Ее определяют как отношение объема, занятого атомами к объему ячейки (для объемно-центрированной кубической решетки – 0,68, для гранецентрированной кубической решетки – 0,74) 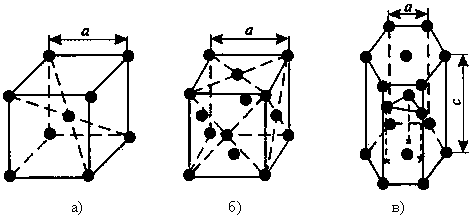 Рис. 1. Основные типы кристаллических решеток: а – объемно-центрированная кубическая; б– гранецентрированная кубическая; в – гексагональная плотноупакованная Основными типами кристаллических решёток металлов являются:
Аллотропия или полиморфные превращения. Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропией или полиморфизмом. Каждый вид решетки представляет собой аллотропическое видоизменение или модификацию. Примером аллотропического видоизменения в зависимости от температуры является железо (Fe). Fe: Превращение одной модификации в другую протекает при постоянной температуре и сопровождается тепловым эффектом. Видоизменения элемента обозначается буквами греческого алфавита в виде индекса у основного обозначения металла. Примером аллотропического видоизменения, обусловленного изменением давления, является углерод: при низких давлениях образуется графит, а при высоких – алмаз. Используя явление полиморфизма, можно упрочнять и разупрочнять сплавы при помощи термической обработки. Магнитные превращения. Некоторые металлы намагничиваются под действием магнитного поля. После удаления магнитного поля они обладают остаточным магнетизмом. Это явление впервые обнаружено на железе и получило название ферромагнетизма. К ферромагнетикам относятся железо, кобальт, никель и некоторые другие металлы. При нагреве ферромагнитные свойства металла уменьшаются постепенно: вначале слабо, затем резко, и при определённой температуре (точка Кюри) исчезают (точка Кюри для железа – Строение реальных металлов. Из жидкого расплава можно вырастить монокристалл. Их обычно используют в лабораториях для изучения свойств того или иного вещества. Металлы и сплавы, полученные в обычных условиях, состоят из большого количества кристаллов, то есть, имеют поликристаллическое строение. Эти кристаллы называются зернами. Они имеют неправильную форму и различно ориентированы в пространстве. Каждое зерно имеет свою ориентировку кристаллической решетки, отличную от ориентировки соседних зерен, вследствие чего свойства реальных металлов усредняются, и явления анизотропии не наблюдается В кристаллической решетке реальных металлов имеются различные дефекты, которые нарушают связи между атомами и оказывают влияние на свойства металлов. Различают следующие дефекты:
К точечным дефектам относят нарушения в виде вакансий (дефекты по Шотки), межузельных атомов (дефекты по Френкелю), избытка или недостатка атомов, а также примеси посторонних атомов (дефекты замещения и внедрения). Точечные дефекты вызывают незначительные искажения решетки, что может привести к изменению свойств тела (электропроводность, магнитные свойства), их наличие способствует процессам диффузии и протеканию фазовых превращений в твердом состоянии. При перемещении по материалу дефекты могут взаимодействовать. К линейным дефектам относятся дислокации. Дислокация – это дефект кристаллического строения, представляющий собой линию, вдоль и вблизи которой нарушено характерное для кристалла правильное расположение атомных плоскостей. Простейшие виды дислокаций – краевые и винтовые. Краевая дислокация представляет собой линию, вдоль которой обрывается внутри кристалла край “лишней“ полуплоскости (экстраплоскости). Если экстраплоскость находится в верхней части кристалла, то краевая дислокация – положительная ( Другой тип дислокаций получил название винтовая дислокация Винтовая дислокация – это результат спирального роста кристалла. Если переход от верхних горизонтов кристалла к нижним осуществляется поворотом по часовой стрелке, то дислокация правая, а если поворотом против часовой стрелки – левая. Винтовая дислокация параллельна вектору сдвига. Линии дислокаций не могут обрываться внутри кристалла, они должны либо быть замкнутыми, либо разветвляться на несколько дислокаций, либо выходить на поверхность кристалла. Дислокационная структура материала характеризуется плотностью дислокаций. Плотность дислокаций в кристалле определяется как среднее число линий дислокаций, пересекающих внутри тела площадку площадью 1 м2, или как суммарная длина линий дислокаций в объеме 1 м3 Плотность дислокаций изменяется в широких пределах и зависит от состояния материала. После тщательного отжига плотность дислокаций составляет 105…107 м-2, в кристаллах с сильно деформированной кристаллической решеткой плотность дислокаций достигает 1015…1016 м –2. Плотность дислокации в значительной мере определяет пластичность прочность материала. Минимальная прочность определяется критической плотностью дислокаций Вместе с тем замечено, что при определенных условиях дислокации и другие дефекты кристаллов увеличивают прочность материалов. Это происходит тогда, когда накоплено значительное количество дислокаций, которые, взаимодействуя друг с другом, мешают своему развитию и перемещению. Перемещению дислокаций препятствуют также атомы примесей, границы блоков, различные обособленные включения в решетки. Отсюда ряд исследователей делают вывод о положительном влиянии дислокаций на прочностные свойства материалов. Видимо, все-таки, лучше вообще не иметь дефектов, чем иметь их в огромном количестве, которое несколько увеличивает прочность материала по сравнению с некоторой минимальной прочностью, которую имеет материал при неблагоприятном числе дефектов. Прочность бездефектного материала в сотни раз больше прочности материала с «оптимальным» количеством дефектов. Необходимо также отметить возможность локального скопления дислокаций, которые могут вызвать местные концентрации напряжений, которые способны образовать зародыши микротрещин (трещины Гриффитса). Дислокации влияют не только на прочность и пластичность, но и на другие свойства кристаллов (электрические, оптические, магнитные и др.) Дислокации увеличивают среднюю скорость диффузии в кристалле, ускоряют старение и другие процессы, уменьшают химическую стойкость, поэтому в результате обработки поверхности кристалла специальными веществами в местах выхода дислокаций образуются ямки. Образуются дислокации при деформации, в процессе кристаллизации, при термической обработке. Поверхностные дефекты представляют собой поверхности раздела между отдельными зернами или субзернами в поликристаллическом металле; к ним относятся также дефекты упаковки. Поликристалл содержит большое число мелких зерен, границы между которыми представляют переходный слой шириной 1-5 нм. В нем нарушена правильность расположения атомов, имеется скопление дислокаций, повышена концентрация примесей. Границы между зернами называют большеугловыми, т.к. кристаллографические направления в соседних зернах образуют углы в десятки градусов. Каждое зерно состоит из субзерен. Субзерна разориентированы относительно друг друга на угол не более 50 – малоугловые границы. Дефект упаковки – это часть атомной плоскости, ограниченной дислокациями, в пределах которой нарушен нормальный порядок чередования атомных слоев. Поверхностные дефекты влияют на механические и физические свойства металлов. Чем мельче зерно, тем выше предел текучести, вязкость и меньше опасность хрупкого разрушения. Диффузия протекает значительно быстрее вдоль границ зерен, чем сквозь кристаллы, особенно при нагреве. Взаимодействие между дефектами, перемещение их в кристаллах отражается на свойствах материалов. К объемным дефектам в кристаллах относят микротрещины в них, поры и различные включения. Хорошая пластичность дает возможность обрабатывать металлы под давлением (прокатка, ковка, штамповка, волочение). Металлы обладают хорошими литейными свой ствами, а также свариваемостью, способны работать при низких и высоких температурах. Металлические изделия и конструкции легко соединяются с помощью болтов, заклепок и сварки. Наряду с этим металлы обладают и существенными недостатками: имеют боль шую плотность, при действии различных газов и влаги коррози руют, а при высоких температурах значительно деформируются. Определение «чистый металл» весьма условно. Любой чистый металл содержит примеси, а потому его следует рассматривать как сплав. Под термином «чистый металл» понимается металл, содержащий 0,01–0,001% примесей. Современная металлургия позволяет получать металлы высокой чистоты (99,999 %). Однако примеси даже в малых количествах могут оказывать существенное влияние на свойства металла. Чистые металлы обладают высокой пластичностью и низкой прочностью, что не обеспечивает требуемых физико-химических и технологических свойств. Поэтому их применение в строительстве и технике в качестве конструкционных материалов сильно ограничено. Наиболее широко используют сплавы, обладающие более высокой проч ностью, твердостью и износостойкостью и т. д. Сплавы – это системы, состоящие из нескольких металлов или металлов и неметаллов. Так, например, прочность технического железа составляет примерно 250 МПа, при введении в железо углерода в количестве 0,9 мас. % прочность повышается до 980 МПа. Природа твердых сплавов может быть различной, это могут быть твердые растворы, химические соединения и механические смеси компонентов. Твердыми растворами называются фазы, в которых один из компонентов сохраняет свою кристаллическую решетку, а атомы других (или другого) компонента располагаются в решетке первого компонента (растворителя). Таким образом, твердый раствор, состоящий из двух или нескольких компонентов, имеет один тип решетки и представляет собой одну фазу. Различают твердые растворы замещения и внедрения. Химические соединения(AmBn) образуются между компонентами, имеющими большое различие в электронном строении атомов и кристаллических решеток. Кристаллическая решетка соединения отличается от кристаллических решеток компонентов, образующих соединение. Соединение имеет постоянную температуру плавления; его образование сопровождается значительным тепловым эффектом. Приметы соединений: Mg2Sn, Mg2Pb, Mg3Bi2. Сплавы – механические смеси - образуются, если компоненты не растворяются друг в друге в твердом состоянии и химически не взаимодействуют. При образовании смеси каждый компонент сохраняет свою кристаллическую решетку. Все металлы и образованные из них сплавы делят на две группы: черные и цветные. К черным металлам относятся железо и сплавы на его основе – стали и чугуны, остальные металлы являются цветными. В стро ительстве в основном применяют черные металлы – чугуны и стали для каркасов зданий, мостов, труб, кровли, арматуры в бетоне и для других металлических конструкций и изделий. К цветным металлам относятся все металлы и сплавы на осно ве алюминия, меди, цинка, титана. Цветные металлы являются более дорогостоящими и дефицитными. Диаграммы состояния двухкомпонентных систем. Строение сплава определяет его свойства, поэтому важно знать, как это строение будет меняться при изменении температуры и состава сплава. Зависимость между строением сплава, его составом и температурой описывается при помощи диаграмм состояния. Диаграммы состояния строятся экспериментально по критическим точкам, полученным на кривых охлаждения сплавов данной системы. Поскольку эти диаграммы не содержат фактора времени и критические точки стремятся получить при очень медленном нагреве или охлаждении сплава, т.е. для равновесного состояния, то диаграммы состояния также называются еще и диаграммами равновесия. Зависимость между составом, структурой и характером диаграмм состояния впервые установил Н.С. Курнаков. Вид диаграммы состояния двойной системы определяется взаимодействием ее компонентов в жидком и твердом состоянии (образованием жидких и твердых растворов, химических соединений и промежуточных фаз), а также наличием полиморфных модификаций компонентов. Можно выделить несколько основных типов диаграмм состояний. Первый тип – диаграммы состояния сплавов, образующих гетерогенные структуры. Второй тип – диаграммы состояния сплавов, образующих твердые растворы с неограниченной или ограниченной растворимостью компонентов в твердом состоянии. Третий тип – диаграммы состояния сплавов, образующих химические соединения. Диаграммы состояния сплавов I типа. Диаграмма состояния сплавов с отсутствием растворимости компонентов в твердом состоянии (сплавы - механические смеси) Диаграмма состояния и кривые охлаждения типичных сплавов системы представлены на рис. 5.3. 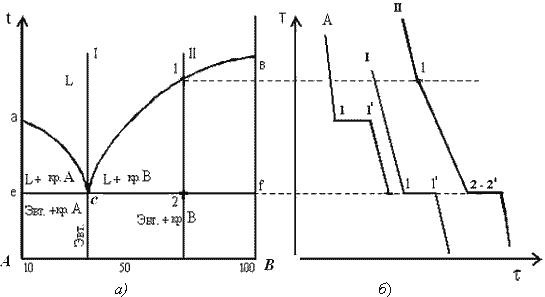 Рис. 5.3. Диаграмма состояния сплавов с отсутствием растворимости компонентов в твердом состоянии (а) и кривые охлаждения сплавов (б) Проведем анализ диаграммы состояния. 1. Количество компонентов: К = 2 (компоненты А и В); 2. Число фаз: f = 3 (кристаллы компонента А, кристаллы компонента В, жидкая фаза). 3. Основные линии диаграммы: линия ликвидус acb, состоит из двух ветвей, сходящихся в одной точке; линия солидус ecf, параллельна оси концентраций стремится к осям компонентов, но не достигает их; 4. Типовые сплавы системы. а) Чистые компоненты, кристаллизуются при постоянной температуре, на рис 5.3 б показана кривая охлаждения компонента А. б). Эвтектический сплав – сплав, соответствующий концентрации компонентов в точке с (сплав I). Кривая охлаждения этого сплава, аналогична кривым охлаждения чистых металлов (рис. 5.3 б) Эвтектика – мелкодисперсная механическая смесь разнородных кристаллов, кристаллизующихся одновременно при постоянной, самой низкой для рассматриваемой системы, температуре. При образовании сплавов механических смесей эвтектика состоит из кристаллов компонентов А и В: Эвт. (кр. А + кр. В) Процесс кристаллизации эвтектического сплава: до точки 1 охлаждается сплав в жидком состоянии. При температуре, соответствующей точке 1, начинается одновременная кристаллизация двух разнородных компонентов. На кривой охлаждения отмечается температурная остановка, т.е. процесс идет при постоянной температуре, так как согласно правилу фаз в двухкомпонентной системе при наличии трех фаз (жидкой и кристаллов компонентов А и В) число степеней свободы будет равно нулю (С= 2-3+1=0). В точке 1/ процесс кристаллизации завершается. Ниже точки 1/ охлаждается сплав, состоящий из дисперсных разнородных кристаллов компонентов А и В. в) Другие сплавы системы аналогичны сплаву II, кривую охлаждения сплава см на рис 5.3.б. Процесс кристаллизации сплава II: до точки 1 охлаждается сплав в жидком состоянии. При температуре, соответствующей точке 1, начинают образовываться центры кристаллизации избыточного компонента В. На кривой охлаждения отмечается перегиб (критическая точка), связанный с уменьшением скорости охлаждения вследствие выделения скрытой теплоты кристаллизации. На участке 1–2 идет процесс кристаллизации, протекающий при понижающейся температуре, так как согласно правилу фаз в двухкомпонентной системе при наличии двух фаз (жидкой и кристаллов компонента В) число степеней свободы будет равно единице Схема микроструктуры сплава представлена на рис. 5.4.  Рис. 5.4. Схема микроструктур сплавов: а – доэвтектического, б – эвтектического, в – заэвтектического 5. При проведении количественного структурно-фазового анализа, конода, проведенная через заданную точку, пересекает линию ликвидус и оси компонентов, поэтому состав твердой фазы или 100 % компонента А, или 100 % компонента В. Диаграммы состояния сплавов II типа. Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии (сплавы твердые растворы с неограниченной растворимостью) Диаграмма состояния и кривые охлаждения сплавов системы представлены на рис. 5.1. 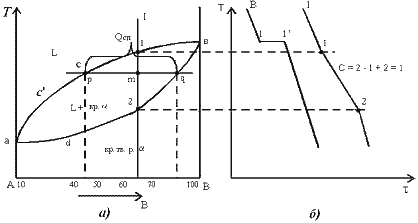 Рис.5.1 Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии (а); кривые охлаждения типичных сплавов (б) Сначала получают термические кривые. Полученные точки переносят на диаграмму, соединив точки начала кристаллизации сплавов и точки конца кристаллизации, получают диаграмму состояния. Проведем анализ полученной диаграммы. 1. Количество компонентов: К = 2 (компоненты А и В). 2. Число фаз: f = 2 (жидкая фаза L, кристаллы твердого раствора 3. Основные линии диаграммы:
4. Характерные сплавы системы: Чистые компоненты А и В кристаллизуются при постоянной температуре, кривая охлаждения компонента В представлена на рис. 5.1,б. Остальные сплавы кристаллизуются аналогично сплаву I, кривая охлаждения которого представлена на рис. 5.1, б. Процесс кристаллизации сплава I: до точки 1 охлаждается сплав в жидком состоянии. При температуре, соответствующей точке 1, начинают образовываться центры кристаллизации твердого раствора Схема микроструктуры сплава представлена на рис. 5.2.  Рис. 5.2. Схема микроструктуры сплава – однородного твердого раствора 5. Количественный структурно-фазовый анализ сплава. Пользуясь диаграммой состояния можно для любого сплава при любой температуре определить не только число фаз, но и их состав и количественное соотношение. Для этого используется правило отрезков. Для проведения количественного структурно-фазового анализа через заданную точку проводят горизонталь (коноду) до пересечения с ближайшими линиями диаграммы (ликвидус, солидус или оси компонентов). а). Определение состава фаз в точке m: Для его определения через точку m проводят горизонталь до пересечения с ближайшими линиями диаграммы: ликвидус и солидус. Состав жидкой фазы определяется проекцией точки пересечения горизонтали с линией ликвидус p на ось концентрации. Состав твердой фазы определяется проекцией точки пересечения горизонтали с линией солидус q (или осью компонента) на ось концентрации. Состав жидкой фазы изменяется по линии ликвидуса, а состав твердой фазы – по линии солидуса. С понижением температуры состав фаз изменяется в сторону уменьшения содержания компонента В. б). Определение количественного соотношения жидкой и твердой фазы при заданной температуре (в точке m): Количественная масса фаз обратно пропорциональна отрезкам проведенной коноды.Рассмотрим проведенную через точку m коноду и ее отрезки. Количество всего сплава (Qсп) определяется отрезком pq. Отрезок, прилегающий к линии ликвидус pm, определяет количество твердой фазы. Отрезок, прилегающий к линии солидус (или к оси компонента) mq, определяет количество жидкой фазы. Диаграммы состояния сплавов III типа. Диаграмма состояния сплавов, компоненты которых образуют химические соединения. 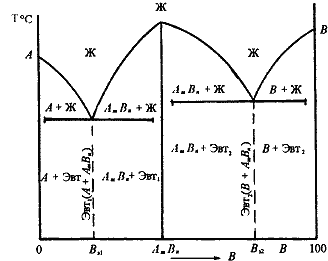 Рис. 5.6. Диаграмма состояния сплавов, компоненты которых образуют химические соединения Диаграмма состояния сложная, состоит из нескольких простых диаграмм. Число компонентов и количество диаграмм зависит от того, сколько химических соединений образуют основные компоненты системы. Число фаз и вид простых диаграмм определяются характером взаимодействия между компонентами. Эвт1 (кр. А + кр. AmBn); Эвт2 (кр. B + кр. AmBn). Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии Диаграмма состояния и кривые охлаждения типичных сплавов системы представлены на рис.5.5. 1. Количество компонентов: К = 2 (компоненты А и В); 2. Число фаз: f = 3 (жидкая фаза и кристаллы твердых растворов 3. Основные линии диаграммы: линия ликвидус acb, состоит из двух ветвей, сходящихся в одной точке; линия солидус аdcfb, состоит из трех участков; dm – линия предельной концентрации компонента В в компоненте А; fn – линия предельной концентрации компонента А в компоненте В. 4. Типовые сплавы системы. При концентрации компонентов, не превышающей предельных значений (на участках Аm и nВ), сплавы кристаллизуются аналогично сплавам твердым растворам с неограниченной растворимостью, см кривую охлаждения сплава I на рис. 5.5 б. При концентрации компонентов, превышающей предельные значения (на участке dcf), сплавы кристаллизуются аналогично сплавам механическим смесям, см. кривую охлаждения сплава II на рис. 5.5 б. 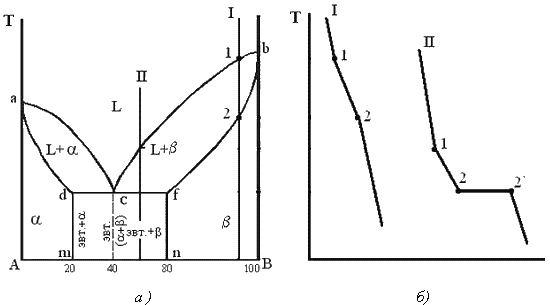 Рис. 5.5 Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии (а) и кривые охлаждения типичных сплавов (б) Сплав с концентрацией компонентов, соответствующей точке с, является эвтектическим сплавом. Сплав состоит из мелкодисперсных кристаллов твердых растворов Кристаллы компонентов в чистом виде ни в одном из сплавов не присутствуют. Диаграмма состояния сплавов, испытывающих фазовые превращения в твердом состоянии (переменная растворимость) Диаграмма состояния представлена на рис. 5.7. По внешнему виду диаграмма похожа на диаграмму состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии. Отличие в том, что линии предельной растворимости компонентов не перпендикулярны оси концентрации. Появляются области, в которых из однородных твердых растворов при понижении температуры выделяются вторичные фазы. На диаграмме: df – линия переменной предельной растворимости компонента В в компоненте А; ek – линия переменной предельной растворимости компонента А в компоненте В. Кривая охлаждения сплава I представлена на рис. 5.7 б. 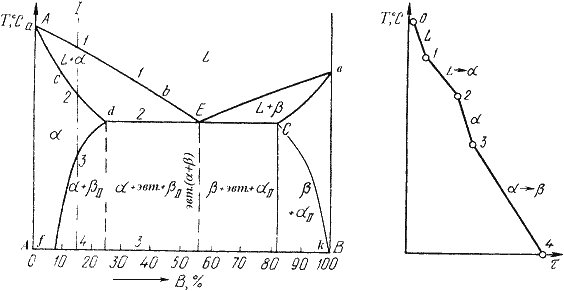 Рис. 5.7. Диаграмма состояния сплавов, испытывающих фазовые превращения в твердом состоянии (а) и кривая охлаждения сплава (б) Процесс кристаллизации сплава I: до точки 1 охлаждается сплав в жидком состоянии. При температуре, соответствующей точке 1, начинают образовываться центры кристаллизации твердого раствора Связь между свойствами сплавов и типом диаграммы состояния Так как вид диаграммы, также как и свойства сплава, зависит от того, какие соединения или какие фазы образовали компоненты сплава, то между ними должна существовать определенная связь. Эта зависимость установлена Курнаковым, (см. рис. 5.8.). 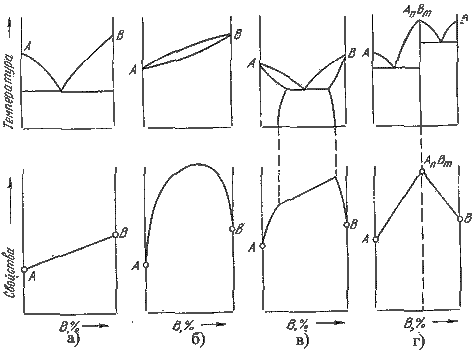 Рис. 5.8. Связь между свойствами сплавов и типом диаграммы состояния
На приведенном графике зависимости предела текучести σТ от плотности дислокаций ρ участок 1 соответствует прочности теоретической, 2 – прочности «усов», 3 – технически чистых металлов, 4 - упрочненных металлов. 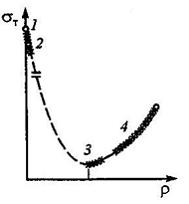
|
