вяжущий вещество. Лекция 1 Неорганические вяжущие Изучаемые вопросы Фазовый состав
 Скачать 362.51 Kb. Скачать 362.51 Kb.
|
Формулировка закона ГессаТепловойэффектреакциине зависитотпромежуточных стадийиопределяетсятольконачальнымиконечнымсостояниемсистемы. Следствия закона ГессаСледствие 1.Тепловой эффект разложения какого-либо соединения равен, но противоположен по знаку тепловому эффекту образования этого соединения. ΔНразложения = -ΔНобразования Следствие2. Если две реакции имеют одинаковое начальное состояние и разные конечные, то разность их тепловых эффектов равна тепловому эффекту перехода из одного конечного состояния в другое. 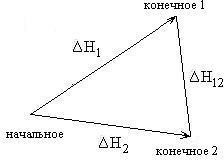 ΔН12 = ΔН2-ΔН1 Следствие 3. Если две реакции из различных начальных состояний приходят к одному конечному, то разность их тепловых эффектов равна тепловому эффекту перехода из одного начальное состояние в другое. 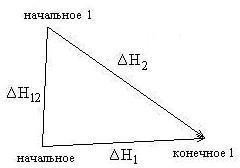 ΔН12 = ΔН1-ΔН2 Следствие 4. Тепловой эффект реакции равен алгебраической сумме теплот образования продуктов реакции минус алгебраическая сумма теплот образования исходных веществ. Тепловой эффект процесса зависит от температуры. Эта зависимость определяется законом Кирхгофа, который формулируется следующим образом: «Частная производная от теплового эффекта по температуре равна разности теплоемкости системы в конечном и исходном состояниях». Второе_начало_термодинамики._Энтропия._Свободная_энергия_Гельмгольца.'>Второе начало термодинамики. Энтропия. Свободная энергия Гельмгольца. Свободная энергия Гиббса. Термохимические расчеты. Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами. Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая, что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не может равняться абсолютному нулю (невозможно построить замкнутый цикл, проходящий через точку с нулевой температурой). Энтропия (S) – термодинамическая функция состояния, которая служит мерой беспорядка (неупорядоченности) системы. Возможность протекания эндотермических процессов обусловлена изменением энтропии, ибо в изолированных системах энтропия самопроизвольно протекающего процесса увеличивается ΔS > 0 (второй закон термодинамики). Комбинация F = U – TS., в сущности описывающая работу, при постоянных Т и V является функциейсостояния. Ее называют изохорно-изотермическимпотенциаломГельмгольца или свободнойэнергиейвопределенииГельмгольца. По физическому смыслу свободная энергия - это та свободная часть внутренней энергии U, которую система только и может превратить в работу. При осуществлении процессов при постоянных температуре и объеме она носит имя Гельмгольца. К такого рода процессам относятся, например, действия, совершаемые с помощью электрохимических источников тока. изобарно-изотермическийпотенциалГиббса, или свободнаяэнергияГиббса. По физическому смыслу свободная энергия Гиббса - это та часть теплосодержания Н, которое тело может превратить в работу при постоянных температуре и давлении F= Н– TS Термохимическиерасчёты Закон Гесса: тепловойэффект реакции, протекающей припостоянном давлениии(или)объеме,зависитотприродыисостоянияисходныхвеществиконечныхпродуктов,но независитотпутиреакции. Закон Гесса лежит в основе термохимических расчетов. СледствиеиззаконаГесса: энтальпияхимическихреакцийравнасуммеэнтальпий образования продуктов реакций за вычетом суммы энтальпий образованияисходныхвеществ с учетом ихстехиометрических коэффициентов. Кинетика гетерогенных процессов. Скорость химической реакции. Основные закономерности протекания твердофазных реакций. Гетерогенные реакции – это реакции между химическими реагентами, находящимися в различных агрегатных состояниях. Таких процессов очень много. К ним относятся горение топлив, взаимодействие металлов с кислотами, получение азотной кислоты абсорбцией оксидов азота водой, выщепачивание кислотами руд, обработка нефтепродуктов серной кислотой и др. Особенностью гетерогенных процессов является то, что взаимодействие между реагентами происходит на границе раздела фаз. На скорость таких реакций влияют как химические так и физические факторы. К последним относятся величина поверхности раздела фаз и быстрота переноса вещества из объема к границе раздела и от нее в объем. Для увеличения поверхности раздела фаз необходимо твердое вещество измельчать и распылять один из двух несмешивающихся жидких реагентов. Следовательно, на скорость гетерогенных реакций влияет степень дисперсности реагента. Так как твердое вещество в результате взаимодействия изменяет только свою массу (концентрация его всегда постоянна), то в кинетическое уравнение закона действующих масс твердое вещество не включается. Как уже было сказано, химическая реакция в гетерогенных системах протекает на поверхности раздела фаз. Для того, чтобы непрерывно протекала реакция необходима постоянная доставка реагента к поверхности раздела фаз и уноса с нее уже образовавшегося вещества. Как видим, процесс делится на три последовательные стадии: диффузия реагента в зону взаимодействия, химическая реакция, удаление продукта реакции. В соответствии с теорией диффузии: диффузионный поток тем интенсивнее, чем большн разность между концентрацией реагента в данной точке объема (Со) и в зоне реакции (Ср), больше коэффициент диффузии Д и меньше тощина слоя (δ), через который происходит массопередача. В случае стационарного режима (т.е. режима, при котором за рассматриваемый промежуток времени на реакцию расходуется все вещество, доставленное к поверхности раздела фаз), скорость реакции может быть расчитана по следующему уравнению, связывающему скорость процесса с химическим (К) и диффузионным (Д/δ=β) факторами. V=(K*β/K+β)*Со Здесь встречается два случая: Медленно протекает сама химическая реакция. (К мало, “химическое сопротивление” К–1 значительное. Процесс протекает в так называемой кинетической области. Для увеличения скорости необходимо применять теже способы воздействия на реакцию, как в гомогенных системах. Медленным является сам процесс переноса вещества (велико “диффузионное сопротивление” β–1). В этом случае для увеличения скорости применяют перемешивание. Правило фаз Гиббса. Диаграммы состояния однокомпонентных, двухкомпонентных и трехкомпонентных систем. Пра́вило фаз Ги́ббса, закон термодинамики многофазных многокомпонентных систем, согласно которому число фаз, сосуществующих в равновесии, не превосходит числа независимых компонентов более чем на 2. Установлено Дж.У.Гиббсом в 1875. Правило фаз Гиббса определяет соотношение между числом фаз (Ф), компонентов (К), внешних переменных (П) и числом степеней свободы или вариантности (С) термодинамической системы, находящейся в равновесии и записывается следующим образом: С = К + 2 – Ф; Цифра 2 в правиле фаз связана с существованием 2-х переменных (температуры и давления), одинаковых для всех фаз. Однокомпонентные системы. Однокомпонентной системой является любое простое в-во или хим. соед., обладающее строго определенным составом в газообразном, жидком и твердом состояниях. Диаграммы состояния обычно строят на плоскости в координатах Т-р (рис. 1). Фазовые поля (области существования) пара V, жидкости L и твердой фазы S дивариантны, т.е. допускают одновременное изменение двух параметров состояния - Т и р. 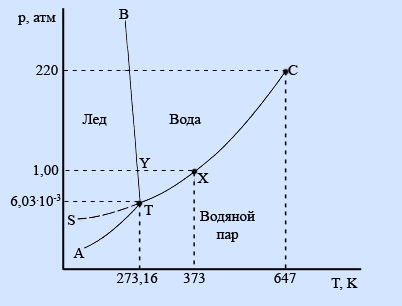 Двойные системы. Состояние двойной системы определяется тремя независимыми параметрами - Т, р и содержанием х одного из компонентов, поэтому диаграмма состояния такой системы трехмерна. Обычно принимают постоянными Т или р и рассматривают соответствующие плоские сечения диаграммы состояния, называемые соотв.изотермич. (р – х)или изобарными (Т – х)диаграммами состояния. Различают диаграммы плавкости и растворимости Диаграммы плавкости. Такие диаграммы состояния служат для установления условий равновесия между твердыми и жидкими фазами. Диаграммы растворимости. При отсутствии в системе твердых фаз диаграмма состояния состоит из области существования одной жидкой фазы (т. наз. области гомогенности) и области сосуществования двух насыщенных жидких р-ров разного состава, образующих несмешивающиеся друг с другом слои 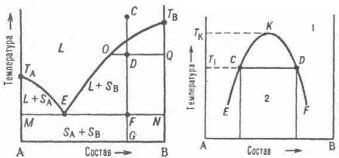 Тройные системы. Состояния тройных систем однозначно определяются четырьмя независимыми параметрами: Т, р и молярными (массовыми) долями двух компонентов (доля третьего компонента определяется из условия равенства единице суммы долей всех компонентов). Поэтому при построении диаграмм состояния тройных систем один из независимых параметров (р или Т) или два (р и T) фиксируют и рассматривают пространственные изобарные или изотермич. диаграммы или плоские изобарно-изотермич. диаграммы, соответствующие одному из сечений пространственной диаграммы состояния. Каждому составу тройной смеси отвечает определенная точка на плоскости составов. Область возможных составов тройных систем наз. композиционным треугольником или треугольником составов. В системе прямоугольных координат он представляет собой прямоугольный равнобедренный треугольник, вершины к-рого отвечают компонентам А, В и С, а стороны - двойным смесям АВ, ВС и СА. 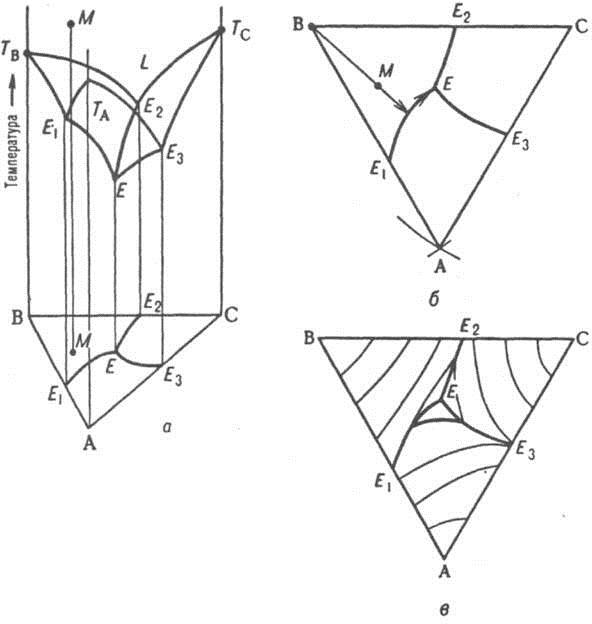 Изделия из керамических материалов. Классификация керамических материалов: тонкая керамика, грубая керамика. Физические и химические свойства фарфора. Керамические изделия, так же как и стеклянные, входят в группу силикатных товаров. Керамическими называют изделия, изготовленные в основном из глинистых материалов и обожженные для придания прочности. В зависимости от температуры обжига, а также состава массы черепок керамических изделий может получиться пористым или сплошным (спекшимся). Чтобы сделать поверхность керамических изделий гладкой, легко очищающейся и не впитывающей влаги, ее покрывают глазурью, представляющей собой тонкий слой стеклообразной массы. По характеру строения черепка различают изделия с пористым и спекшимся (плотным) черепком, а также изделия грубой и тонкой керамики. У изделий грубой керамики черепок имеет в изломе зернистое строение (макронеоднородное). Большинство строительных керамических изделий — строительный кирпич, черепица, канализационные трубы и т. д.— являются изделиями грубой керамики. У изделий тонкой керамики излом черепка имеет макрооднородное строение. Он может быть пористым, как например, у фаянсовых облицовочных глазурованных плиток, и спекшимся, как у плиток для полов, кислотостойкого кирпича, фарфоровых изделий. Черепок фарфора, кроме того, обладает просвечиваемостью. Физические свойства. К ним относятся плотность, белизна, просвечиваемость, механическая прочность черепка и глазури, блеск и твердость глазури, термическая стойкость, электрическая прочность и др. Они зависят от структурных элементов черепка, и, прежде всего, от соотношения стекловидной и кристаллической фаз, а также от количества и характера пор и наличия дефектов в виде трещин. На некоторые свойства фарфора влияет также толщина черепка и глазури. Плотность фарфора 2,4—2,5 г/см3, объемная масса на 1/10меньше плотности. Фарфор имеет плотный спекшийся черепок с пористостью по водопоглощению не более 0,2 %. Белизна является важным показателем качества фарфора. Она зависит от наличия в сырьевых материалах примесей железа, титана, хрома и других окрашивающих соединений, а также от режима и среды в печи при обжиге. Исходные материалы очищают от окрашивающих примесей. Если окись железа находится в массе в виде мельчайших частиц, то на изделиях могут появиться темные рассредоточенные точки — мушки, которые снижают белизну и ухудшают внешний вид изделий. Крупные включения окиси железа при обжиге выплавляются, оставляя темное пятно или сквозное отверстие. Снижение белизны фарфора может произойти и за счет неполного выгорания углерода при обжиге в окислительной среде и неполного восстановления оксидов трехвалентного железа в двухвалентное. Оксиды трехвалентного железа придают черепку желтоватый оттенок, а двухвалентного — синеватый. Белизна фарфора повышается с увеличением в массе каолина. Существенно влияет на белизну фарфора наличие глазурного слоя и его толщина: с увеличением толщины глазурного слоя она снижается. Просвечиваемость фарфора зависит от содержания стекловидной фазы, на что влияет количество в массе плавней, степень их дисперсности, а также температура обжига. С увеличением в черепке полевошпатового стекла при одновременном снижении содержания глинистых материалов просвечиваемость возрастает. Она улучшается и при повышении температуры обжига. Кристаллы муллита, остаточного кварца и особенно пузырьки газа и поры снижают просвечиваемость. Механическаяпрочность имеет большое практическое значение. Для фарфора различают прочность черепка и прочность глазури. Прочность черепка зависит от соотношения кристаллической и стекловидной фаз, его толщины и пористости. С увеличением кристаллической фазы прочность черепка повышается. При увеличении толщины изделия на 0,5 мм механическая прочность возрастает на 12— 17 %. Изделия из массы с повышенным содержанием глинистых материалов (50—54 %) имеют болee высокую механическую прочность. На механическую прочность черепка влияет степень дисперсности зерен кварца: чем тоньше помол, тем выше прочность за счет уменьшения пористости. Фарфор, как и стекло, в 12—13 раз лучше сопротивляется сжатию, чем растяжению. На прочность фарфоровых изделий заметное влияние оказывает и толщина глазурного слоя. Чем тоньше слой глазури, тем выше прочность изделий, особенно если глазурь находится в состоянии сжатия. Если глазурь находится в состоянии растяжения, то прочность изделий резко снижается. Блескитвердостьглазури являются важными показателями фарфоровых изделий, характеризующими их внешний вид и пригодность для использования по назначению. Блеск глазури придает изделиям красивый внешний вид и noвышает их санитарно-гигиенические свойства, так как гладкие изделия меньше загрязняются и легче очищаются. Он зависит от количества зеркально и диффузно отраженного от поверхности света и от коэффициента преломления, с повышением которого блеск увеличивается. Чем ровнее поверхность глазурного слоя и меньше шероховатость, тем выше блеск. По изменению блеска глазури можно судить о появлении микротрещин, которые со временем увеличиваются. Блеск глазури зависит от ее состава, температуры обжига и среды, а также от наличия в ней различных газовых включений и коэффициента преломления. Повышенным блеском характеризуются свинцовые, стронциевые и титановые глазури, а также глазури, содержащие редкоземельные элементы. Воздушные и газовые включения, присутствующие в стекловидной фазе глазури, сильно снижают ее блеск. При соответствии температуры политого обжига температуре плавления глазури достигается хороший блеск. Если температура обжига ниже, то глазурь имеет матовость в результате неполного расплавления. Твердость глазури — важный эксплуатационный показатель, характеризующий поведение глазурного слоя при пользовании режущими и другими столовыми приборами. Глазурь не должна разрушаться столовыми приборами, на ней не должны оставаться штрихи от ножа, вилки. Твердость глазури зависит от ее химического состава. Большей твердостью характеризуются полевошпатовые глазури, более мягкие — свинцовые и баритовые. Фарфоровые глазури являются твердыми, майоликовые — мягкими, а фаянсовые глазури относятся к средним. Термическаястойкость обусловливает надежность фарфоровых изделий и возможность использования их по назначению. Эти изделия в процессе эксплуатации часто подвергаются воздействию разных температур. Низкая термическая стойкость приводит к преждевременному износу и выходу из строя фарфоровых изделий. Термическая стойкость фарфора так же, как и стеклоизделий, зависит от химического состава черепка и глазури, соответствия их коэффициентов термического расширения, формы изделия, толщины черепка и глазури, прочности и модуля упругости и репка, а также от теплопроводности и плотности. Термическая стойкость изделий сложной конфигурации снижается с увеличением толщины глазурного слоя. Она уменьшается по мере повышения в черепке стекловидной фазы и возрастает с увеличением муллита. Однако при насыщении полевошпатового пекла глиноземом и кварцем термостойкость повышается, так как их коэффициенты термического расширения в стекловидной фазе уменьшаются. Заметно влияют на снижение термической стойкости инородные включения, микротрещины и другие дефекты черепка и глазурного слоя. Трещины глазури чаще всего образуются, когда у глазури коэффициент термического расширения выше, чем у черепка. Если термическое расширение черепка выше, чем глазури, то происходит отскок глазури, что ухудшает внешний вид изделий. С появлением трещин сильно снижается блеск глазури. |
