вяжущий вещество. Лекция 1 Неорганические вяжущие Изучаемые вопросы Фазовый состав
 Скачать 362.51 Kb. Скачать 362.51 Kb.
|
ЦементныйкаменьСтруктура цементного камня. Выделяют основные элементы структуры цементного камня: Непрореагировавшиезернаклинкера, количество которых постепенно уменьшается. Относительно крупные кристаллы Ca(OH)2 и эттрингита (ГСАК), образующие каркас цементного камня, который увеличивает его упругие свойства, жесткость. Мелкие гелевидные частички гидросиликатов кальция – цементный клей, который играет роль матрицы, придает цементному камню связанность и деформативные свойства. Соотношение кристаллической и гелевой составляющих определяет индивидуальные физико-механические свойства цементного камня: прочность, деформативность и т.д. При этом указанное соотношение зависит от химического и минерального состава цемента. Очень мелкие гелевые поры (в которых вода замерзает только при -50 °С и ниже и не перемещается под действием силы тяжести). Эти поры большого влияния на свойства цемента не оказывают. Капиллярные поры (размером 0,1-20 мкм), которые получаются за счет испарения излишней воды затворения, не вступившей в химические реакции. Они не желательны, так как в них вода замерзает уже ниже -5 °С, что опасно с точки зрения морозостойкости. С другой стороны, вода поглощается в эти поры даже из воздуха за счет капиллярной конденсации. Количество этих пор необходимо уменьшать за счет снижения начального количества воды затворения. Крупныевоздушныепоры (от 50-100 мкм до 2 мм), которые появляются за счет вовлечения воздуха в бетонную и растворную смесь при перемешивании. Они, как правило, замкнутые и имеют положительное значение, так как, в отличие от капиллярных пор, обычно не заполняются водой и в большей степени снижают теплопроводность материала и, кроме того, не только не снижают, а даже увеличивают его морозостойкость (играют роль резервных пор). В порах цементного камня обычно присутствует жидкаяфаза, которая представляет собой водные растворы щелочей, прежде всего Ca(OH)2. Это обусловливает отсутствие коррозии стальной арматуры в цементном бетоне при достаточной концентрации раствора Са(ОН)2 вследствие «пассивирующего» действия щелочи по отношению к стали. Портландцемент. Процессы в печи при обжиге портландцемента. Твердение портландцемента. Механизмтверденияпортландцемента Превращение цементного теста в камневидное тело обусловлено сложными химическими и физико-химическими процессами взаимодействия клинкерных минералов с водой, в результате которых образуются новые гидратные соединения, практически нерастворимые в воде. В то же время, есть один неоспоримый момент, определяющий все возможные дальнейшие (растворительные, гидролизные, химические, конденсационные, кристаллизационные и др.) преобразования – это момент контакта поверхности цементных частиц с высокоорганизованной жидкой средой. Следовательно, прежде чем рассматривать вероятность тех или иных вторичных и зависимых последующих стадий, явлений и процессов, необходимо уточнить возможное «конструктивное устройство» формирующейся на границе раздела фаз «клинкерное зерно – вода» энергетической композиции? И чем достовернее данное уточнение, тем более объективным и всесторонним будет логическая трактовка дальнейшего развития процесса. Показано, что особенностью структуры силикатов кальция является наличие неравномерной электронной плотности на Si-O-Ca-cвязи, вследствие чего кислородные атомы образуют неравноценные связи – ковалентные с атомами кремния и более ионные – с кальцием (≡Si-O―Ca―O-Si≡). Данный аспект находит широкое подтверждение в экспериментально-теоретических исследованиях на протяжении многих десятилетий. Другой химически активный компонент – вода, структуре и свойствам которой обычно не уделяется должного внимания, рассматривается, как некая вспомогательная среда, в которой осуществляются растворительные, химические, кристаллизационные и прочие явления. Между тем, молекулы воды – достаточно «эластичные» и чрезвычайно чувствительные объекты. Посредством водородных связей диполи создают временные межмолекулярные энергетические структуры (рис.2.1), так называемые «кластеры» или «мерцающие группы» типа (Н2О)n. Таким образом, в основе (первопричиной) взаимодействия гетерогенной системы «цемент – вода», несомненно, лежат силы электростатической природы. Под действием электромагнитного поля поверхностных элементов кристаллической решетки цементных минералов происходит мгновенное перераспределение высокоорганизованных диполей на границе раздела фаз, определенная их ориентация, создание своеобразной энергетической структуры (цементной «мицеллы» по Г.Н. Сиверцеву), коренным образом влияющей на дальнейшее развитие гидратационного процесса. Превращение цементного теста в камневидное тело обусловлено сложными химическими и физико-химическими процессами взаимодействия клинкерных минералов с водой, в результате которых образуются новые гидратные соединения, практически нерастворимые в воде. Бетоны. Структура бетона. Формирование и состав твердой фазы бетона. Влияние отдельных технологических факторов на структуру порового пространства цементного камня. Бетон- композиционный материал, получаемый в результате твердения вяжущей системы с крупным и мелким заполнителями Для бетонных смесей в качестве наполнителей используют измельчённые кварцевые пески, известняки, глиежи, диатомиты, доломиты, туфы, золы-уносы ТЭС, доменные, ваграночные, электротермофосфорные шлаки и др. К числу наиболее распространенных заполнителей относятся: естественные (песок, гравий, щебень на основе горных пород) и искусственные (керамзит, золошлаковые отходы и др.). В ряде случаев портландцемент выделяют из большого многообразия вяжущих веществ в самостоятельный класс, а другие цементы, чье твердение не связано с преимущественной гидратацией высокоосновных силикатов кальция, рассматривают как специальные. Ряд свойств цементного камня является следствием формирования пористой структуры и проницаемости цементного камня. Главное из этих свойств - морозостойкость цементного камня. Основным фактором морозостойкости является структура порового пространства. Если все поры в камне будет заполнены водой, разрушение должно произойти уже после первого цикла замораживания. Морозостойкость обусловлена присутствием в структуре определенного объема пор, не заполненных водой, в которые отжимается часть воды при замораживании. При твердении цементного камня возникает система пор, заполненных паро-воздушной смесью, так называемые "резервные поры", наличие которых и определяет морозостойкость цементного камня. Водоцементное отношение. Влияние тонкости помола и минералогического состава цемента на структуру порового пространства. При затворении цемента водой вокруг диспергированных частиц цемента образуются водные оболочки, толщина которых колеблется около десятых долей микрона. Количество воды, необходимое для покрытия зёрен сухого цемента такими оболочками (сольватным слоем), отнесённое к массе цемента, представляет собой максимальную молекулярную влагоёмкость цемента. Эту характеристику цемента называют его водопотребностью или нормальной густотой цементного теста. Тонкость помола цемента - характеристика дисперсности цемента, которая может быть выражена: массовой долей остатка (прохода) на одном или нескольких контрольных ситах; величиной удельной поверхности. При увеличении тонкости помола увеличивается плотность и уменьшается общая пористость. Это говорит о необходимости увеличения удельной поверхности до максимально возможной. Однако общая пористость не дает полного представления о поровом пространстве и, следовательно, о стойкости бетона к агрессивным средам. Поэтому было предложено разделить пористость на виды – сквозную и тупиковую, а сами поры подразделить по диаметру и происхождению. Водопотребность цемента зависит от вещественного состава цемента (количества и вида гидравлических или инертных добавок), тонкости помола цемента и фазового состава клинкера. Водопотребность цементов (нормальная густота) увеличивается при переходе от бездобавочных цементов к цементам с минеральными добавками и к цементам, содержащим большое количество добавок (ППЦ, ШПЦ) от 25 – 27 % до 31 – 33 %. Повышение тонкости помола цемента также увеличивает его водопотребность, влияние фазового состава клинкера менее заметно, однако, увеличивается при переходе от низкоалюминатных цементов к высокоалюминатным. Эффективным способом снижения водопотребности цемента является применение добавок водопонизителей - пластификаторов, суперпластификаторов, гиперпластификаторов. Поверхностные явления. Поверхностно-активные вещества (ПАВ), поверхностно- инактивные вещества. Адсорбция. Адгезия. Поверхностные явления протекают на границах раздела фаз и обусловлены особыми свойствами поверхностных слоев. ПАВ (поверхностно-активные вещества) — вещества, понижающие поверхностное натяжение водных растворов. Неионогенные ПАВ — спирты, альдегиды, кетоны, сложные эфиры. Ионогенные ПАВ — органические кислоты, амины и их соли. ПИВ (поверхностно-инактивные вещества) — вещества, повышающие поверхностное натяжение водных растворов. Сильные неорганические электролиты — соли, кислоты, щелочи. ПНВ (поверхностно-неактивные вещества) — вещества, не изменяющие поверхностное натяжение водных растворов (многоатомные спирты, углеводы). Коллоидные_растворы_и'>Дисперсные системы. Классификация дисперсных систем. Коллоидные растворы и истинные растворы. Устойчивость дисперсных систем. Дисперсными называют гетерогенные системы, в которых одно вещество в виде очень мелких частиц равномерно распределено в объеме другого. То вещество, которое присутствует в меньшем количестве и распределено в объеме другого, называют дисперснойфазой. Она может состоять из нескольких веществ. Вещество, присутствующее в большем количестве, в объеме которого распределена дисперсная фаза, называют дисперсионной средой. Между ней и частицами дисперсной фазы существует поверхность раздела, поэтому дисперсные системы называют гетерогенными (неоднородными). Дисперсионную среду, и дисперсную фазу могут представлять вещества, находящиеся в различных агрегатных состояниях — твердом, жидком и газообразном. В зависимости от сочетания агрегатного состояния дисперсионной среды и дисперсной фазы можно выделить 9 видов таких систем. 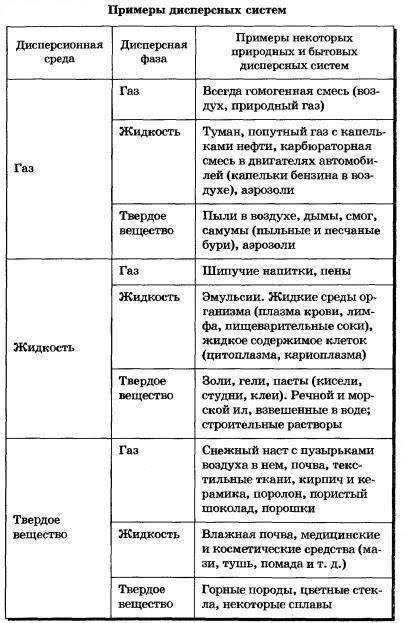 По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делят на грубодисперсные (взвеси) с размерами частиц более 100 нм и тонкодисперсные (коллоидные растворы или коллоидные системы) с размерами частиц от 100 до 1 нм. Если же вещество раздроблено до молекул или ионов размером менее 1 нм, образуется гомогенная система — раствор. Она однородна (гомогенна), поверхности раздела между частицами и средой нет. Коллоидные системы — это такие дисперсные системы, в которых размер частиц фазы от 100 до 1 нм. Эти частицы не видны невооруженным глазом, и дисперсная фаза и дисперсионная среда в таких системах отстаиванием разделяются с трудом. Их подразделяют на золи (коллоидные растворы) и гели (студни). Коллоидныерастворы,илизоли. Это большинство жидкостей живой клетки (цитоплазма, ядерный сок — кариоплазма, содержимое органоидов и вакуолей) и живого организма в целом (кровь, лимфа, тканевая жидкость, пищеварительные соки, гуморальные жидкости и т. д.). Такие системы образуют клеи, крахмал, белки, некоторые полимеры. Коллоидные растворы могут быть получены в результате химических реакций; например, при взаимодействии растворов силикатов калия или натрия («растворимого стекла») с растворами кислот образуется коллоидный раствор кремниевой кислоты. Золь образуется и при гидролизе хлорида железа (Ш) в горячей воде. Коллоидные растворы внешне похожи на истинные растворы. Их отличают от последних по образующейся «светящейся дорожке» — конусу при пропускании через них луча света. 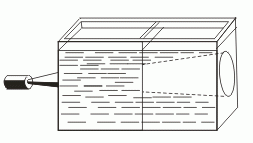 Это явление называют эффектомТиндаля. Более крупные, чем в истинном растворе, частицы дисперсной фазы золя отражают свет от своей поверхности, и наблюдатель видит в сосуде с коллоидным раствором светящийся конус. В истинном растворе он не образуется. Аналогичный эффект, но только для аэрозольного, а не жидкого коллоида, вы можете наблюдать в кинотеатрах при прохождении луча света от киноаппарата через воздух кинозала.  Частицы дисперсной фазы коллоидных растворов нередко не оседают даже при длительном хранении из-за непрерывных соударений с молекулами растворителя за счет теплового движения. Они не слипаются и при сближении друг с другом из-за наличия на их поверхности одноименных электрических зарядов. Но при определенных условиях может происходить процесс коагуляции. Частицы дисперсной фазы коллоидных растворов нередко не оседают даже при длительном хранении из-за непрерывных соударений с молекулами растворителя за счет теплового движения. Они не слипаются и при сближении друг с другом из-за наличия на их поверхности одноименных электрических зарядов. Но при определенных условиях может происходить процесс коагуляции.Коагуляция — явление слипания коллоидных частиц и выпадения их в осадок — наблюдается при нейтрализации зарядов этих частиц, когда в коллоидный раствор добавляют электролит. При этом раствор превращается в суспензию или гель. Некоторые органические коллоиды коагулируют при нагревании (клей, яичный белок) или при изменении кислотно-щелочной среды раствора. Гели, или студни, представляющие собой студенистые осадки, образующиеся при коагуляции золей. К ним относят большое количество полимерных гелей, столь хорошо известные вам кондитерские, косметические и медицинские гели (желатин, холодец, желе, мармелад, торт «Птичье молоко») и конечно же бесконечное множество природных гелей: минералы (опал), тела медуз, хрящи, сухожилия, волосы, мышечная и нервная ткани и т. д. Историю развития жизни на Земле можно одновременно считать историей эволюции коллоидного состояния вещества. Со временем структура гелей нарушается — из них выделяется вода. Это явление называют синерезисом. Растворы называют истинными, если требуется подчеркнуть их отличие от коллоидных растворов. Растворителем считают то вещество, агрегатное состояние которого не изменяется при образовании раствора. Например, вода в водных растворах поваренной соли, сахара, углекислого газа. Если же раствор образовался при смешении газа с газом, жидкости с жидкостью и твердого вещества с твердым, растворителем считают тот компонент, которого больше в растворе. Так, воздух — это раствор кислорода, благородных газов, углекислого газа в азоте (растворитель). Столовый уксус, в котором содержится от 5 до 9% уксусной кислоты, представляет собой раствор этой кислоты в воде (растворитель — вода). Но в уксусной эссенции роль растворителя играет уксусная кислота, так как ее массовая доля составляет 70— 80%, следовательно, это раствор воды в уксусной кислоте. При кристаллизации жидкого сплава серебра и золота можно получить твердые растворы разного состава. Растворы подразделяют на: Молекулярные – это водные растворы неэлектролитов – органических веществ (спирта, глюкозы, сахарозы и т. д.); молекулярно-ионные – это растворы слабых электролитов (азотистой, сероводородной кислот и др.); ионные – это растворы сильных электролитов (щелочей, солей, кислот — NaOH, K2SO4, HNO3, НС1О4). Раньше существовали две точки зрения на природу растворения и растворов: физическая и химическая. Согласно первой растворы рассматривали как механические смеси, согласно второй — как нестойкие химические соединения частиц растворенного вещества с водой или другим растворителем. Последняя теория была высказана в 1887 г. Д. И. Менделеевым, который посвятил исследованию растворов более 40 лет. Современная химия рассматривает растворение как физико-химический процесс, а растворы как физико-химические системы. Более точное определение раствора таково: Раствор — гомогенная (однородная) система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия. Устойчивость дисперсных систем характеризуется постоянством дисперсности (распределения частиц по размерам) и концентрации дисперсной фазы (числом частиц в единице объема). Наиболее сложна в теоретическом аспекте и важна в практическом отношении проблема устойчивости аэрозолей и жидких лиофобных дисперсных систем. Различают седиментационную устойчивость и устойчивость к коагуляции (агрегативную устойчивость). Седиментационно устойчивы коллоидные системы с газовой и жидкой дисперсионной средой, в которых броуновское движение частиц препятствует оседанию; грубодисперсные системы с одинаковой плотностью составляющих их фаз; системы, скоростью седиментации в которых можно пренебречь из-за высокой вязкости среды. В агрегативно устойчивых дисперсных системах непосредственно контакты между частицами не возникают, частицы сохраняют свою индивидуальность. При нарушении агрегативной устойчивости дисперсных систем частицы, сближаясь в процессе броуновского движения, соединяются необратимо или скорость агрегации становится значительно больше скорости дезагрегации. Между твердыми частицами возникают непосредственные точечные ("атомные") контакты, которые затем могут превратиться в фазовые (когезионные) контакты, а соприкосновение капель и пузырьков сопровождается их коалесценцией и быстрым сокращением суммарной площади межфазной поверхности. Для таких систем потеря агрегативной устойчивости означает также потерю седимeнтационной устойчивости. В агрегативно устойчивых системах дисперсный состав может изменяться вследствие изотермич. перегонки - молекулярного переноса вещества дисперсной фазы от мелких частиц к более крупным. Этот процесс обусловлен зависимостью давления насыщенного пара (или концентрации насыщенного раствора) от кривизны поверхности раздела фаз. Агрегативная устойчивость и длительное существование лиофобных дисперсных систем с сохранением их свойств обеспечивается стабилизацией. Для высокодисперсных систем с жидкой дисперсионной средой используют введение веществ - стабилизаторов (электролитов, ПАВ, полимеров. В теории устойчивости Дерягина-Ландау-Фервея- Овербека (теории ДЛФО) основная роль отводится ионно-электростатическому фактору стабилизации. Стабилизация обеспечивается электростатическим отталкиванием диффузных частей двойного электрического слоя, который образуется при адсорбции ионов электролита на поверхности частиц. При некотором расстоянии между частицами отталкивание диффузных слоев обусловливает наличие минимума на потенциальной кривой (дальний, или вторичный, минимум; смотри рисунок). Хотя этот минимум относительно неглубок, он может препятствовать дальнейшему сближению частиц, притягиваемых силами межмолекулярного взаимодействия. Ближний, или первичный, минимум соответствует прочному сцеплению частиц, при котором энергии теплового движения недостаточно для их разъединения. Сближаясь на расстояние, отвечающее этому минимуму, частицы объединяются в агрегаты, образование которых ведет к потере системой агрегативной устойчивости. При этом устойчивость системы к коагуляции определяется высотой энергетического барьера. 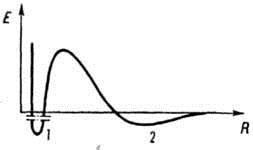 Зависимость энергии взаимодействия Емежду частицами от расстояния R: 1 и 2 - ближний и дальний минимумы соответственно. При введении в Дисперсные системы в качестве стабилизатора ПАВ фактором стабилизации может быть "термодинамическая упругость" пленок среды, разделяющей частицы. Стабилизация обеспечивается тем, что при сближении частиц, например, капель или газовых пузырей, происходит растяжение и утоньшение разделяющей их прослойки, содержащей ПАВ, и, как следствие, нарушение адсорбционного равновесия. Восстановление этого равновесия и приводит к повышению устойчивости прослойки среды, разделяющей частицы. Гидродинамич. сопротивление вытеснению жидкой дисперсионной среды из прослойки между сближающимися частицами - один из кинетических факторов стабилизации дисперсных систем. Он особенно эффективен в системах с высоковязкой дисперсионной средой, а при застекловывании последней делает систему неограниченно устойчивой к агрегации частиц и коалесценции. Структурно-механический фактор стабилизации, по П. А. Ребиндеру, возникает при образовании на межфазной границе полимолекулярных защитных слоев из мицеллообразующих ПАВ, высокомолекулярных соединений, а иногда и тонких сплошных или дискретных фазовых пленок. Межфазный защитный слой должен обладать способностью сопротивляться деформациям и разрушению, достаточной подвижностью для "залечивания" возникших в нем дефектов и, что особенно важно, быть лиофилизованным с внешней стороны, обращенной в сторону дисперсионной среды. Если защитный слой недостаточно лиофилен, он, предохраняя частицы откоалесценции. не сможет предотвратить коагуляции. Структурно- механический барьер является, по существу, комплексным фактором стабилизации, который включает термодинамические, кинетические и структурные составляющие. Он универсален и способен обеспечить высокую агрегативную устойчивость любых дисперсных систем с жидкой дисперсионной средой, в том числе высококонцентрированных, наиболее важных в практическом отношении. Основные свойства дисперсных систем определяются поверхностными явлениями: адсорбцией, образованием двойного электрического слоя и обусловленных им электрокинетических явлений, контактными взаимодействиями частиц дисперсной фазы. Размер частиц определяет оптические (светорассеяние и другие) и молекулярно- кинетические свойства (диффузия, термофорез, осмос и дрeubt). Дисперсные системы повсеместно распространены в природе. Это - горные породы, грунты, почвы, атмосферные и гидросферные осадки, растительные и животные ткани. Дисперсные системы широко используют в технологических процессах; в виде дисперсных систем выпускается большинство промышленных продуктов и предметов бытового потребления. Высокодисперсные технические материалы (наполненные пластики, дисперсноупрочненные композиционные материалы) отличаются чрезвычайно большой прочностью. На высокоразвитых поверхностях интенсивно протекают гетерогенные и гетерогенно-каталитические химические процессы. Учение о дисперсных систем и поверхностных явлениях в них составляет сущность коллоидной химии. Самостоятельный раздел коллоидной химии - физико-химическая механика - изучаeт закономерности структурообразования и механические свойства структурированных дисперсных систем и материалов в их связи с физико-химическими явлениями на межфазных границах. Первое начало термодинамики. Энтальпия. Закон Гесса, следствия закона Гесса. Закон Кирхгофа. Первоеначалотермодинамики. Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и на совершение работы над внешними телами: Q= ΔU + A. Энтальпия системы (от греч. enthalpo нагреваю) – это однозначная функция H состояния термодинамической системы при независимых параметрах энтропии Sи давлении P, которая связана с внутренней энергией Uсоотношением H= U+ PV, где V– объем системы. В химии чаще всего рассматривают изобарные процессы (P = const), и тепловой эффект в этом случае называют изменением энтальпии системы или энтальпией процесса: ΔH= ΔU + PΔV Энтальпия имеет размерность энергии (кДж). Ее величина пропорциональна количеству вещества; энтальпия единицы количества вещества (моль) измеряется в кДж∙моль–1. |
