Понятия и законы химии. Основные классы веществ. Лекция 1 Тема Основные законы и понятия химии. Основные классы веществ. Основные понятия
 Скачать 185.28 Kb. Скачать 185.28 Kb.
|
1 2 Лекция 1 Тема 1. Основные законы и понятия химии. Основные классы веществ.Основные понятия Атомом называется мельчайшая частица химического элемента, сохраняющая его химические свойства. Атом каждого элемента состоит из ядра, масса которого складывается из определенного количества протонов и нейтронов, и вращающихся вокруг него электронов, число которых равно числу протонов, т.е. заряду ядра. Заряд ядра равен порядковому номеру элемента в Периодической системе Д.И. Менделеева и является величиной, определяющей химические свойства элемента. Например, порядковый номер цинка – 30, это означает, что ядро его атома содержит 30 протонов, заряд ядра равен +30, число электронов в атоме цинка – тридцать. Атомы, обладающие одинаковым зарядом ядра (и, следовательно, тождественными химическими свойствами), но разным числом нейтронов, называются изотопами. Элементом называется вид атомов, характеризующихся определенной величиной положительного заряда ядра. Все открытые на Земле элементы систематизированы в таблице Д.И. Менделеева. Они подразделяются на металлы и неметаллы. Каждый элемент имеет свое название и символ (например, Na – натрий, Р – фосфор). Все вещества делятся на простые и сложные. Для большинства из них мельчайшей частицей является молекула, которая состоит из атомов, число которых и взаимное расположение в молекуле определяют свойства вещества. Молекула – это наименьшая частица вещества, обладающая его химическими свойствами. Молекулы могут состоять из атомов одного или нескольких элементов. Простое вещество – это вещество, состоящее из атомов одного элемента. Например: О2, Н2, Fe. С учетом аллотропных модификаций их насчитывается около 400. Мельчайшей частицей, сохраняющей свойства простого вещества, может быть атом, а может быть молекула. Например, простое вещество железо Fe состоит из атомов элемента железа, а простые вещества: кислород О2 и водород Н2 – из двухатомных молекул, образованных атомами одного элемента - кислорода и водорода. Атомы одного и того же элемента могут образовывать несколько простых веществ. Аллотропия – явление существования одного и того же элемента в виде нескольких простых веществ. Эти вещества называют аллотропными модификациями. Аллотропные модификации отличаются друг от друга строением, различием физических и химических свойств. Классическим примером аллотропии является элемент кислород О, существующий в виде двух простых веществ: кислорода, молекула которого состоит из двух атомов - О2 и озона, молекула которого состоит из трёх атомов - О3. Эти два вещества различаются и по физическим и по химическим свойствам. Сложное вещество, или соединение - это вещество, состоящее из атомов разных элементов. Вид и число атомов в молекуле вещества изображаются химической формулой. Например, формула серной кислоты – H2SO4. Это означает, что молекула этого вещества состоит из одного атома серы, двух атомов водорода и четырех атомов кислорода. Соотношение между числом атомов разных элементов в молекуле определяется валентностью этих элементов. Валентность элемента – это способность его атомов соединяться с другими атомами в определенных соотношениях (число связей, которыми данный элемент связан с другими атомами в молекуле вещества). Валентность – сложное понятие, его современное значение будет выяснено при изучении теории строения вещества. При составлении названий веществ, описании их свойств употребляется понятие степень окисления. Степень окисления – это условный заряд атома данного элемента в соединении, вычисленный, исходя из предположения, что все атомы в молекуле ионизированы, т.е. имеют заряд. Степень окисления может иметь положительное, отрицательное и нулевое значения, которые обычно ставятся над символом элемента сверху. Например, 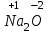 , , 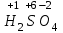  . Степень окисления элементов в простых веществах равна нулю . Степень окисления элементов в простых веществах равна нулю 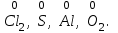 Степень окисления некоторых элементов в их соединениях имеет постоянное значение. К таким элементам относятся щелочные металлы (степень окисления +1), металлы II А подгруппы Периодической системы (+2), а также серебро Степень окисления некоторых элементов в их соединениях имеет постоянное значение. К таким элементам относятся щелочные металлы (степень окисления +1), металлы II А подгруппы Периодической системы (+2), а также серебро 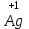 , цинк , цинк 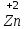 , кадмий , кадмий 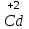 , алюминий , алюминий 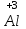 . Водород проявляет степень окисления +1 во всех соединениях, кроме гидридов, в которых степень окисления водорода равна –1 . Водород проявляет степень окисления +1 во всех соединениях, кроме гидридов, в которых степень окисления водорода равна –1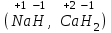 . Степень окисления кислорода практически постоянна и составляет –2. . Степень окисления кислорода практически постоянна и составляет –2.Большинство элементов имеет переменную степень окисления, например, 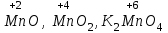 . .Массы атомов и молекул очень малы (10-25-10-20 г) и пользоваться ими при расчетах неудобно. Поэтому в химии введены относительные величины масс атомов и молекул, которые называются атомными или соответственно молекулярными массами. В качестве единицы измерения принята атомная единица массы (сокращенно а.е.м.), равная 1/12 массы атома изотопа углерода 12С. Относительной атомной массой (или атомной массой) элемента называется масса его атома, выраженная в атомных единицах массы. Атомные массы элементов определяются из таблицы Д.И. Менделеева, причем их значения принято округлять до целого числа. Исключение составляет масса хлора, равная 35,5. Относительной молекулярной массой (или молекулярной массой) простого или сложного вещества называется масса его молекулы, выраженная в атомных единицах массы. Атомные и молекулярные массы обычно приводятся без обозначения единицы измерения. Важнейшей количественной единицей в химии является величина, называемая молем. Моль – это количество вещества, содержащее столько молекул, атомов, ионов или других структурных единиц, сколько содержится атомов в 12 г изотопа углерода 12С. В одном моле любого вещества содержится 6,02×1023 структурных единиц. Число 6,02×1023 называется числом Авогадро. ¥ Применяя понятие «моль», необходимо в каждом конкретном случае указывать, какие именно структурные единицы имеются в виду. Например, следует различать моль атомов Н, моль молекул Н2, моль ионов Н+. В моле атомов, молекул, ионов водорода содержится 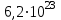 атомов, молекул, ионов водорода соответственно. атомов, молекул, ионов водорода соответственно.Масса 1 моль вещества называется молярной (или мольной) массой и выражается в г/моль. Численно масса 1 моль любых структурных единиц равна массе этой структурной единицы, выраженной в а.е.м. Вещества способны вступать между собой в химические реакции. Процессы, при которых одни вещества превращаются в другие, отличающиеся от исходных своим составом и свойствами, называются химическими. 1.2 Основные законы Закон сохранения массы. Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции. Этот закон является частным случаем основополагающего закона природы – закона сохранения материи. Закон постоянства состава. Одним из важнейших законов химии является закон постоянства состава. Всякое химически чистое индивидуальное вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав. Исходя из представлений атомно-молекулярной теории это означает, что каждое химически чистое вещество состоит из одинаковых молекул, в состав которых входят атомы определенных элементов. При этом соотношение между числом атомов каждого элемента и, следовательно, соотношение между их массами определяются молекулярной формулой вещества и остаются постоянными независимо от количества вещества и способа его получения. Законы сохранения массы вещества и постоянства состава в химии выражаются в составлении уравнения реакции, которое показывает, какие вещества и в каком количественном соотношении участвуют в данном процессе. Химическое уравнение состоит из двух частей, соединенных знаком равенства. В левой части записываются формулы веществ, вступающих в реакцию (исходные вещества), а в правой – формулы веществ, образующихся в результате реакции (продукты реакции). Согласно закону сохранения массы вещества число атомов каждого элемента в левой и правой частях уравнения должно быть одинаковым. Для этого в случае необходимости подбирают и расставляют перед формулами исходных и конечных веществ коэффициенты, которые называются стехиометрическими коэффициентами. Так, уравнение взаимодействия гидроксида алюминия с серной кислотой 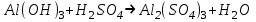 после подбора коэффициентов будет выглядеть следующим образом: 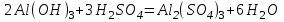 (1) (1)Коэффициенты в обеих частях уравнения химической реакции можно увеличивать или уменьшать в одинаковое число раз. Так, уравнение (1) можно записать следующим образом: 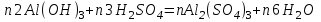 Примем n равным: 2. Тогда уравнение (1) будет иметь вид 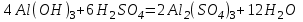 (2) (2) Все записанные уравнения удовлетворяют закону сохранения массы вещества. Обычно расставляют минимальные целочисленные коэффициенты, причем коэффициент 1 опускается. В рассмотренном примере таким уравнением является уравнение (1). Уравнение реакции считается составленным только тогда, когда подобраны коэффициенты. Если при подборе коэффициентов не удается уравнять количество атомов в обеих частях уравнения, то это означает, что формулы веществ, участвующих в реакции, написаны неправильно. Химические уравнения можно складывать и вычитать как обычные алгебраические уравнения, если продукты одной реакции являются исходными веществами для другой. В этом случае расставляются удобные для сложения или вычитания коэффициенты. Так, чтобы составить суммарное уравнение получения фосфорной кислоты из фосфора, кислорода и воды, надо составить два уравнения: 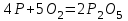 а) а)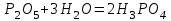 б) б)Чтобы исключить промежуточное вещество 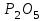 , надо удвоить коэффициенты в уравнении б) и сложить оба уравнения , надо удвоить коэффициенты в уравнении б) и сложить оба уравнения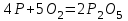 + 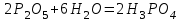 ______________________  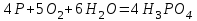 Если в реакции участвуют газообразные вещества, то на основании уравнения реакции можно определить не только массы реагирующих газов, но их объемы. Объем газа зависит от его количества, давления и температуры. Количественные расчеты объемов газообразных веществ, участвующих в химической реакции, базируются на законе Авогадро. В равных объемах любых газов, взятых при одинаковой температуре и давлении, содержится одно и то же число молекул. В соответствии с законом Авогадро одинаковое число молекул газа занимает при одних и тех же условиях одинаковый объем. С другой стороны, 1 моль любого вещества содержит (по определению) одинаковое число частиц. Отсюда следует важный вывод (следствие из закона Авогадро): При определенных температуре и давлении 1 моль любого вещества в газообразном состоянии занимает один и тот же объем. Поскольку объем данной массы газа зависит от давления и температуры, то при расчетах по химическим реакциям с участием газообразных веществ необходимо указывать условия, при которых находится газ. Наиболее употребительными являются так называемые «нормальные условия» (н.у.). К нормальным условиям относятся: температура 00С (273К) и давление, равное 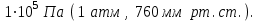 Объем 1 моль любого газообразного вещества при нормальных условиях (н.у.) равен 22,4л. Этот объем называется молярным или мольным объемом газа при нормальных условиях. ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ 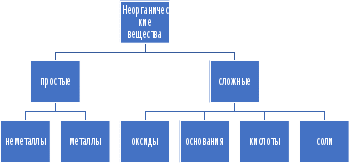 Индивидуальные химические вещества принято делить на простые и сложные. Среди сложных неорганических веществ выделяют четыре основных класса: оксиды, кислоты , основания и соли 2.1 Оксиды. 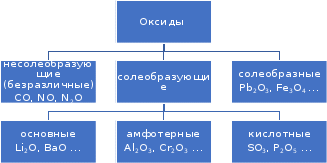 Оксидами называются вещества, состоящие из двух элементов, одним из которых является кислород. Примеры оксидов: NO, NO2, Mn2O7, Al2O3, ZnO, K2O. Названия оксидов образуются из слова “оксид” и названия элемента, образующего оксид, с указанием степени окисления этого элемента, которая записывается в скобках римской цифрой. Так, первые три из указанных оксидов называются: NO - оксид азота (П), NO2 - оксид азота (IV), Mn2O7 -оксид марганца (VII). В названиях последних трёх оксидов не указывается степень окисления элемента, поскольку она постоянна для этих элементов: Al2O3 - оксид алюминия, ZnO оксид цинка, K2O - оксид калия. 2.1.1 классификация оксидов. Оксиды по химическим свойствам подразделяются на солеобразующие и несолеобразующие, или безразличные. К солеобразующим оксидам относятся такие оксиды, которые при взаимодействии с кислотами или основаниями, а иногда и с кислотами, и с основаниями образуют соль. Безразличные оксиды не реагируют ни с кислотами, ни с основаниями, ни с водой. К ним относятся NO, N2O, CO. Солеобразующие оксиды способны образовывать соли. Они делятся на основные, кислотные и амфотерные. Основные оксиды - это оксиды, которым соответствуют основания. Так, оксиду натрия соответствует основание NaOH, а оксиду кальция CaO - основание Ca(OH)2. Кислотные оксиды – это оксиды, которым соответствуют кислоты. Оксиду серы (IV) SО2 - соответствует сернистая кислота Н2SО3, оксиду фосфора (V) - Р2О5 - фосфорная кислота, H3PO4. Кислотные оксиды иначе называются ангидридами соответствующих кислот, например, Р2О5 – фосфорный ангидрид, SО2 – сернистый ангидрид. Степень окисления элемента, образующего кислотный оксид, равна степени окисления этого элемента в соответствующей кислоте. Так, степень окисления серы в SО2 и Н2SО3 равна +4, а степень окисления фосфора в Р2О5 и Н3РО4 равна +5. Амфотерными оксидами называются оксиды, которым соответствуют амфотерные гидроксиды, и которые проявляют свойства как кислотных , так и основных оксидов . Так, оксид цинка ZnO - амфотерный оксид, ему соответствует амфотерный гидроксид Zn(OH)2, оксид хрома (III) - Cr(OH)3 - тоже амфотерен, ему соответствует амфотерный гидроксид Cr(OH)3 2.1.2. Номенклатура оксидов По международной номенклатуре в названии оксидов указывается названиеэлемента, образующего оксид с добавлением слова оксид и указанием степени окисления, если она переменная (если степень окисления постоянная, то её не указывают). При написании названия степень окисления указывают в скобках римской цифрой. Например: ZnO – оксид цинка, SO2 – оксид серы (IV), SO3 – оксид серы (VI). Неорганические соединения (оксиды, кислоты, основания и соли) вступают в многочисленные реакции между собой, которые можно проследить на примере методов получения этих соединений. 2.1.3 Методы получения оксидов1. Непосредственное взаимодействие элемента с кислородом S+O2=SO2 2Ca+O2=2CaO 2. Окисление кислородом сложных веществ 2ZnS+3O2=2ZnO+2SO2 3. Разложение кислот, оснований и солей H2SiO3  H2O+SiO2 H2O+SiO22Al(OH)3  3H2O+Al2O3 3H2O+Al2O3CaCO3  CaO+CO2 CaO+CO22.1.4. Свойства оксидов Взаимодействие с водой. Оксиды щелочных, щелочно-земельных металлов и большинство оксидов неметаллов взаимодействуют с водой: Na2O + H2O = 2NaOH BaO + H2O = Ba(OH)2 N2O5 + H2O = 2HNO3 SO2 +H2O = H2SO3 Основные оксиды взаимодействуют с кислотами, при этом образуются соль и вода: Na2O + 2HNO3 = 2NaNO3 + H2O BaO + H2SO3 = BaSO3↓ + H2O Кислотные оксиды взаимодействуют с растворимыми основаниями, при этом образуются соль и вода: SO2 + 2NaOH = Na2SO3 + H2O СО2 + Ва(ОН)2 = ВаСО3↓ + Н2О Кислотные и основные оксиды взаимодействуют между собой с образованием солей: Na2O + N2O5 = 2NaNO3 Амфотерные оксиды обладают свойствами и кислотных и основных оксидов. Они взаимодействуют и с кислотами. и со щелочами, и с кислотными , и с основными оксидами. ZnO + 2HCl = ZnCl2 + H2O ZnO + SO3 = ZnSO4 сплавление сплавление ZnO + 2NaOH = Na2ZnO2 + H2O ZnO + K2O = K2ZnO2 Кислоты . 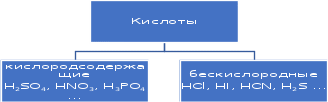 Определение кислот с точки зрения теории электролитической диссоциации было дано С. Аррениусом: Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода. Образовавшийся при диссоциации кислоты анион называется кислотным остатком. Так, при диссоциации азотной кислоты (HNO3) образуются ион водорода Н+ и анион NO3- (нитрат-ион) HNO3 Н++ NO3-. С точки зрения состава, кислотами называются вещества, состоящие из атомов водорода, способных замещаться на металлы и кислотных остатков. H2SO4 + Zn = ZnSO4 + Н2↑ 2.2.1. Классификация кислот Кислоты делятся на кислородосодержащие и бескислородные. Например, серная (H2SO4) и азотная (HNO3) кислоты – кислородосодержащие, а соляная (HCl) и сероводородная (H2S) – бескислородные. 2.2.2. Номенклатура кислот Обычно названия кислородсодержащих кислот производится от названия неметалла с прибавлением окончаний – ная, - вая, если степень окисления неметалла равна номеру группы. По мере понижения степени окисления суффиксы меняются в следующем порядке: - оватая, - истая, - оватистая: HClO4 – хлорная кислота HNO3 – азотная кислота HClO3 - хлорноватая кислота HNO2 – азотистая кислота HClO2 – хлористая кислота H2SO4 – серная кислота HClO - хлорноватистая кислота H2SO3 – сернистая кислота В таблице приведены формулы и названия некоторых кислот и их кислотных остатков. Таблица Формулы и названия кислот и кислотных остатков
2.2.3. Получение кислот Бескислородные кислоты могут быть получены при непосредственном взаимодействии неметаллов с водородом с последующим растворением в воде: hν H2+ Cl2 = 2HCl H2 + S = H2S Большинство кислородсодержащих кислот можно получить растворением кислотных оксидов в воде: t0 Р2О5 + 3Н2О = 2Н3РО4 SO3 + H2O = H2SO4 Как бескислородные, так и кислородсодержащие кислоты могут быть получены по реакциям обмена между солями и кислотами либо за счет получения нерастворимых солей, либо за счет вытеснения слабой кислоты сильной: BaBr2 + H2SO4 = BaSO4↓+ 2HBr FeS + 2HCl = FeCl2 + H2S↑ 2.2.4. Химические свойства кислот Химические свойства кислот можно разделить на две группы: общие для всех кислот реакции, связанные с наличием в их растворах иона Н+ и специфические, т.е. характерные для конкретных кислот. К первому типу свойств относится: взаимодействие кислот с металлами, стоящими в ряду напряжений до водорода, например: Zn + 2HCl = ZnCl2 + H2↑ Ряд напряжений (сокращенный)Zi K Ca Na Mg Al Zn Fe Pb H Cu Ag Au Кислоты различают по основности. Основность кислот определяется числом атомов водорода, способных замещаться на металл: HCl – одноосновная кислота, H2SO4 – двухосновная кислота, Н3РО4 – трехосновная кислота. Взаимодействие кислот с основаниями – реакция нейтрализации: 2NaOH + H2SO4 = Na2SO4 + 2Н2О Взаимодействие кислот с основными оксидами: СаО + 2HCl = СаCl2 + Н2О Взаимодействие кислот с солями: NaCN + HCl = HCN + NaCl 2.3. Основания 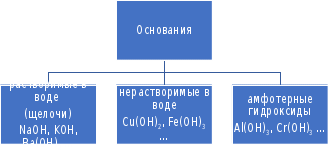 С точки зрения теории электролитической диссоциации: основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы (ОН-). С точки зрения состава вещества: основаниями называются соединения , состоящие из атомов металла и одной или нескольких гидроксильных групп. Основания имеют формулу Me(OH)n, где Ме - ион металла; ОН- - гидроксильная группа; n - количество гидроксильных групп, численно равное заряду иона металла (n+), например, K+OH,Ca2+(OH)2. 2.3.1. Классификация оснований. Основания делят на две группы: растворимые в воде – щелочи ( образованные щелочными и щелочноземельными металлами) и нерастворимые в воде. В группу нерастворимых оснований входят и амфотерные гидроксиды, имеющие свойства и оснований и кислот. Число гидроксильных групп в формуле основания определяет его кислотность. Например, NH4OH - однокислотное основание, Cu(OH)2 - двухкислотное. 2.3.2. Номенклатура оснований По международной номенклатуре названия гидроксидов образуются из слова гидроксид и названия металла: NaOH - гидроксид натрия, Ba(OH)2 - гидроксид бария. Если металл имеет переменную степень окисления, то в скобках указывается римской цифрой степень окисления металла в данном основании: Fe(OH)2 - гидроксид железа (П), Fe(OH)3 - гидроксид железа (Ш). Некоторые гидроксиды имеют специфические названия, например, гидроксид калия - едкое кали, гидроксид натрия - едкий натр, гидроксид кальция - гашеная известь. 2.3.3. Получение оснований 1. Растворимые основания – щелочи получают: а) взаимодействием щелочных и щелочноземельных металлов с водой: 2Na + 2H2O = 2NaOH + H2↑ ; б) ) взаимодействием оксидов щелочных и щелочноземельных металлов с водой: SrO + H2O = Sr(OH)2 Нерастворимые основания получают взаимодействием растворимых солей металлов со щелочами: CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4 FeCl3 + 3KOH = Fe(OH)3↓ + 3KCl Химические свойства оснований Все нерастворимые основания при нагревании разлагаются с образованием оксидов: t0 Cu(OH)2 = CuО + Н2О t0 2Al(OH)3 = Al2O3 + 3H2O Все основания взаимодействуют с кислотами – реакция нейтрализации: KOH + HNO3 = KNO3 + H2O Cd(OH)2 + H2SO4 = CdSO4 + 2H2O Щелочи взаимодействуют с кислотными оксидами: Са(ОН)2 + СО2 + СаСО3↓ + Н2О Щелочи взаимодействуют с солями: 2NaOH + Pb(NO3)2 = Pb(OH)2↓ + 2NaNO3 Химические свойства амфотерных гидроксидов Амфотерные гидроксиды обладают свойствами и кислот и оснований. Они взаимодействуют и с кислотными оксидами и с основными; и с растворами кислот и растворами щелочей. При взаимодействии с растворами щелочей образуются гидроксокомплексы: Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]. Соли 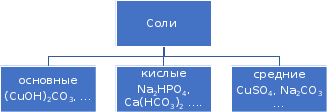 С точки зрения теории электролитической диссоциации: Солями называются электролиты, при диссоциации которых образуются катионы металлов и анионы кислотных остатков. С точки зрения состава вещества: солями называются соединения состоящие из атомов металла и кислотного остатка. Например: NaNO3, AlCl3, CuSO4. 2.4.1. Классификация солей Соли делят на три группы: средние, кислые и основные. Средние соли – это продукты полного замещении атомов водорода в кислоте на атомы металла или полного замещения гидроксильных групп основания на кислотные остатки. Например: Al2(SO4)3, Na2CO3, Pb(CH3COO)2. Кислые соли – это продукты неполного замещении атомов водорода в многоосновных кислотах на атомы металла. Например: NaHSO4, Са(НРО4), Са(Н2РО4)2. Основные соли - это продукты неполного замещении гидроксильных групп в многокислотных основаниях на кислотные остатки. Например: (CuOH)2CO3, AlOHCl2, [Al(OH)2]Cl. 2.4.2. Номенклатура солей Названия средних солей складываются из названия кислотного остатка и названия металла. При этом, если металл имеет переменную степень окисления, то она указывается римской цифрой. Например, K2SO4 – сульфат калия, Al(NO3)3 – нитрат алюминия, CuCO3 – карбонат меди (II). При наименовании средних солей кислородсодержащих кислот к латинскому корню названия элемента, образующего кислотный остаток, добавляется окончание - ат, для высших степеней окисления, +5 +3 - ит для низших степеней окисления: NaNO3 - нитрат натрия, NaNO2 - нитрит натрия. Если элемент образует несколько кислот с различными степенями окисления используют приставки +1 гипо - , для низших степеней окисления и пер- для высших степеней окисления. Например: KClO – +3 +5 +7 гипохлорит калия, KClO2 - хлорит калия, KClO3 – хлорат калия, KClO4 – перхлорат калия. Если один элемент образует несколько кислот с различным содержанием числа атомов неметалла, то указывают их число: K2CrO4 – хромат калия, K2Cr2O7 – дихромат калия. При неполном замещении водорода в кислоте на металл образуются кислые соли. В этом случае кислотный остаток содержит один или два иона водорода, и соли называются в соответствии с названиями анионов, например, K2HPO4 – гидрофосфат калия, KH2PO4 – дигидрофосфат калия. Кислые соли образуют только многоосновные кислоты. Основные соли являются продуктом неполного замещения гидроксид-ионов в основании на анионы кислотного остатка. В основных солях катион состоит из иона металла и одного или двух гидроксид-ионов. Если в состав катиона входит один гидроксид-ион, то к названию металла добавляется приставка гидроксо- , а если два, - то дигидроксо-, например CuOHCl – хлорид гидроксомеди (II), Al(OH)2NO3 – нитрат дигидроксоалюминия. Основные соли образуют только многокислотные основания. Помимо средних, кислых и основных солей, существуют также двойные, смешанные и комплексные соли, которые в данной работе не рассматриваются. 2.4.3. Методы получения солей 1. Реакция нейтрализации: Са(ОН)2 + 2HCl = CaCl2 + H2О Взаимодействие металла с неметаллом 2Fe + 3Cl2 = 2FeCl3 Взаимодействие металла с кислотой Со + 2HCl = CоCl2 + H2О 4. Взаимодействие металла с солью. Реакция протекает в том случае, если реагирующий металл стоит в ряду напряжений левее металла, входящего в состав соли Fe+CuSO4=FeSO4+Cu 5. Взаимодействие основного оксида с кислотным CaO+SO3=CaSO4 6. Взаимодействие основного оксида с кислотой CuO+2HCl=CuCl2+H2O 7. Взаимодействие кислотного оксида с основанием CO2+2NaOH=Na2CO3+H2O 8. Взаимодействие соли с кислотой Na2CO3+2HCl = 2NaCl+H2CO3 9. Взаимодействие соли со щелочью CrCl3+3NaOH=Cr(OH)3+3NaCl 10. Взаимодействие между собой двух солей в растворе. Эта реакция происходит реально в том случае, если одна из образующих солей выпадает в осадок AgNO3+NaCl=AgCl+NaNO3 11. Чтобы превратить среднюю соль в кислую, надо добавить соответствующей кислоты CaCO3+H2CO = Ca(HCO3)2 ¥ Вновь превратить кислую соль в среднюю можно действием соответствующего основания Ca(HCO3)2+Ca(OH)2=2CaCO3 + 2H2O 12. Основные соли полусаются при осторожном добавлении небольших количеств щелочи к растворам средних солей: AlCl3 + 2NaOH = Al(OH)2Cl + 2NaCl _______________________ Многие реакции между веществами происходят в водных растворах. Содержание вещества в растворе можно определить, зная его концентрацию. Одним из наиболее употребительных способов выражения концентрации является массовая доля растворенного вещества в растворе или, упрощенно, массовая доля. Массовой долей растворенного вещества в растворе называется отношение массы растворенного вещества к массе раствора. (I) Массовая доля обозначается буквой и выражается в долях единицы или в процентах (по массе). Правомерным является и другое определение массовой доли. Массовая доля растворенного вещества в растворе показывает, какая масса растворенного вещества содержится в 100 массовых единицах раствора. (II) Пусть, например, имеется раствор соляной кислоты с массовой долей HCl 5%; иначе можно записать: 5%-ный (по массе) раствор соляной кислоты. Это означает, что: а) отношение массы соляной кислоты и массы ее раствора равно 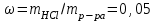 ; б) масса соляной кислоты составляет 5% от массы ее раствора; в) в 100 г (мг, кг, т) раствора содержится 5 г (мг, кг, т) собственно соляной кислоты. ; б) масса соляной кислоты составляет 5% от массы ее раствора; в) в 100 г (мг, кг, т) раствора содержится 5 г (мг, кг, т) собственно соляной кислоты. 1 2 |
