Понятия и законы химии. Основные классы веществ. Лекция 1 Тема Основные законы и понятия химии. Основные классы веществ. Основные понятия
 Скачать 185.28 Kb. Скачать 185.28 Kb.
|
1 2 ПРИМЕРЫ ТИПОВЫХ ЗАДАЧ И ИХ РЕШЕНИЕ.Задача 1. Определить степени окисления атомов всех элементов в соединениях: Cr2O3, K2Cr2O7, Ca3(PO4)2, NH4NO3. При определении степеней окисления атомов следует руководствоваться следующими правилами: алгебраическая сумма степеней окисления всех атомов в молекуле вещества равна нулю, а в ионе – заряду иона; степень окисления водорода во всех соединения, кроме соединений металлов с водородом, равна +1; степень окисления кислорода во всех соединения, кроме пероксидов, равна -2; элементы 1, 2, 3 групп имеют постоянную степень окисления равную номеру группы. Решение. Молекула Cr2O3 состоит из 3 атомов кислорода (степень окисления равна –2) и 2 атомов хрома (степень окисления неизвестна, х). Составляем уравнение: 2х+3(-2)=0, отсюда х=+3, получаем 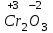 . .В молекуле K2Cr2O7 известны степени окисления калия (+1) и кислорода (-2). Составляем уравнение: 2(+1)+2х+7(-2)=0, получаем х=+6, 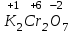 . .В соединении Ca3(PO4)2 неизвестна только степень окисления фосфора. Однако в данном случае составлять уравнение, подобное предыдущему, не стоит. Ca3(PO4)2 – фосфат кальция, соль фосфорной кислоты, H3PO4, а в кислотах и их солях степень окисления основного элемента (в данном случае фосфора) одинакова. Поэтому для определения степени окисления фосфора составим более простое уравнение для кислоты, от которой образована соль (Н3РО4): 3(+1)+х+4(-2)=0, отсюда х=+5, получаем 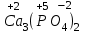 . .В молекуле NH4NO3 (нитрата аммония, соли азотной кислоты) неизвестна степень окисления двух разных атомов азота, х и у ( 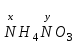 ). Степень окисления азота “у” определяем так же, как в предыдущем примере, т.е. по формуле азотной кислоты, HNO3: 1(+1)+у+3(-2)=0; у=5. ). Степень окисления азота “у” определяем так же, как в предыдущем примере, т.е. по формуле азотной кислоты, HNO3: 1(+1)+у+3(-2)=0; у=5.Степень окисления азота «х» определяем, зная, что ион аммония (NH4+) имеет заряд 1+: х+4(+1)=+1, отсюда х=-3. Получаем 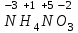 . .Задача 2. Чему равен объем (н.у) сероводорода массой 8,5 г? Сколько молей и молекул H2S содержится в этой массе? Известно, что 1 моль любого вещества имеет массу, называемую молярной массой, и содержит число Авогадро (NА=6,02·1023) молекул. Известно также, что если вещество является газом или паром, то при нормальных условиях (н.у.) объем его 1 моль равен 22,4 л. Решение. М(H2S) = 34 г/моль; Vм (HzS) = 22,4 л/моль (н.у.); NA = =6,02·1023 молекул H2S. Введем обозначения: 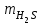 - массаH2S, - массаH2S, 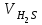 - объем H2S, - объем H2S, 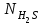 - число молекул H2S, - число молекул H2S, 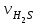 - количество вещества (число молей) H2S. - количество вещества (число молей) H2S.Задачу можно решить двумя способами. 1-й способ. Сначала определим количество вещества: 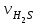 = = 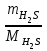 = =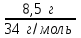 = 0,25 моль. = 0,25 моль.По количеству вещества определим остальные параметры: 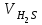 = 0,25 моль 22,4л/моль = 5,6 л = 0,25 моль 22,4л/моль = 5,6 л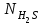 = = 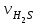 NA= 0,25 моль 6,02 1023 мол-л/моль = NA= 0,25 моль 6,02 1023 мол-л/моль == 1,50 1023 молекул. 2-й способ. Количество вещества определим так же, как и в 1-м способе: 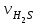 = = 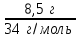 =0,25 моль. =0,25 моль.Что же касается определения объема газа и числа молекул, то эти величины можно рассчитать непосредственно из соотношения, из которого следует, что в 34 г H2S содержится 6,02 1023 молекул H2S, а объем (н.у.) H2S массой 34 г составляет 22,4 л. Составим две пропорции: 34 г H2S – 6,02 1023 молекул H2S 8,5 г H2S – х молекул H2S, отсюда x=1,5 1023 молекул 34 г H2S – 22,4 л H2S 8,5 г H2S – у л H2S, отсюда у=5,6 л В данной задаче 1-й способ является более удобным и легким, но если бы, например, в задаче требовалось определить только объем H2S (н.у.) массой 8,5 г, то более рационально было бы воспользоваться пропорцией 34 г H2S – 22,4 H2S 8,5 г H2S – у л H2S. у=5,6 л и определить искомую величину в одно действие. Задача 3. Определить, сколько атомов кислорода содержится в 4,9 г серной кислоты. Решение подобных задач основывается на законе постоянства состава. Напишем формулу серной кислоты, H2SO4. В одной молекуле H2SO4 содержится два атома водорода, 1 атом серы и 4 атома кислорода. Если возьмем 1 моль H2SO4, т.е. 6,02 1023 молекул серной кислоты, то в нем будет содержаться: 2 6,02 1023 атомов водорода (т.е. 2 моль атомов Н), 1 6,02 1023 атомов серы (т.е. 1 моль атомов S), 4 6,02 1023 атомов кислорода (т.е. 4 моль атомов О). Отсюда получаем, что в 1 моль любого вещества содержится столько же моль атомов каждого элемента, сколько атомов этих элементов входит в состав молекулы соединения. При этом соотношение между числом моль атомов в 1 моль вещества будет одинаковым для любого количества этого вещества. Так в данном примере это соотношение будет следующим: 1 моль H2SO4 –2 моль атомов Н: 1 моль атомов S: 4 моль атомов О. Решение. 1-й способ. Определим, какое количество () H2SO4 содержится в 4,9 г H2SO4: 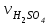 = = 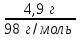 4,9 г моль/98 г =0,05 моль. Составим пропорцию 4,9 г моль/98 г =0,05 моль. Составим пропорцию1 моль H2SO4 - 4 моль ат. О 0,05 моль H2SO4 – х моль ат. О, отсюда х = 0,2 моль-атомов О. Зная, что 1 моль любых частиц (молекул, атомов, ионов и др.) содержит число Авогадро (NA) этих частиц, определим, сколько атомов кислорода (NО) содержится в 0,2 моль- атомов О: NО= 0,2 моль· 6,02·1023 атомов/моль = 1,204 ·1023 атомов О. Таким образом, в 4,9 г H2SO4 содержится 1,204· 1023 атомов кислорода. 2-й способ. Из формулы серной кислоты следует, что 1 моль H2SO4 имеет массу 98 г. Составим пропорцию 98 г H2SO4 – 4 моль ат. О 4,9 г H2SO4 – х моль ат. О, отсюда х = 0,2 моль- атомов О. Тогда число атомов кислорода (NО) , будет равно N0 = 0,2 моль 6,02 1023 атомов/моль= 1,204 · 1023 ат. О. 3-й способ. В 1 моль серной кислоты содержится 4 моль атомов кислорода, моль серной кислоты имеет массу 98 г, а 4 моль атомов кислорода содержат 4 · 6,02 · 1023 атомов кислорода. Составляем пропорцию 98 г H2SO4 – 4 · 6,02 · 1023 ат. О 4,9 г H2SO4 – х ат. О, отсюда х = 1,204 · 1023 атомов О. Из выше изложенного следует, что третий способ является наиболее легким и рациональным. Задача 4. Какой объем аммиака (при н.у.) будет содержать 6 моль атомов азота? Согласно формуле аммиака (NH3 ) в 1 молекуле его содержится 1 атома азота, следовательно, 1 моль NH3 содержит 1 моль- атомов азота. С другой стороны, 1 моль аммиака, как и всякого газа, при нормальных условиях (н.у.) занимает объем 22,4 л. Решение. 1-й способ. Составим пропорцию: 1 моль NH3 – 1 моль ат. N х моль NH3 – 6 моль ат. N, отсюда х = 6 моль NH3 и объем аммиака ( 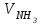 ) при н.у. будет равен ) при н.у. будет равен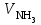 =6 моль · 22,4 л/моль = 134,4 л. =6 моль · 22,4 л/моль = 134,4 л.2-й способ. Используя соотношение 22,2 л – 1 моль NH3 – 1 моль ат. N, составим пропорцию 22,4 л – 1 моль ат. N х – 6 моль ат. N, отсюда х = 134,4 л NH3. Задача 5. В каком объеме сернистого газа (н.у.) содержится столько же молекул, сколько атомов натрия содержится в 7,1 г Na2SO4 ? При решении подобных задач следует понимать, что в данном случае не требуется определять ни число атомов, ни число молекул. Из определения числа Авогадро следует, что какие бы частицы мы ни брали (молекулы, атомы, ионы, электроны и др.) число этих частиц будет одинаковым тогда, когда будут равны их количества. Поэтому фактически в таких задачах поставлен вопрос о сравнении числа молей (количества) различных частиц. Решение. Определим количество вещества 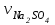 в 7,1 г Na2SO4. в 7,1 г Na2SO4. 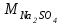 =142 г/моль, =142 г/моль, отсюда 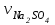 = 7,1 г :142 г/моль = 0,05 моль атомов. = 7,1 г :142 г/моль = 0,05 моль атомов.В 1 моль Na2SO4 содержится 2 моль атомов Na. Определим, сколько моль атомов Na содержится в 0,05 моль Na2SO4: 1 моль Na2SO4 - 2 моль ат. Na 0,05 моль Na2SO4 - х моль ат. Na., отсюда х = 0,1 моль ат.Na. По условию задачи число атомов Na должно быть равно числу молекул SO2 , а это будет в том случае, когда количества атомов Na и молекул SO2 будут одинаковыми. Отсюда следует, что количество сернистого газа равно 0,1 моль. Поскольку 1 моль любого газа при нормальных условиях занимает объем 22,4 л, получаем 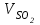 (н.у.) = 22,4 л/моль·0,01 моль = 2,24 л. (н.у.) = 22,4 л/моль·0,01 моль = 2,24 л.Таким образом, в 22,4 л SO2 (н.у.) будет содержаться столько же молекул SO2, сколько атомов Na содержится в 7,1 г Na2SO4 . Задача 6. Определить массовую долю вещества в растворе, если в 40 г раствора содержится 8 г вещества. Решение. 1-й способ. В соответствии с определением (I), с. 18, - массовая доля равна =mв-ва/mр-ра = 8 г /40 г = 0,2; или в процентах = 20%. 2-й способ. На основании определения (II) составляем пропорцию 8 г в-ва - 40 г р-ра х г в-ва - 100 г р-ра, отсюда х = 20 г. Это означает, согласно определению (II) с. 18 , что = 20%. Задача 7. В 45 мл воды растворено 5 г сульфата натрия. Определить массовую долю Na2SO4 в растворе. Решение. Массовая доля Na2SO4 в растворе равна 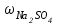 = = 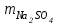 /mр-ра. /mр-ра.Масса сульфата натрия составляет 5 г. Масса раствора складывается из массы растворенного вещества (Na2SO4) и массы растворителя (воды), которая неизвестна. Зная, что плотность воды 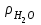 равна 1 г/см3, а объем воды равна 1 г/см3, а объем воды 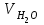 – 45 мл (см3), получаем – 45 мл (см3), получаем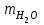 = = 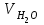 · · 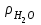 = 45 мл · 1 г/мл = 45 г = 45 мл · 1 г/мл = 45 гТогда масса раствора (m р-ра) будет mр-ра= 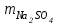 + + 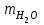 = 5 г + 45 г = 50 г = 5 г + 45 г = 50 ги 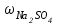 = 5 г/ 50 г =0,1 или 10%. = 5 г/ 50 г =0,1 или 10%.Задача 8. Сколько граммов раствора серной кислоты с массовой долей H2SO4 20% надо взять для полной реакции с 20 мл 10 %-ного (по массе) раствора гидроксида натрия с плотностью раствора = 1,109 г/мл? При решении подобных задач следует четко понимать, что: 1) поскольку вещества вступают в реакцию, то необходимо составить уравнение реакции, по которому и будет производиться основной расчет; 2) в реакции, соответствующей составленному уравнению, участвуют чистые вещества, содержащиеся в растворах, из чего следует, что в расчетах по уравнению необходимо использовать массы растворенных веществ, а не массы растворов. Решение. Составим уравнение реакции 2 NaOH + H2SO4= Na2SO4+2 H2O. Определим массу NaOH, содержащуюся в 20 мл 10%-ного по массе раствора с плотностью =1,109 г/мл. 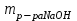 =Vр-ра · р-ра = 20 мл · 1,109 г/мл=22,18 г, =Vр-ра · р-ра = 20 мл · 1,109 г/мл=22,18 г,а в растворе NaOH содержится 10% NaOH, отсюда 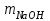 = mр-ра · = 22,18 г · 0,1 = 2,218 г. = mр-ра · = 22,18 г · 0,1 = 2,218 г.По уравнению реакции определим массу серной кислоты, участвующей в реакции, зная, что 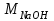 = 40 г/моль, а = 40 г/моль, а 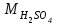 =98 г/моль =98 г/моль и что, согласно уравнению, один моль серной кислоты реагирует с 2 моль гидроксида натрия. Составим пропорцию 98 г H2SO4 - 2 · 40 г NaOH х г H2SO4 - 2,218 г NaOH, отсюда х = 2,7 г. Таким образом, в 20% - ном (по массе) растворе H2SO4 содержится 2,7 г H2SO4. Зная массовую долю серной кислоты в растворе ( H2SO4), определим массу раствора H2SO4 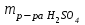 = = 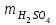 /= 2,7 г/ 0,2 =13,5 г. /= 2,7 г/ 0,2 =13,5 г.Задача 9. Сколько литров углекислого газа (н.у.) образуется при взаимодействии 50 мл 8%-ного (по массе) раствора соляной кислоты ( р-ра HСl= 1,04 г/см3) с избытком раствора карбоната калия? Решая подобные задачи, необходимо помнить, что объем 22,4 л для определения числа молей можно использовать только применительно к объему газа, так как 22,4 л/моль - это объем 1моль газа или пара (при н.у.). Применять же эту величину (22,4 л/моль) к расчетам, непосредственно связанным с объемом растворов, нельзя. Решение. Составим уравнение реакции 2HCl +К2CO3= 2КCl + CO2 +H2O mр-ра HCl= V р-ра HCl · р-ра=50 мл · 1,04 г/мл=52 г mHСl = m р-ра HCl · HСl = 52 г · 0,08 = 4,16 г. Из уравнения реакции следует, что при взаимодействии 2 моль HCl с К2CO3 образуется 1 моль СО2 (н.у.) . Учитывая, что МHСl =36,5 г/моль, а 1 моль СО2 (н.у.) занимает объем 22,4 л, составим пропорцию 2 · 36,5 г HCl – 22,4 л СО2 4,16 г HCl – х л СО2, отсюда х=1,26 л, т.е. 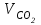 (н.у.) = 1,26 л. (н.у.) = 1,26 л.1 2 |
