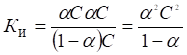|
|
заттар құрылысы мен құрамы. лекция посл. Лекция 1 Введение. Предмет аналитической химии
Лекция № 5. Кислотно-основная система качественного анализа.
Под качественным химическим анализом вещества понимают определение его качественного состава, т.е. открытие (идентификацию) атомов, атомных групп, ионов и молекул в анализируемом веществе.
Существует два метода качественного анализа: дробный и систематический. Дробный качественный анализ предполагает обнаружение иона или вещества в анализируемой пробе с помощью специфического реагента в присутствие всех компонентов пробы. Примером такой реакции может служить обнаружение ионов аммония при подщелачивании раствора:
NH4+ + ОН– = NH3↑ + Н2O
Однако специфических реагентов известно немного. Более распространенны групповые реагенты, дающие сходные реакции с целой группой ионов.
В основу той или иной аналитической классификации катионов по группам положены их сходства или различия по отношению к действию определенных аналитических реагентов и свойства образующихся продуктов аналитических реакций (растворимость в воде, кислотах и щелочах, способность к комплексообразованию, окислительно-восстановительные свойства).
Существует ряд классификаций катионов по группам (или химических методов качественного анализа катионов). Наиболее распространенными среди них являются три классификации: сероводородная, аммиачно-фосфатная и кислотно-основная, причем сероводородный метод анализа в настоящее время практически не используется, т.к. требует применения токсичного сероводорода и довольно продолжителен.
Применение групповых реагентов позволяет подразделить многие катионы по аналитическим группам, однако не существует классификации, охватывающей все известные катионы или, по крайней мере, катионы всех металлов.
В таблицах 1.1, 1.2 и 1.3 представлены катионы в соответствии с сероводородной, аммиачно-фосфатной и кислотно-основной классификациями. В этих таблицах перечислены не все катионы, входящие в группу, а только те из них, которые наиболее часто встречаются в фармацевтическом анализе.
Нужно отметить, что в водных растворах «голые» индивидуальные катионы металлов не существуют, поскольку они термодинамически неустойчивы и образуют комплексы различного состава. Поэтому используемая в дальнейшем форма написания катионов Mg2+, Bi3+ и т.д. означает лишь, что речь идет о соединениях элементов в соответствующих степенях окисления, а не о действительном существовании таких ионов.
Кислотно-основная классификация катионов.
Данная классификация катионов основана на использовании и качестве групповых реагентов водных растворов кислот и оснований – HCl, H2SO4, NaOH или KOH, NH3*H2O.
Катионы, открываемые в рамках кислотно-основной классификации, подразделяют на шесть аналитических групп (табл. 1.3).
К первой аналитической группе относят катионы Li+, Na+, К+, NH4+. Групповой реагент отсутствует.
Вторая аналитическая группа представлена катионами Ag+, Hg22+, Pb2+. Групповой реагент – раствор НСl (обычно с концентрацией 2 моль/л). Групповой реагент осаждает из водных растворов катионы второй аналитической группы в виде осадков малорастворимых в воде AgCl, Hg2Cl2, РbСl2. Их произведения растворимости при комнатной температуре равны соответственно 1,8*10-10, 1,3*10-18, 1,6*10-5. При действии группового реагента катионы Рb2+ осаждаются не полностью – частично они остаются в растворе.
К третьей аналитической группе относят катионы Са2+, Sr2+, Ba2+ (Рb2+ иногда). Групповой реагент – раствор H2SO4. Катионы осаждаются в виде малорастворимых CaSO4 (ПР = 2,5*10-5), SrSO4 (ПР = 3,2*10-7), BaSO4 (ПР = 1,1*10-10), PbSO4, (ПР = 1,6*10-8). При действии группового реагента ионы Са2+ осаждаются не полностью. Для более полнго осаждения ионов кальция в форме CaSО4 к раствору прибавляют этанол, в присутствие которого растворимость сульфата кальция уменьшается. Осадки CaSО4, SrSО4, BaSО4 практически нерастворимы в разбавленных кислотах и щелочах. Сульфат кальция растворим в водном растворе (NH4)2SО4 с образованием комплекса (NH4)2[Ca(SО4)2].
Четвертая аналитическая группа включает катионы Аl3+, Cr3+, Zn2+, As3+, As5+, Sn2+, Sn4+ . Иногда сюда же относят катионы Sb3+. Групповой реагент – водный раствор NaOH (или КОН) в присутствии Н2О2 (обычно избыток 2 моль/л раствора NaOH в присутствии Н2О2(%)), иногда – без Н2О2. При действии группового реагента катионы IV аналитической группы осаждаются из водного раствора в виде амфотерных гидроксидов, растворимых в избытке группового реагента с образованием гидроксомплексов
Контрольные вопросы
.Достоинства и недостатки системы.
2.Дробный и систематический методы анализа.
3.Значение метода системного анализа.
4.Сущность и значение дробного анализа.
Лекция № 6. Задачи и объекты химического анализа.
Химические аналитические реакции (групповые, общие, частные). Аналитическая форма, аналитические признаки. Аналитические классификации катионов и анионов. Аналитические эффекты и условия выполнения аналитических реакций
Химические реакции, при проведении которых возникает аналитический эффект, называют аналитическими, а реактивы, применяемые для проведения аналитических реакций, называют аналитическими реагентами.
Аналитические реакции должны быть в достаточной степени, избирательными (специфичными) – проходить только с обнаруживаемым веществом и приводить к образованию достаточно характерных продуктов. Чувствительность реакции характеризуется наименьшим количеством вещества, которое может быть обнаружено или количественно определено данным методом. Она может выражаться двумя величинами: открываемым (определяемым) минимумом и минимальной (предельной) концентрацией (предельным разбавлением).
Определяемым минимумом называется наименьшее количество вещества или иона, которое может быть обнаружено (определено) данным методом в данных условиях. Открываемый минимум очень мал (1 ·10-6 г). Чем меньше он, тем выше чувствительность метода.
Минимальная (предельная) концентрация – это наименьшая концентрация раствора, при которой данная реакция позволяет еще однозначно открывать (обнаруживать) определяемой вещество. Обычно выражается в г/мл или г/л раствора. Связь между этими величинами выражается формулой:
m = Cmin · V ·106
где: m – открываемый минимум, г
Сmin – минимальная (предельная) концентрация, мкг/мл;
V – Объем раствора, мл
Химические реактивы должны отвечать ряду требований, это- чистота, чувствительность и специфичность. Химические реактивы классифицируются по степени чистоты на технические (т), чистые (ч) - до 2% примесей, чистые для анализа (ч.д.а.) – до 1% примесей, химически чистые (х.ч.) – менее 1% примесей, высоко-эталонно-чистые (в.э.ч.) и особо чистые (ос.ч.). По области применения реактивы разделяются на индикаторы, красители для микроскопии, для хроматографии, для фотографии, фармакопейные, для криоскопии, для люминофоров, и специальные.
Химические реагенты, используемые в аналитических реакциях делятся на специфические, избирательные (или селективные) и групповые.
Специфичный реагент образует характерный осадок и окрашивание или выделение газа только с определенным ионом.
Избирательный реагент реагирует с несколькими ионами, которые могут принадлежать к разным группам.
Групповой реагент вступает в реакцию во всеми ионами данной группы. С помощью этого реагента ионы данной группы можно отделить от ионов других групп.
Химический качественный анализ проводят в основном двумя способами: «сухим путем» - анализируют вещество, не растворяя его, и «мокрым путем» - сначала исследуемое вещество растворяют, а затем определяют его состав. Для анализа сухим путем пользуются следующими методами:
Испытывают образец на окрашивание пламени;
Получают окрашенные стекла;
Реакции растирания.
Анализируя вещество мокрым путем, предварительно растворяют его в воде, кислоте или растворе щелочи.
Для анализа мокрым путем использую реакции, которые проводят:
1. Пробирочным;
2. Капельным;
3. Микрокристаллоскопическим методом.
Применяя специфические реакции, можно обнаруживать соответствующие ионы так называемым дробным методом, т.е. непосредственно в отдельных порциях исследуемого раствора. Когда достаточно специфические реакции отсутствуют, обнаружение ионов дробным методом невозможно. Для этого разработана определенная последовательность реакций обнаружения отдельных ионов, представляющую систематический ход анализ. Он состоит в том, что к обнаружению важного данного иона приступают лишь после того, как все другине ионы мешающие его обнаружению, будут предварительно обнаружены и удалены из раствора.
В аналитической практике качественного анализа в мокром методе катионы и анионы делят на аналитические группы.
Аналитическая классификация катионов может быть различной, так как их разделение зависит от метода систематического анализа, которые подразделяют в зависимости от применяемых групповых реагентов на:
- карбонатный метод;
- кислотно-основной метод;
- сероводородный метод;
- сульфидно-основной метод;
- фосфатно-аммиачный метод;
- бифталатный метод;
- тиоацетамидный метод и другие.
Наиболее распространенными являются кислотно-основной, сероводородный и аммиачно-фосфатный методы систематического анализа.
Кислотно-основной метод анализа катионов основан на различной растворимости хлоридов и сульфатов в водных растворах и на различной растворимости гидроксидов в воде, избытке щелочи и водном растворе аммиака. Групповыми реагентами являются HCI, H2SO4, NaOH, NH4OH. В этом методе катионы делят на шесть групп (см.табл.1).
Таблица 1 -Классификация катионов на аналитические группы
по кислотно-основному методу
Группа
|
Катионы
|
Групповой реагент
|
Краткая характеристика осадка
(название группы)
|
I
|
K+, Na+,
NH4+
|
-
|
-
|
II
|
Ag+, [Hg2]2+,
Pb2+
|
HCI
|
Хлориды нерастворимы в воде
и разбавленных растворах кислот
(хлоридная)
|
III
|
Ba2+, Sr2+,
Ca2+
|
H2SO4
|
Сульфаты нерастворимы в воде
и разбавленных растворах кислот
(сульфатная)
|
IY
|
AI3+ As3+
As5+, Cr3+,
Sn2+, Sn4+
Zn2+
|
NaOH (избыток)
+3% H2O2
|
Гидроксиды растворимы в избытке
Щелочи или в присутствии
окислителя
(амфотерная)
|
Y
|
Mg2+,Mn2+,
Fe2+, Fe3+,
Bi3+, Sb3+,
Sb5+
|
NH4OH (конц.)
|
Гидроксиды нерастворимы в избытке
щелочи и аммиаке
(гидроксидная)
|
YI
|
Cu2+, Ni2+,
Co2+, Cd2+,
Hg2+
|
NH4OH (избыток)
|
Гидроксиды нерастворимы в избытке щелочи, но растворимы в избытке амми-
ака
(аммиакатная)
|
Методика качественного анализ анионов отличается от методики анализ катионов. В основе деления анионов на аналитические группы, лежит различная растворимость бариевых и серебряных солей и общепринятого систематического хода анализа анионов не существует.
Наиболее распространенное деление анионов на три группы является следующее:
Таблица 2 - Классификация анионов
Группа
|
Характеристика
группы
|
Анионы
|
Групповой реагент
|
I
|
Соли бария мало-
растворимы
В воде
|
SO42- (сульфат-ион)
SO32- (сульфит-ион)
S2O32-(тиосульфат-ион)
CO32-(карбонат-ион)
PO43-(фосфат-ион)
AsO43- (арсенат-ион)
AsO33- (арсенит-ион)
BO2- (борат-ион)
B4O72- (тетраборат-ион)
CrO42- (хромат-ион)
Cr2O72- (бихромат-ион)
SiO32- (силикат-ион)
C2O42- (оксалат-ион)
|
BaCI2 в нетральном или слабощелочном растворе
|
II
|
Соли серебра мало-
растворимы в воде
и разбавленной азот-
ной кислоте
|
CI- (хлорид-ион)
Br- (бромид-ион)
I- (иодид-ион)
S2- (сульфид-ион)
SCN- (роданид-ион)
CN- (цианид-ион)
и др..
|
AgNO3 в присутствии 2н
HNO3
|
III
|
Соли бария и серебра
растворимы в воде
|
NO3- (нитрат-ион)
NO2- (нитрит-ион)
CH3COOH- (ацетат-ион)
MnO4- (перманганат-ион)
|
Группового
реагента нет
|
Контрольне вопросы
1. Что является задачей аналитической химии?
2 Какие требования предъявляются к аналитическим реакциям?
3. Что такое дробный и систематический анализы?
4. На сколько групп делятся катионы по кислотно-основной классификации?
5. Что лежит в основе деление катионов на группы?
6. Что такое анализ мокрым путем?
7. Какие реакции относятся к сухим?
8. Как делятся реагенты, применяемые в аналитических реакциях?
Лекция № 7. Константа и степень ионизации слабых электролитов.
Изучение разбавленных растворов показало, что все их общие свойства (понижение давления пара, изменение температур замерзания и кипения, величина осмотического давления) изменяются пропорционально числу частиц растворенного вещества. Эта формулировка представляет собой обобщенный закон разбавленных растворов Рауля-Вант-Гоффа. Эта общая закономерность оказалась справедливой для растворов органических веществ в воде и для растворов в органических растворителях. При исследовании водных растворов солей, кислот, оснований было обнаружено, что изменение соответствующего свойства в зависимости от состава раствора значительно превышает ожидаемую величину. Например, понижение температуры замерзания моляльного раствора NaCl превышает почти в два раза криоскопическую постоянную для воды (3,36° вместо 1,86°). Это свидетельствует о том, что число частиц в водных растворах кислот, оснований и солей не соответствует молярной концентрации раствора.
Кроме того, растворы, для которых характерны отклонения от законов разбавленных растворов, обладают значительной электропроводностью в отличие от водных растворов некоторых органических веществ. Это можно было объяснить наличием в растворе заряженных частиц. Растворы, проводящие электрический ток, были названы электролитами.
Свойства электролитов были рассмотрены и обобщены основоположником теории электролитической ионизации Аррениусом (1887) и развиты в трудах В.А. Кистяковского, И.А. Каблукова на основе химической (гидратной) теории растворения Д.И. Менделеева. Основные положения теории электролитической диссоциации:
1) при растворении солей, кислот и оснований в воде происходит диссоциация этих веществ с образованием электрически заряженных частиц - катионов и анионов;
2) электропроводность таких растворов прямо пропорциональна общей концентрации ионов в растворе.
В работах И. А. Каблукова и В. А. Кистяковского отмечалось, что электролитическая ионизация вызывается взаимодействием полярных молекул растворителя с частицами растворяемого вещества (молекулами газов, атом-ионами при растворении кристаллов). Это взаимодействие приводит к поляризации даже преимущественно ковалентных связей, как, например, в хлористом водороде. При растворении этого газа в воде происходит образование ионов водорода и хлора за счет ослабления связи Н--С1 в среде с большой диэлектрической постоянной. Переход ионов в раствор сопровождается их гидратацией:
НС1 + nН2О H+ (Н2О)x + С1- (Н2О)n-x
Такой же процесс наблюдается и при растворении ионно-ковалентных кристаллов (например, NaCI) в воде. Хотя в кристаллической решетке NaCl нет ионов Na+ и Сl-, однако взаимодействие с дипольными молекулами растворителя способствует поляризации связей в кристалле, их ослаблению и обеспечивает возможность перехода частиц в раствор с образованием гидратированных ионов:
НС1 + nН2О Na+ (Н2О)x + С1- (Н2О)n-x
Таким образом, в сильно полярных растворителях ионизируются не только вещества с преимущественно гетерополярной связью (соли), но и молекулы, характеризующиеся малой ионностью. С этой точки зрения известное правило “подобное растворяется в подобном” не является универсальным.
Процесс гидратации сильно экзотермичен и идет самопроизвольно с уменьшением энтальпии. Теплота гидратации заметно превышает энергию разрыва связи (теплоту диссоциации). Обычно степень гидратации, т. е. количество молекул растворителя, окружающих каждый ион, очень велико (n и х - целые числа, n >> 1, x >>1); лишь при ионизации кислоты х = 1:
НA + nН2О H3O+ + A-(Н2О)n-1
Это объясняется малым размером иона водорода (протона), который составляет 10-4 от размера атома. При гидратации протон внедряется в сферу молекулы H2O с образованием оксоний-иона Н3О+. Новая ковалентная связь образуется по донорно-акцепторному механизму за счет свободной электронной пары кислорода и является насыщенной. Одной из количественных характеристик электролитической ионизации является степень ионизации, которая определяется как отношение диссоциированных молекул к общему числу растворенных молекул. Обычно степень ионизации выражают в долях единицы или в процентах:
б = (n/n0)100,
где n0 - число растворенных частиц; n - число частиц, подвергшихся электролитической ионизации.
По степени ионизации электролиты условно подразделяются на сильные (б > 30%) и слабые (б < 3%). Степень ионизации зависит от природы растворителя. Чем более полярна молекула растворителя, тем при прочих равных условиях выше степень ионизации растворенного вещества. Поскольку электролитическая ионизация сопровождается тепловым эффектом, то степень ионизации зависит от температуры, причем влияние температуры можно оценить по принципу Ле-Шателье: если электролитическая ионизация представляет собой эндотермический процесс, то с повышением температуры степень ионизации растет, в противоположном случае -- уменьшается.
Сильно влияет на степень электролитической ионизации концентрация раствора. Если рассматривать электролитическую ионизацию как равновесный обратимый химический процесс
KA + nН2О K+ (Н2О)x + A- (Н2О)n-x ,
то в соответствии с принципом смещения равновесия разбавление водой увеличивает количество диссоциированных молекул, т. е. степень ионизации при разбавлении возрастает. В связи с этим деление электролитов по силе в соответствии с величиной степени ионизации условно и приведенная классификация справедлива только для 0,1 н. растворов.
Процесс электролитической ионизации удобнее характеризовать константой ионизации, применив к нему законы химического равновесия. Так, для реакции
КА К+ + А-
константа ионизации
Ки = [К+][А-]/[КА].
Здесь и далее символом [ ] обозначаются молярные концентрации компонентов. В отличие от степени ионизации константа электролитической ионизации зависит лишь от природы электролита и температуры. Чем больше величина Ки, тем сильнее электролит.
Между константой и степенью электролитической ионизации существует количественная связь. Действительно, пусть в рассмотренном процессе общее количество растворенного вещества КА равно С, а степень ионизации равна б. Тогда [К+] = [А-] = бС и, соответственно, концентрация недиссоциированных частиц [КА] = (1 - б)С. Подставив эти значения в выражение для константы ионизации, получим:
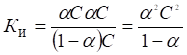
Полученное соотношение известно под названием закона разбавления Оствальда.
Для слабых электролитов, когда б << 1, Ки б2С. Отсюда
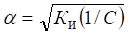 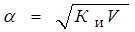
где V - разбавление,
Из формулы следует, что если, например, разбавить раствор в 100 раз, то степень ионизации возрастет в 10 раз.
С учетом степени электролитической ионизации можно применить законы разбавленных растворов и к растворам электролитов введением поправочного множителя i, называемого изотоническим коэффициентом Вант-Гоффа. Тогда отношение соответствующего свойства (понижение давления пара, изменение температуры плавления и кипения, осмотическое давление) для электролита к аналогичному свойству раствора неэлектролита той же концентрации равно коэффициенту Вант-Гоффа, т.е.
?P'/?P = ?T'3/?T3 = ?T'k/?Tk = P'осм/Росм = i
Очевидно, что для растворов электролитов всегда i > 1, а для растворов неэлектролитов i = 1. Законы разбавленных растворов могут быть легко трансформированы применительно к растворам электролитов:
P'осм. = iСRT, Tзам. = iKСm,
Tкип. = iEСm, P' = iP0AxA
Контрольные вопросы
.Закон разведения Оствальда.
2.Константа и степень ионизации. Использование их при рaсчетах.
3.Смещение ионного равновесия.
4.Влияние одноименных ионов. Основные
положения теории сильных электролитов.
|
|
|
 Скачать 0.52 Mb.
Скачать 0.52 Mb.