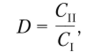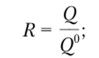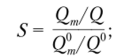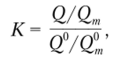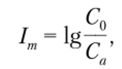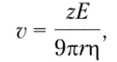7. Комплексонометрическое титрование Теоретические основы комплексонометрии. Классификация методов. Комплексоны: ЭДТА, трилон Б и др. Индикаторы комплексонометрии (хромоген черный, эриохром, мурексид и др). Примеры комплексонометрического титрования. 8. Физико-химические (инструментальные) методы анализа Электрохимические методы анализа Характеристика титриметрических электрохимических методов анализа. Классификация методов. Методы без наложения и с наложением внешнего потенциала. Прямые и косвенные электрохимические методы. 1. Потенциометрический анализ (потенциометрия) Принцип метода. Определение концентрации анализируемого вещества в прямой потенциометрии. Применение прямой потенциометрии. Сущность потенциометрического титрования. Индикаторный электрод и электрод сравнения. Определение рН растворов. Определение точки эквивалентности по потенциалу индикаторного электрода. Кривые потенциометрического титрования. 2. Кондуктометрический анализ (кондуктометрия) Принцип метода, основные понятия. Связь концентрации растворов электролитов с их электрической проводимостью. Прямая кондуктометрия. Определение концентрации анализируемого раствора по данным измерения электропроводности (расчетный метод, метод градуировочного графика). Кондуктометрическое титрование. Сущность метода. Типы кривых кондуктометрического титрования. Оптические методы анализа 1. Колориметрические и спектрофотометрические методы Основы колориметрических и спектрофотометрических методов анализа. Закон Бугера – Ламберта – Бера. Молярный коэффициент поглощения. Оптическая плотность растворов. Визуальные и фотоэлектроколориметрические методы анализа. Построение калибровочного графика. Фотоэлектроколориметры и спектрофотометры. Применения колориметрии и спектрофотометрии. 2. Рефрактометрический метод анализа Основы рефрактометрического метода анализа. Показатель преломления. Зависимость показателя преломления от концентрации. Рефрактометры. Применение рефрактометрии. 3. Поляриметрический метод анализа Основы поляриметрического метода. Поляризованный луч. Плоскость поляризации. Оптическая активность веществ. Удельное вращение. Определение концентраций веществ по углу вращения плоскости поляризации. Поляриметры. Область применения поляриметрии. Хроматографические методы анализа Основы хроматографии на твердой неподвижной фазе. Газоадсорбционная хроматография. Колоночный вариант жидкостно-адсорбционной хроматографии. Ионообменная хроматография. Иониты. Тонкослойная хроматография. Сорбенты. Растворители. Принципы хроматографии на жидкой неподвижной фазе. Газожидкостная и жидкостная адсорбционная хроматография (колоночный вариант).
Контрольные вопросы
1. 1.Классификация анионов. Общая характеристика групп анионов.
2.Анализ сухого остатка.
3.Перевод сухого остатка в раствор и метод анализа.
Лекция № 15. Методы концентрирования и разделения.
В практике химического анализа часто встречаются ситуации, когда надежному и точному определению компонента мешают другие компоненты, присутствующие в анализируемом образце, в том числе и основные, составляющие матрицу образца. Устранить влияние метающих компонентов можно двумя способами. Первый способ, так называемое маскирование, заключается в переводе мешающего компонента в аналитически неактивную форму. Эту операцию можно провести непосредственно в аналитической системе, причем мешающие компоненты остаются в этой же системе.
Этот прием не всегда удается осуществить, особенно при анализе многокомпонентных смесей. В этом случае используют второй способ — разделение компонентов и (или) концентрирование определяемого компонента. Концентрирование определяемого компонента применяется также в том случае, если его содержание в анализируемой системе оказывается ниже предела обнаружения выбранного аналитического метода. Операции разделения и концентрирования часто совмещаются.
Разделение — это операция (процесс), в результате которой компоненты, составляющие исходную смесь, отделяются один от другого.
Концентрирование — операция (процесс), в результате которой повышается отношение концентрации или количества микрокомпонента к концентрации или количеству макрокомпонента.
При концентрировании микрокомпоненты либо собираются в меньшем объеме или массе (абсолютное концентрирование), либо отделяются от макрокомпонента таким образом, чтобы отношение концентрации микрокомпонента к концентрации макрокомпонента повышалось (относительное концентрирование). Примером абсолютного концентрирования может служить упаривание пробы при анализе природных вод.
Различают групповое и индивидуальное разделение и концентрирование. При групповом за один прием выделяется несколько компонентов, при индивидуальном — один.
Многие методы разделения и концентрирования основаны на различии распределения веществ между двумя фазами. При этом процесс включает в себя две стадии: первая — контакт фаз и установление равновесия между ними и вторая — разделение фаз. Методы разделения классифицируются:
а) по природе процессов разделения;
б) агрегатному состоянию контактирующих фаз;
в) характеру процессов разделения.
Наиболее общей является классификация по природе процессов разделения: физико-химические (осаждение и соосаждение, экстракция, сорбция, электрохимические методы и т.п.) и физические (испарение, зонная плавка, направленная кристаллизация и т.п.). При этом для каждой сферы науки или техники, в которых применяется химический анализ, характерен свой набор методов разделения и концентрирования. Например, при анализе сточных и природных вод на содержание органических веществ в случае необходимости обычно используют сорбционные методы, выпаривание п вымораживание, выделение летучих органических веществ испарением, экстракцию и хроматографические методы разделения.
При разделении возможны следующие сочетания контактирующих фаз: газ — жидкость, газ — твердое тело, жидкость — жидкость, жидкость — твердое тело. Разделение может осуществляться статическим (одноступенчатым), динамическим или хроматографическим (многоступенчатыми) способами.
При описании разделения и концентрирования используют следующие количественные характеристики:
• коэффициент распределения между контактирующими фазами
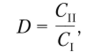
где С, и С„ — концентрация компонента в первой и второй фазах соответственно;
• степень извлечения
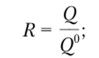
• коэффициент разделения
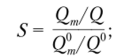
• коэффициент концентрирования
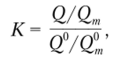
где Q0 и Q°m — количества определяемого компонента и матрицы в образце до процесса разделения и (или) концентрирования; Q и Qm — количества определяемого компонента и матрицы в анализируемой системе после процесса разделения и (или) концентрирования.
В настоящее время все большее распространение получают так называемые гибридные и комбинированные методы, в которых операции разделения, концентрирования и собственно химического анализа совмещаются в одном приборе. Например, при анализе природных объектов (воды, льда, почвы) на присутствие в них тяжелых металлов довольно широко используется метод инверсионной вольтамперометрии. В этом методе на первой стадии происходит электрохимическое разделение и концентрирование микропримесей тяжелых металлов на поверхности электрода, а на второй — вольтамперометрический анализ полученного концентрата.
Маскирование. Маскирование достигается введением в анализируемую систему вещества, которое переводит мешающий анализу компонент в аналитически неактивную форму. При этом не происходит образования новой фазы, как это имеет место при разделении, и поэтому исключаются операции разделения фаз перед анализом.
Различают два вида маскирования — термодинамическое (равновесное) и кинетическое (неравновесное). При термодинамическом маскировании создают такие условия, при которых концентрация мешающего компонента в аналитически активной форме оказывается ниже предела обнаружения используемого аналитического метода. При кинетическом маскировании добиваются значимого различия в скоростях реакции определяемого и мешающего компонента с реагентом, используемым для их обнаружения.
Для проведения операции маскирования используются следующие группы маскирующих веществ.
1. Вещества, переводящие мешающий компонент в устойчивое комплексное соединение. Например, железо(Ш) образует кроваво-красный комплекс [Fe(SCN)J("“3) , который мешает обнаружению кобальта в виде комплекса синего цвета [Co(SCN)J°7 2) . Устранить мешающее влияние железа можно введением фторида натрия, который переводит железо(Ш) в более устойчивый бесцветный комплекс [FeF6]3 .
2. Вещества, изменяющие степень окисления мешающего иона. Например, чтобы устранить мешающее влияние хрома(Ш), его обычно окисляют до хрома(У1).
3. Вещества, осаждающие мешающие ионы, но осадок при этом можно не отделять.
4. Вещества со специфическим действием. Например, в методе инверсионной вольтамперометрии в анализируемую систему может добавляться муравьиная кислота, которая, разлагаясь под действием ультрафиолетового излучения на радикалы, связывает растворенный кислород и разрушает органические поверхностно активные вещества.
Для оценки эффективности маскирования используют так называемый индекс маскирования 1т:
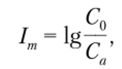
где С0 — общая концентрация мешающего компонента; Са — концентрация компонента в аналитически активной форме. Индекс маскирования может быть рассчитан по константам равновесия соответствующих маскирующих реакций.
Экстракция. Экстракцией называются физико-химический процесс распределения вещества между двумя фазами, чаще всего между двумя несмеши- вающимися жидкостями (обычно между водой и органическими растворителями), и соответствующий метод выделения, разделения и концентрирования веществ.
При экстракции одновременно может протекать несколько процессов: образование экстрагируемых соединений, распределение этих соединений между двумя фазами, реакции в органической фазе (диссоциация, ассоциация, полимеризация). Компонент, ответственный за образование экстрагируемого соединения, называется экстрагентом. Инертные органические растворители, в которых растворяется экстрагент и которые способствуют улучшению физических и экстракционных свойств экстрагента, называются разбавителями. Разбавитель должен иметь плотность существенно больше или меньше плотности воды и слабую растворимость в воде, для того чтобы легче было разделить водную и органическую фазы, а также малую токсичность. Фаза, содержащая экстрагированное соединение, называется экстрактом. Обратный перевод экстрагированного вещества из органической фазы в водную называется реэкстракцией, а раствор, используемый для этого, — реэкстрагептом.
Экстракция имеет место только в том случае, если экстрагируемое соединение лучше растворимо в органической фазе, чем в воде. Это оказывается возможным, если соединение гидрофобно. Гидрофобность обеспечивается переводом экстрагируемого вещества во внутрикомплексное соединение (хелатный комплекс), содержащее крупные гидрофобные органические лиганды, нейтрализацией его заряда за счет образования нейтральных комплексов или ионных ассоциатов, сольватацией экстрагируемого соединения молекулами экстрагента. Экстракция ионных ассоциатов улучшается с увеличением размеров ионов и уменьшением их заряда.
Экстракция может осуществляться периодическим или непрерывным методами. Периодическая экстракция представляет собой экстракцию вещества отдельными порциями свежего экстрагента. В этом случае при достаточно высоких значениях коэффициента распределения даже однократная экстракция позволяет количественно извлечь вещество. Непрерывная экстракция осуществляется при непрерывном контакте и относительном движении двух фаз. При этом одна из фаз остается неподвижной, а вторая пропускается через объем первой в виде отдельных капель.
Экстракционные методы пригодны для разделения, концентрирования, извлечения микро- или макрокомпонентов, индивидуального и группового извлечения компонентов при анализе разнообразных природных объектов. Метод прост и быстр, обеспечивает высокую эффективность разделения и концентрирования и совместим с различными аналитическими методами. Селективность разделения можно улучшить оптимизацией условий проведения процесса, например выбором соответствующего pH, разбавителя, концентрации экстрагента, введением маскирующего агента.
Хроматография. В тех случаях, когда коэффициенты распределения компонентов смеси между двумя фазами различаются незначительно, разделить их можно только с использованием динамических хроматографических методов. Хроматографией называется способ разделения веществ, основанный на различии в их коэффициентах распределения между двумя фазами, одна из которых неподвижна, а вторая направленно движется относительно первой. Необходимыми условиями для проведения хроматографии являются наличие достаточно большой поверхности раздела между фазами и динамический способ разделения (одна фаза движется относительно второй). Сочетание этих двух условий обеспечивает высокую эффективность хроматографии, позволяющей отделять друг от друга очень близкие по своим свойствам вещества, такие как, например, изотопы элементов или оптические изомеры.
Существует несколько способов классификации хроматографических методов.
1. По агрегатному состоянию подвижной фазы различают жидкостную и газовую хроматографии. Жидкостную хроматографию в зависимости от агрегатного состояния неподвижной фазы делят на твердожидкофазную и жидко-жидкофазную хроматографии. Последнюю часто называют распределительной хроматографией. Газовую хроматографию в зависимости от агрегатного состояния неподвижной фазы делят на газоадсорбционную (твердая неподвижная фаза) и газожидкостную или газораспределительную.
2. В зависимости от механизма распределения компонентов хроматографию делят на молекулярную и хемосорбционную. В молекулярной хроматографии взаимодействие между неподвижной фазой и компонентами разделяемой смеси осуществляется за счет межмолекулярных сил типа сил Ван-дер-Ваальса. К хемосорбционной хроматографии относят ионообменную, осадочную, лигандообменную (комплексообразовательную), окислительно-восстановительную. В этом случае разделение компонентов смеси происходит в результате соответствующих химических реакций.
3. По способу осуществления хроматографию классифицируют на фронтальную, проявительную (элюентную) и вытеснительную. В аналитической химии чаще всего используется проявительная хроматография.
4. По технике выполнения различают колоночную хроматографию (неподвижная фаза находится в колонке) и плоскостную — бумажную или тонкослойную (неподвижная фаза — лист бумаги или тонкий слой сорбента на стеклянной или металлической пластинке).
Сущность хроматографического метода заключается в следующем. В верхнюю часть колонки, на тонкий слой сорбента или на полоску бумаги вносят небольшой объем разделяемой смеси (во много раз меньший, чем объем неподвижной фазы). Компоненты смеси сорбируются в верхних слоях сорбента в колонке или в месте нанесения пробы в случае плоскостной хроматографии, причем слабо сорбирующиеся компоненты перемещаются вдоль колонки или по радиусу пятна несколько дальше, чем сильно сорбирующиеся компоненты. Образуется так называемая первичная хроматограмма, в которой полного разделения компонентов, как правило, не происходит.
Для достижения полного разделения первичную хроматограмму проявляют, промывая колонку (обрабатывая тонкий слой сорбента, бумагу) подходящим растворителем (подвижной фазой). Скорость движения разделяемых компонентов по направлению движения подвижной фазы определяется величиной их коэффициента распределения между подвижной и неподвижной фазами. Чем больше коэффициент распределения, тем быстрее передвигается компонент. Если условия проведения процесса (природа неподвижной и подвижной фаз, длина колонки, скорость движения подвижной фазы) подобраны правильно, то происходит полное разделение компонентов, и они последовательно друг за другом выходят из колонки. Таким образом, появляется возможность отобрать фракции, содержащие отдельные компоненты смеси, и проанализировать их подходящими аналитическими методами.
В современных газовых и жидкостных хроматографах на выходе из колонки помещается детектор, позволяющий регистрировать факт прохождения какого-либо компонента через колонку. По времени прохождения компонента можно определить его природу, а по величине сигнала детектора — его количество. В качестве детекторов используются неселективные анализаторы, такие как кондуктометры, рефрактометры и т.п. Таким образом, в хроматографах происходит разделение с одновременным качественным и количественным анализом компонентов.
Сорбция. Это процесс поглощения газов, паров и растворенных веществ твердыми или жидкими веществами. Сорбцию широко используют для разделения и концентрирования веществ. При этом обычно достигается хорошая селективность разделения и большие значения коэффициентов концентрирования.
Процессом сорбции относительно легко управлять, а для реализации этого метода не требуется сложного приборного оформления и экстремальных условий. Он легко сочетается с различными аналитическими методами последующего определения компонентов. Поэтому метод сорбции удобен для проведения работ в полевых условиях.
Классификация сорбционных методов основана на различиях в механизме взаимодействия вещества с сорбентами. Различают адсорбцию (физическую сорбцию и хемосорбцию на твердой фазе), распределение веществ между двумя несмешивающимися фазами (жидкая фаза на сорбенте) и капиллярную конденсацию — образование жидкой фазы в порах и капиллярах твердого сорбента при поглощении паров вещества. В чистом виде эти механизмы, как правило, не наблюдаются.
Процесс сорбции может осуществляться двумя методами: статистическим и динамическим. Последний положен в основу хроматографических методов разделения. В аналитической практике используют разнообразные сорбенты: активные угли, ионообменные и хелатообразующие смолы, обычные и химически модифицированные кремнеземы и целлюлоза, оксиды, гидроксиды, алюмосиликаты, гетерополикислоты и их соли и т.п.
Электрохимические методы разделения и концентрирования. Электрохимические методы разделения и концентрирования включают в себя электролиз при контролируемом потенциале, метод цементации (внутренний электролиз) и электрофорез.
Электролиз. Метод основан на осаждении элемента или какого-либо соединения этого элемента на электроде электрическим током при контролируемом потенциале. Наиболее распространен вариант катодного осаждения металлов, анодное осаждение, например в форме оксидов, используют редко. Материалом электродов могут служить ртуть, в том числе в виде тонкопленочного ртутного электрода, углерод (графит, стеклоуглерод), платина и ее сплавы, серебро, медь, вольфрам. Состав образующегося на электроде осадка зависит от условий процесса (в первую очередь — величины электродного потенциала), состава электролита и материала электродов.
Существуют различные варианты метода. В одном случае подбором соответствующего состава электролита и величины потенциала можно селективно выделить определенный компонент, во втором (варьируя потенциал в широких пределах) — группу компонентов, а затем определить каждый из них соответствующими селективными методами. Полного разделения удается достичь, когда определяемый компонент отделяется от электрохимически неактивных веществ. Например, при выделении из водного раствора на катоде к таким веществам будут относиться соли активных металлов и органические соединения.
При концентрировании микрокомпонентов более удобен вариант выделения на электроде их, а не компонентов матрицы, так как в этом случае уменьшаются потери микрокомпонента, возможные за счет его механического захвата осаждающейся матрицей, образования интерметаллических соединений и твердых растворов. В большинстве случаев для полного выделения микрокомионента требуется очень большое время, поэтому ограничиваются частичным его выделением. Концентрирования микрокомионента можно достичь не только его осаждением на электроде, но и электрохимическим растворением матрицы.
Электролитическое выделение в большинстве случаев составляет неотъемлемую часть инверсионных электрохимических методов, из которых наиболее распространена инверсионная вольтамперометрия.
Метод цементации заключается в восстановлении компонентов (обычно микрокомпонентов) на активных металлах (алюминий, цинк, магний) или амальгамах этих металлов. При цементации одновременно происходят два процесса: катодный (выделение компонента) и анодный (растворение цементирующего металла). Например, этот метод используется для выделения соответствующих микроэлементов (в основном тяжелых металлов) из природных вод с последующим их определением атомно-эмиссионной спектроскопией.
Электрофорез. Метод основан на зависимости скорости движения заряженных частиц в электрическом поле от величины их заряда, формы и размеров. Эта зависимость для сферических частиц описывается уравнением
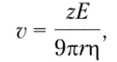
где z — эффективный заряд частицы, который в растворах меньше заряда иона вследствие влияния ионной атмосферы; Е — напряженность электрического поля; г — эффективный радиус частицы, учитывающий толщину сольватной оболочки; г — вязкость среды. На скорость движения частиц сильно влияет состав среды, в частности pH, что используют для повышения селективности разделения.
Различают два варианта электрофореза: фронтальный и зонный (на носителе). В первом случае небольшой объем исследуемого раствора помещают в капилляр с электролитом. Во втором случае движение ионов происходит в среде реагента, которым специально обработана бумага. При этом частицы удерживаютя на бумаге после отключения поля. Главная область применения классического электрофореза — биохимический анализ: разделение белков, ферментов, нуклеиновых кислот и т.п.
Капиллярный электрофорез интенсивно развивается с начала 1980-х гг. Это было обусловлено существенным уменьшением диаметра капилляра
(до 50—100 мкм) и переходом к прямому спектрофотометрическому определению компонентов непосредственно в капилляре. К основным достоинствам метода относятся его высокая эффективность и простота аппаратурного оформления. Капиллярный электрофорез получил применение для анализа сточных и природных вод на содержание неорганических компонентов (катионов и анионов).
Другие методы разделения и концентрирования. Существует ряд других методов разделения и концентрирования, которые с тем или иным успехом используются для целей анализа. К ним можно отнести осаждение и соосаждение, методы испарения (дистилляция, отгонка, возгонка), вымораживание. Все эти методы при определенных условиях позволяют достичь высоких значений коэффициента концентрирования.
Для разделения гетерогенных систем широко используются фильтрация, седиментация и ультрацентрифугирование.
Контрольные вопросы
Сорбционные процессы в аналитической химии.
2.Примение экстрагентов в химическом анализе.
3.Концентрирование растворов.
4.Основные принципы хроматографии.
Литература
Основная литература:
1. Посыпайко В.И., Козырева Н.А., Логачева Ю.П. Химические методы анализа – М.:ВШ. 1989.
2. Алексеев В.Н. Курс качественного химического полумикроанализа. 5-е изд. – М.:Химия.1973.
3. Крешков А.П. Основы аналитической химии. Т.1,2,3. – М.: Химия. 1976.
4. Пилипенко А.Т., Пятницкий И.В. Аналитическая химия (в 2-х книгах). – М.: Химия. 1990.
5. Васильев В.П. Аналитическая химия. Т.1,2. – М.: ВШ. 2006.
6. Каланова Ш.М., Жалгасбаева М.К. Сборник тестов по количественному анализу. – Алматы. 1998.
7. Толстоусов В.Н., Эфрос С.М. Задачник по количественному анализу. – Л.: Химия. 1987.
8. Пономарев В.Д. Аналитическая химия. Т 1,2 – М:.ВШ – 1982.
9. Основы аналитической химии. Под ред. Ю.А.Золотова. В 2 кн., М.: Высшая школа., 2000,- 845 с.
Дополнительная литература:
10. Москвин Л.Н., Царицына Л.Г. Методы разделения и концентрирования в аналитической химии. – Л.: Химия. 1991.
11. Карпов Ю.А., Савостин А.П. Методы пробоотбора и пробоподготовки. - М.: БИНОМ. Лаборатория знаний. 2003.
12. Справочник химика. Т.4. – Л.: Химия. 1967.
13. Лурье Ю.Ю. Справочник по аналитической химии. – М.: Химия. 1989.
14. INTERNET |
 Скачать 0.52 Mb.
Скачать 0.52 Mb.