Лекция. Лекция%2011%20ОВР. Лекция 11. Окислительновосстановительные реакции
 Скачать 79.23 Kb. Скачать 79.23 Kb.
|
|
Лекция 11. Окислительно-восстановительные реакции Реакции, сопровождающиеся изменением степеней окисления элементов, называются окислительно-восстановительными. Название сложилось исторически с давних пор, когда стали известны реакции окисления металлов кислородом и их восстановления из оксидов. В настоящее время к реакциям восстановления и окисления относят не только реакции с кислородом, но и все реакции, сопровождающиеся передачей электронов. Окислителем называется вещество, в составе которого есть элемент, принимающий электроны. Восстановителем называется вещество, в составе которого есть элемент, отдающий электроны. Типичными окислителями являются вещества, в составе которых есть элементы в высшей степени окисления. Например: KMnO4, NaNO3, KClO4. Типичными восстановителями являются вещества, содержащие элементы в низшей степени окисления. Например: NH3, H2S, KI и другие галогениды. Вещества, содержащие элементы в промежуточных степенях окисления, проявляют окислительно-восстановительную двойственность, т.е. могут быть и окислителями и восстановителями в зависимости от реагента. Например: NaNO2, Na2SO3, NaClO и т.д. Каждая окислительно-восстановительная реакция состоит из двух полуреакций: полуреакции окисления и полуреакции восстановления, которые составляют единый процесс. Восстановитель в результате реакции окисляется, а окислитель – восстанавливается. Если цинковую пластинку поместить в раствор сульфата меди, то через некоторое время будет заметно растворение цинка и выделение меди на поверхности цинковой пластинки, т.е. будет протекать следующая реакция: Zn + CuSO4 = ZnSO4 + Cu, или в ионном виде: Zn + Cu2+ = Zn2+ + Cu. Конечно, мы привели схему процесса. В реальном процессе ионы окружены гидратными оболочками, т.е. являются гидратированными. Расчет термодинамических характеристик данной реакции показывает, что H298 = –216,8 кДж/моль, S298 = –16,1 э.е. Отсюда G = –21680 + 16,1T. При стандартных условиях константа равновесия этой реакции равна 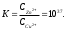 Такое высокое значение константы равновесия указывает на практическую необратимость данной реакции. Если разделить реакцию цинка с раствором сульфата меди на две полуреакции и провести их раздельно в приборе, изображенном на рисунке 4.8, то можно получать полезную работу.  Рис. 4.8. Схема гальванического элемента Если растворы, содержащие цинковую и медную пластинки, не соединены солевым мостиком, то в каждом из них протекают следующие процессы: полуреакция растворения цинка Zn = Zn2+ + 2e; DG0 = -152420 + 48,1T; полуреакция растворения меди Сu = Cu2+ + 2e; DG0 = 64390 + 132T. Оба эти процесса являются строго равновесными. Константа равновесия цинка в растворе достаточно велика, при стандартных условиях К = 1019. Так как водные растворы не обладают электронной проводимостью, то освобождающиеся электроны накапливаются на поверхности цинка, создавая строго определенную равновесную концентрацию. На поверхности цинка создается отрицательный заряд или потенциал Е1. Вследствие электростатического притяжения электронов в металле и ионов в растворе на границе двух сред возникает двойной электрический слой. Медная пластинка тоже равновесна в водном растворе СuSO4, но константа этого равновесия при тех же условиях очень мала: К = 10-18. Поэтому концентрация электронов на медной поверхности намного меньше, чем на цинковой. Это приводит к тому, что потенциал медной пластинки Е2 должен быть более положительным по сравнению с потенциалом цинковой пластинки. Если эти две полуреакции соединить солевым мостиком, а цинковую и медную пластинки металлическим проводником, то электроны будут перемещаться от того элементa, где их избыток, к тому элементу, где их недостаток. Возникнет электрический ток. Замкнутая неравновесная система называется гальваническим элементом. Для восстановления равновесного потенциала цинкового электрода цинк переходит в раствор, медь для восстановления своего равновесного потенциала должна выделяться из раствора. Разность потенциалов между электродами (цинком и медью) Е = Е2 – E1 называется электродвижущей силой, а величины Е1 и Е2 – электродными потенциалами. В элементах, подобных изображенному на рисунке 4.8, можно использовать и другие комбинации металлов. Если в качестве пары металлов взять никель и медь, то никель окисляется на аноде, а ионы меди восстанавливаются на катоде. Элемент в этом случае имеет эдс Е = 0,57 В. Если же используются цинк и никель, то цинк окисляется, а ионы никеля восстанавливаются, и эдс этой системы равен 0,53 В (при концентрации ионов в растворе, равной 1 моль/л). Электродвижущие силы гальванических элементов обладают таким же свойством аддитивности, как и реакции Ni + Cu2+ = Ni2+ + Cu E0 = +0,57 B Zn + Ni2+ = Zn2+ + Ni E0 = +0,53 B Zn + Cu2+ = Zn2+ + Cu E0 = +1,10 B. Положительный знак эдс означает, что электрохимическая реакция самопроизвольно протекает слева направо. Символ Е0 означает стандартный потенциал, соответствующий 1 М концентрации реагирующих ионов и температуре 298 К. Водородный электрод Электродные реакции не обязательно должны протекать на металлах. На рисунке 4.9 изображен гальванический элемент, в котором катодная реакция представляет процесс восстановления водорода 2H+ + 2e = H2 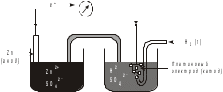 Рис. 4.9. Гальванический элемент с водородным электродом В гальваническом элементе с водородным электродом протекают следующие реакции: На аноде: Zn(тв.) Zn2+ + 2e На катоде: 2H+ + 2e H2(г.) Полная реакция: Zn(тв.) + 2H+ Zn2+ + H2 (г.) Такая же полная реакция протекает при погружении полоски металлического цинка в раствор серной кислоты. Металл растворяется в кислоте, а газообразный водород выделяется на катоде. Водородный электрод используется в электрохимии в качестве стандартного, его электродный потенциал при стандартных условиях принимается равным нулю. Основой водородного электрода служит пластинка черненой платины, погруженной в 1 М раствор серной кислоты. Через раствор непрерывно пропускают газообразный водород под давлением 013 гПа (1 атм). Мелкодисперсная платина хорошо адсорбирует водород на своей поверхности. В растворе устанавливается равновесие: H+ + e 1/2H2. Относительно такого электрода, который является международным электродом сравнения, определяют потенциалы других электродов. Электродные потенциалы, определенные относительно стандартного водородного электрода при стандартных условиях (температура 298 К и давление 1013 гПа), называются стандартными электродными потенциалами. Когда электрический заряд величиной q самопроизвольно перемещается между точками с разностью потенциалов Е вольт, он выполняет внешнюю электрическую работу WВНЕШН. = qE. Поэтому изменение изобарно-изотермического потенциала системы, в которой происходит перемещение электрического заряда, равно G = WВНЕШН = –qE. Так как электрон имеет отрицательный заряд, он должен самопроизвольно перемещаться из области с низким потенциалом в область с высоким потенциалом. Для электрона, перемещаемого между точками с разностью потенциалов Е в направлении повышения потенциала, изменение свободной энергии равно G = -eE. Для моля электронов G = -NeE = -FE, где N – число Авогадро, F = Ne – заряд одного моля электронов, равный 96485 Кл, или 1 фарадею. Если на моль реакции приходится n электронов ( т.е. заряд nF фарадеев на моль), изменение свободной энергии составляет G = – nFE. Отсюда Е = – G/nF. Реакция в гальваническом элементе (его называют элементом Даниэля) Zn(тв.) + Сu2+ Zn2+ + Cu(тв.) создает стандартное напряжение элемента 1,10 В. Следовательно, эта реакция должна иметь стандартный изобарно-изотермический потенциал, равный G = –2(96500)(+1,10) = –212300 Дж/моль, n – число электронов, перемещающихся в реакции на каждый ион. Аналогично можно рассчитать изменение изобарно-изотермического потенциала для других окислительно-восстановительных реакций. Международный союз по чистой и прикладной химии (ИЮПАК) принял решение, что электродные потенциалы следует записывать как потенциалы восстановления. Термином "электродный потенциал" следует обозначать величины, имеющие знак, соответствующий направлению протекания реакции восстановления. Так, реакцию на цинковом электроде следует записать следующим образом: Zn2+(ГИДР.) + 2e = Zn(тв.), Е0 = –0,763 В. Тогда говорят, что цинк имеет электродный потенциал минус 0,763 В. Если два электродных потенциала объединяют и получают гальванический элемент, который используют в качестве электрической батареи, то электрод, имеющий более отрицательный потенциал, считают отрицательным электродом, так как он является источником электронов. Для подсчета эдс элемента на основании стандартных электродных потенциалов следует от из величины потенциала более положительного электрода вычесть значение электродного потенциала менее положительного электрода. Например, гальванический элемент, составленный из натриевого и цинкового электродов, имеет эдс. E0Na-Zn = E0Zn - E0Na = -0,763 B - (-2,71 B) = + 1,95 B, т.е. натрий выступает в качестве анода, а цинк – в качестве катода. Величины электродных потенциалов существенно зависят от температуры и концентрации окислителя и восстановителя. Зта зависимость хорошо описывается уравнением Нернста: 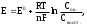 где Е0 – стандартный электродный потенциал; R – универсальная газовая постоянная; Т – абсолютная температура; n – число электронов, участвующих в электродном процессе; F – число Фарадея; CОК. – концентрация окислителя; CВОССТ. – концентрация восстановителя. Если гальванический элемент составлен из одинаковых электродов, помещенных в раствор собственной соли различной концентрации, то такой элемент называется концентрационным. Электродвижущая сила такого элемента определяется соотношением концентраций растворов, так как величина Е для обоих электродов будет одинаковой: 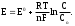 В стандартных условиях при С = С0 = 1 моль/л Е = Е0. Типы окислительно-восстановительных реакций Окислительно-восстановительные реакции очень распространены. Можно сказать, что большинство химических реакций относится к этому виду. Среди всех окислительно-восстановительных реакций различают три типа: 1. Внутримолекулярные окислительно-восстановительные реакции. К ним относятся реакции, в которых внутри одной молекулы атомы одного элемента являются восстановителями, а атомы другого элемента – окислителями. Например, реакция разложения бихромата аммония: (NH4)2Cr2O7 Cr2O3 + N2 + 4H2O. В молекуле бихромата аммония атомы хрома в степени окисления, равной шести, являются окислителями, а атомы азота в степени окисления минус три – восстановителями. 2. Реакции самовосстановления – самоокисления. Их часто называют реакциями диспропорционирования. В таких реакциях атомы одного и того же элемента являются и окислителями и восстановителями. Такие реакции достаточно характерны для элементов, образующих соединения в различных степенях окисления. Например, реакция хлора с водой: Cl2 + H2O HClO + HCl. 3. Межмолекулярные окислительно-восстановительные реакции. В этих реакциях одна из молекул является восстановителем, а другая – окислителем. Например, 2KMnO4 + 10KI + 8H2SO4 2MnSO4 + 5I2 + 6K2SO4 + 8H2O Методы уравнивания окислительно-восстановительных реакций Определение коэффициентов в уравнениях окислительно-восстановительных реакций обычно проводят двумя методами: методом электронного баланса и ионно-электронным методом (метод полуреакций). Метод электронного баланса основан на подсчете числа электронов, теряемых или приобретаемых элементами в окислительно-восстановительной реакции, с учетом изменения степеней окисления. Рассмотрим этот метод на примере реакции K2Cr2O7 + 6KI + 7H2SO4 Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O. Сначала определим элементы, изменяющие степени окисления в ходе реакции. К ним относятся хром и иод. Степень окисления хрома была +6, а стала +3. У иода была степень окисления, равная –1, стала 0. Изменение степеней окисления изобразим в виде схемы:  Cr+6 + 3e Cr+3 2 2I-1 – 2e I20 3 Вследствие электронейтральности химической реакции число отданных окислителем электронов должно быть равно числу электронов, принятых восстановителем. Поэтому вводятся дополнительные множители, изображаемые справа от схемы перехода электронов за вертикальной чертой. Эти множители и представляют собой коэффициенты при молекулах окислителя и восстановителя. Далее уравнивают число атомов, не принимающих участия в окислительно-восстановительной реакции, т.е. атомов, не изменивших степени окисления. Затем уравнивают ионы кислотных остатков, не изменивших свои заряды. В нашем случае это сульфат-ионы. Следующим действием является уравнивание количества ионов водорода. С целью проверки правильности подбора коэффициентов производят подсчет числа атомов кислорода в левой и правой частях уравнения реакции. Метод электронного баланса основан на учете изменения степеней окисления элементов. Но степень окисления – это условная формальная величина. Она показывает условный заряд, который приобрел бы атом, если бы электронная пара полностью перешла к более электроотрицательному атому. В действительности же даже в ионных соединениях не происходит полного перехода электронной пары к более электроотрицательному атому. Так, в NaCl ионность связи составляет около 80%, а не 100%. В нашем случае атом хрома находится в степени окисления +6. В настоящее время установлено, что связи хром – кислород в хроматах, а также в других подобных соединениях, преимущественно ковалентные, сложные по природе, включающие б-связи и -связи. Эффективный заряд на атоме хрома в таких соединениях не превышает 2+. В растворах ионы с зарядом более 3+ не могут существовать вследствие большой величины ионного потенциала и сильнейшего поляризующего действия, приводящего к перераспределению электронной плотности между атомами и понижению заряда. Тем не менее термин "степень окисления" широко используется в химии и является удобным при написании уравнений окислительно-восстановительных реакции, особенно при сплавлении. Ионно-электронный метод, или метод полуреакций, используется для составления уравнений окислительно-восстановительных реакции в растворах и основан на составлении частных уравнений восстановления окислителя и окисления восстановителя. Затем эти частные уравнения суммируются в общее уравнение. Общий принцип, лежащий в основе метода полуреакций, аналогичен методу электронного баланса. Он также основан на подсчете числа электронов, теряемых восстановителем и приобретаемых окислителем в реакции. Отличие в том, что окислители и восстановители берутся в их действительном виде, в котором они существуют в растворах (ионы, молекулы и т.д.). Кроме того, обязательно учитывается среда, так как проявление окислительных или восстановительных свойств веществами сильно зависит от среды, в которой протекает та или иная реакция. Например, большое влияние оказывает кислотность среды, присутствие комплексообразователя и т.д. Частные уравнения полуреакции составляют, основываясь на общих правилах написания ионных уравнений. Сильные электролиты записывают в виде ионов, а слабые электролиты, газообразные и труднорастворимые вещества записывают в молекулярном виде. В качестве примера рассмотрим взаимодействие перманганата калия с сульфатом железа (II) в кислой среде: 2KMnO4 + 10FeSO4 + 8H2SO4 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O. Окислителем в этой реакции является ион MnО4–, восстановителем ион Fe2+. Уравнения полуреакций окисления и восстановления имеют следующий вид: MnO4– + 8H+ + 5e Mn2+ + 4H2O 2 2Fe2+ – 2e 2Fe3+ 5 Так как реакция электронейтральна, то число отданных электронов равно числу принятых. Поэтому умножим верхнее уравнение на 2, а нижнее – на 5. Затем просуммируем обе полуреакции с учетом коэффициентов: 2MnO4– + 16H+ + 10Fe2+ + 10e – 10e 2Mn2+ + 10Fe3+ + 8H2O или 2MnO4– + 16H+ + 10Fe2+ 2Mn2+ + 10Fe3+ + 8H2O Затем поставим полученные коэффициенты в исходное уравнение с учетом молекулы K2SO4, ионы которой не участвуют в реакции. Метод полуреакций удобен при подборе коэффициентов реакций с участием органических веществ или веществ, в молекулах которых несколько атомов изменяют свои степени окисления: 3As2S3 + 28HNO3 + 4H2O 6H3AsO4 + 9H2SO4 + 28NO As2S3 +20H2O – 28e 2AsO43– + 3SO42– + 4OH+ 3 NO3- + 4H+ + 3e NO + 2H2O 28 3As2S3 + 60H2O + 28NO3- + 112H+ 6AsO43– + 9SO42– + 120H+ + 28NO + 56H2O После приведения подобных членов с учетом того, что часть ионов водорода идет на связывание нитрат-ионов и образовавшихся арсенат и сульфат-ионов, получим: 3As2S3 + 28NO3– + 4H2O + 28H+ 6AsO43– + 9SO42– + 36H+ + 28NO Полученные коэффициенты поставим в исходное уравнение. Метод полуреакций удобен тем, что можно определить коэффициенты для практически всех участников окислительно-восстановительной реакции. Кроме того, в этом методе не надо прибегать к понятию "степень окисления". В отличие от метода электронного баланса в методе полуреакций четко показывается роль среды в протекании реакции. Так, перманганат-ион восстанавливается в кислой среде до иона Mn2+, в нейтральной – до MnO2, а в щелочной – до MnO42-. Механизмы окислительно-восстановительных реакций изучены недостаточно полно. Электронный баланс и метод полуреакций имеют много недостатков при описании механизма протекания окислительно-восстановительных реакции. И некоторые данные позволяют по-иному описывать механизм окислительно-восстановительных реакций в растворах. Рассмотрим взаимодействие нитрит-иона с хлорноватистой кислотой: NO2– + HClO NO3– + HCl. Согласно методу электронного баланса запишем: 3+ – 2e N5+ Cl+ + 2e Cl– 3+ + Cl+ N5+ + Cl– Используя метод полуреакций, получим: O2– + H2O – 2e NO3– + 2H+ HOCl + H+ + 2e Cl– + H2O NO2– + HOCl + H2O + H+ NO3– + Cl– +2H+ + H2O или NO2– + HOCl NO3– + Cl– + H+ Оба этих метода подбора коэффициентов, несмотря на разницу в подходе, предполагают, что изменение степени окисления азота и хлора в этом процессе происходит в результате передачи электронов от азота к хлору. Но тонкие исследования с помощью меченых атомов показали, что в этой реакции окисление и восстановление связаны с переносом не электронов, а атомов. Аналогичное явление обнаружено и для других окислительно-восстановительных процессов. Установлено также, что перенос положительно заряженной группы атомов или отдельного атома эквивалентен переносу электронов, а перенос отрицательно заряженной группы атомов или атома – присоединению электронов. Так, для реакции нитрит-иона с хлорноватистой кислотой был доказан следующий механизм:             – – – – – –      H2O O O H2O O O   N – –18O Cl N 18O – – Cl N 18O + HCl. N – –18O Cl N 18O – – Cl N 18O + HCl.O O O H H       Как показывает схема, в результате реакции тяжелый кислород от хлорноватистой кислоты через промежуточный комплекс перешел к азоту, а связь хлора с кислородом заменилась на связь хлора с водородом. Видно, что процесс окисления азота не связан с переносом электронов от азота к хлору. Изменение степени окисления связано с переносом нейтрального атома кислорода с молекулы хлорноватистой кислоты на нитрит-ион. Подобное явление установлено для окисления сульфит-ионов до сульфат-ионов анионами гипохлорита, хлорита, хлората и бромата. Тем не менее, число электронов, переходящих от восстановителя к окислителю, и в методе электронного баланса, и в методе полуреакций точно соответствует числу электронов, которое в действительности затрачивается в электрохимической реакции (например, при электролизе раствора или расплава). Это соответствие вроде бы убеждает в реальности процесса переноса электронов в окислительно-восстановительной реакции. Как же устранить это противоречие между условностью понятия "степень окисления" и постоянным соответствием между изменяющейся степенью окисления и числом электронов, участвующих в окислительно-восстановительных процессах? Рассмотрим полуреакцию ClO3– + 2OH– – 2e ClO4– + H2O. Из неё видно, что при получении моля перхлорат-иона на анод переходят два электрона. Степень окисления хлора также изменяется на две единицы: (Cl(V) Cl(VII). Аналогичное явление происходит при окислении манганата в перманганат: MnO4– – e MnO4– или Mn6+ – e Mn7+, т.е. Mn(VI) Mn(VII). Складывается впечатление, что для повышения степени окисления марганца от VI до VII необходимо электрохимически лишить марганец(VI) одного электрона. Но, учитывая ковалентный характер связей Э-О в оксоанионах ClO3– , MnO4– и им подобных, с этим нельзя согласиться. В анионах MnO4–, MnO42–, ClO4–, ClO3– и других потери электронов не происходит. Электронная система этих ионов включает все электроны нейтральных атомов элементов, образующих оксоанионы, и еще несколько электронов, полученных со стороны атомов, соединенных с этим оксоанионом. Например, электрон атома калия в KMnO4. Какова же тогда природа электронов, переходящих из раствора на анод при анодном окислении: ClO3– + 2OH– – 2e ClO4– + H2O? Видимо, более правильно рассматривать процесс превращения ClO3– ClO4– как процесс вхождения нейтрального атома кислорода в координационную сферу атома хлора в хлорат-ионе. Этому процессу предшествует переход электронов с кислорода молекулы воды или гидроксид-иона на анод с высвобождением нейтрального атома кислорода: H2O – 2e [O] + 2H+. Освободившийся атом кислорода координируется с атомом хлора в хлорат-ионе. превращая его в перхлорат-ион. При этом переносе атома кислорода от гидроксид-иона или воды к хлорат-иону и превращении его в в перхлорат и происходит повышение степени окисления атома хлора на две единицы. |
