10. Биохимия крови. Лекция 18 биохимия крови. Белки крови. Буферные системы крови. Кислотноосновное равновесие
 Скачать 1.1 Mb. Скачать 1.1 Mb.
|
|
Лекция №18 БИОХИМИЯ КРОВИ. БЕЛКИ КРОВИ. БУФЕРНЫЕ СИСТЕМЫ КРОВИ. КИСЛОТНО-ОСНОВНОЕ РАВНОВЕСИЕ. ► Кровь – жидкая ткань, осуществляющая в организме множество функций. Кровь выполняет целый ряд разнообразных функций: транспортную, дыхательную, трофическую, экскреторную, терморегуляторную, поддержание постоянства внутренней среды, обеспечение водно-солевого обмена, защитную, обеспечивает гуморальную регуляцию. Важный физико-химический показатель – осмотическое давление плазмы крови, определяющееся осмотической концентрацией, т.е. суммой всех частиц, находящихся в единице объема. Кровь обладает значительной вязкостью благодаря высокому содержанию белка и эритроцитов. Вязкость крови в 4–5 раз выше вязкости воды. Химический состав крови в норме относительно постоянен. Это объясняется наличием в организме мощных регулирующих механизмов (ЦНС, гормональная система и др.), обеспечивающих взаимосвязь в работе таких важных для жизнедеятельности органов и тканей, как печень, почки, легкие и сердечно-сосудистая система (таблица).
Все случайные колебания в составе крови в здоровом организме быстро выравниваются. Выполнение большинства функций обусловлено белками крови. Белки плазмы крови. ► Белки являются важной составной частью крови и выполняют следующие функции: Поддержание онкотического давления и тем самым сохранение объема циркулирующей крови Обеспечивают вязкость крови. Белки принимают участие в свертывании крови. Ряд белков, в том числе фибриноген, являются компонентами свертывающей системы крови. Поддержание постоянства рН крови, так как белки плазмы составляют мощную буферную систему, обладая амфотерными свойствами. Транспортная функция. Белки плазмы крови соединяются с целым рядом нерастворимых в воде веществ (липиды, билирубин, жирные кислоты, стероидные гормоны, жирорастворимые витамины) и переносят их в ткани и органы. Белки плазмы крови играют важную роль в иммунных реакциях организма. Сывороточные иммуноглобулины входят в состав фракции глобулинов сыворотки крови. Поддержание уровней катионов в крови путем образования с ними недиализируемых соединений. Например, 40-50% кальция, значительная часть железа, магния, меди и других элементов связана с белками сыворотки. Сывороточные белки образуют своеобразный «белковый резерв» организма. При голодании они могут распадаться до аминокислот, которые используются для синтеза белков головного мозга, миокарда и других органов. Также важным белком крови является гемоглобин – транспортный белок, упакованный в эритроцитах. ► ГЕМОГЛОБИН Белки – динамичные молекулы, их функции почти всегда связаны с взаимодействиями с другими молекулами (молекула обратимо связываемая белком называется лигандом). Эти взаимодействия регулируются тонкими молекулярными механизмами изменения конформации белка. Срочность взаимодействия позволяет организму быстро и обратимо реагировать на изменение внешних условий и метаболических процессов. Лиганд связывается с центром связывания (соответствуют друг другу по форме, размеру, заряду, гидрофильности-гидрофобности). Структурные перестройки, которыми сопровождается взаимодействие белка с лигандом, называют индуцированным соответствием. Гемоглобин – классический пример белка связывающего лиганд (кислород). Гемоглобин можно рассматривать как модельный белок для изучения механизмов связывания с лигандами. Для связывания молекулы кислорода не подходят боковые цепи ни одной аминокислоты. Связывание молекулы кислорода происходит с металлами. Для этого отлично подходят переходные металлы – железо и медь. 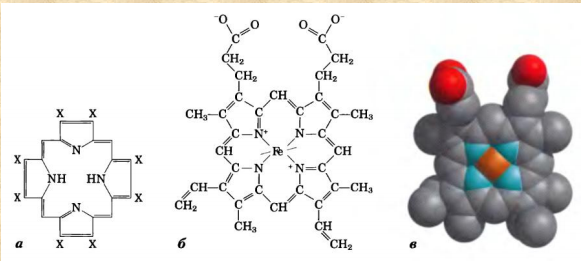 а) структура протопорфирина IX б) гем гемоглобина в) модель гема Железо часто встроено в связанную с белком простетическую группу гем. Гем – это сложная циклическая структура, называемая протопорфирином, с которой связан ион железа (2+). Атом железа имеет шесть координационных связей: четыре связи с атомами азота, две направлены перпендикулярно плоскости порфиринового кольца. Связи препятствуют переходу железа в более окисленную форму (3+), в которой оно будет не способно связывать кислород. При связывании кислорода свойства гемового железа изменяются. Это служит причиной изменения темно-красной окраски венозной крови на светло-красную окраску богатой кислородом артериальной крови. Молекула СО (угарного газа) и молекула монооксида азота (NO) имеют более высокое сродство к гемовому железу, чем молекулы кислорода. При связывании СО с гемом происходит высвобождение кислорода, поэтому угарный газ высоко токсичен для аэробных организмов. Синтез гема. Синтез гемма происходит в клетках печени, почек, слизистой кишечника и др. тканей, но в основном в предшественниках эритроцитов. Первую реакцию катализирует фермент – δ-аминолевулинатсинтазы. Реакция эта протекает в митохондриях. 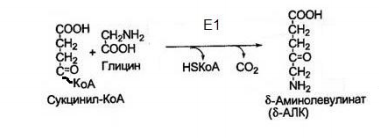 Е1 – аминолевулинатсинтаза (кофермент – пиридоксальфосфат) Вторая реакция происходит при участии порфобилиногенсинтазы (аминолевулинатдегидратазы), она протекает в цитозоле. 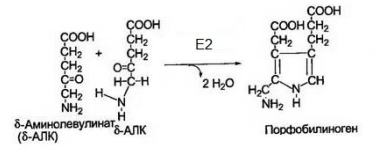 Е2 – аминолелевулинатдегидратаза (требуется цинк) В результате образуется циклический порфобилиноген (монопиррол). На следующем этапе четыре молекулы порфобилиногена конденсируются с образованием промежуточного продукта, с дальнейшим его превращением в уропорфириногены типа I и типа III при участии фермента уропорфириноген-I-синтаза, и дополнительно уропорфириноген-III-косинтазы. Образовавшиеся уропорфириногены могут окисляться до уропорфирина или декарбоксилироваться до копропорфириногена соответствующего типа. Следующим этапом является возвращение копропорфириногена III в митохондрии, где окисляется в протопорфириноген IX и далее в протопорфирин IX, который связывается с железом и образует гем при участии фермента гемсинтазы (феррохелатазы). Далее гем связывается с глобиновыми цепями. Сам же гем оказывает влияние на образование глобиновых цепей – он его ускоряет. 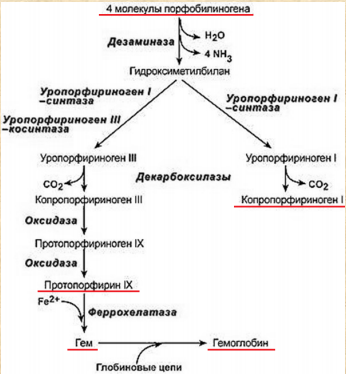 Регуляция синтеза гема: Главный регуляторный фермент – аминолевулинатсинтаза. Гем является отрицательным аллостерическим регулятором данного фермента, действует на уровне транскрипции, взаимодействует с молекулой особого белка-репрессора, образуя активный репрессорный комплекс, связывающийся с ДНК и останавливающий транскрипцию, в результате чего не образуется мРНК данного фермента, фермент не образуется. Достаточное количество ионов железа обладает положительным регуляторным эффектом на синтез данного фермента. мРНК фермента имеет железочувствительный участок IRE. К этому участку высоким сродством обладает особый железосвязывающий белок. Данный белок в отсутствие ионов железа проявляет специфичность к этому участку мРНК и связывается с ним, что блокирует трансляцию мРНК, фермент не образуется. Если же в клетке достаточное количество железа, то ионы железа будут связываться с железосвязывающим белком, инактивируя его, что будет инициировать синтез фермента. Гипоксия к клетках эритропоэтических тканей стимулирует синтез фермента аминолевулинатсинтазы. Активация системы микросомального окисления приводит к увеличению потребления гема для образования цитохрома Р450, внутриклеточная концентрация гема при этом снижается, что и активирует фермент (усиливает синтез фермента), участвующий в его синтезе. Гемоглобин имеет молекулярную массу 64500 и представляет собой практически сферическую молекулу с диаметром около 5,5 нм. Это тетрамерный белок, содержит четыре простетические гемовые группы, каждая из которых соединена с одной полипептидной цепью. Гемоглобин взрослого человека состоит из глобинов двух типов – двух α-цепей (каждая содержит 141 аминокислотный остаток) и двух β-цепей (по 146 аминокислотных остатков). Хотя аминокислотные последовательности α- и β-субъединиц совпадают менее чем на 50%, трехмерные структуры этих двух типов субъединиц очень похожи. Гемсвязывающий карман сформирован в каждой субъединице главным образом спиралями E и F. Четвертичная структура гемоглобина характеризуется сильным взаимодействием между субъединицами разных типов. Даже при обработке распадается с сохранением димерных пар. В контакте между ними задействовано по 19 остатков. Преобладают в основном гидрофобные взаимодействия, а также водородные связи и ионные взаимодействия. Для гемоглобина характерно два конформационных состояния R- и Т. Наибольшим сродством кислород обладает к гемоглобину в R-конформации (релаксированная). В отсутствие кислорода гемоглобин находится в Т-конформации (напряженной, с большим количеством ионных взаимодействий) – дезоксигемоглобин. 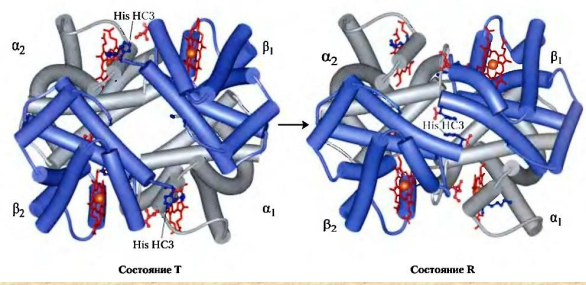 При переходе Т-конформации в R-конформацию происходит скольжение αβ-субъединиц одной по другой, поворот так, что расстояние между β-субъединицами уменьшается, разрушаются некоторые ионные взаимодействия, могут образовываться новые. Важным этапом перехода является изменение положения боковых цепей ключевых аминокислотных остатков, окружающих гем. Изменение конформации сопряжено с некоторым сжатием порфиринового кольца, а присоединение кислорода делает его более плоским. 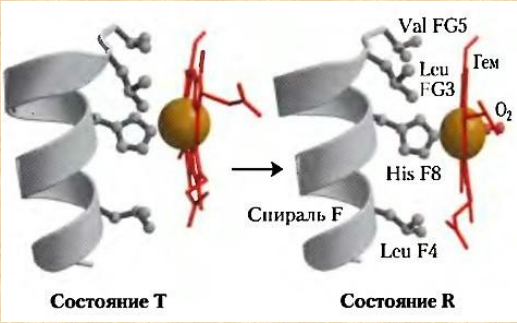 Регуляция 2,3-бисфосфоглицератом. Взаимодействие 2,3-бисфосфоглицерата (БФГ) с гемоглобином – пример гетеротропной аллостерической регуляции. БФГ в довольно высокой концентрации содержится в эритроцитах. Гемоглобин может быть связан с БФГ. А БФГ значительно снижает сродство гемоглобина к кислороду, он связывается с молекулой гемоглобина на некотором расстоянии от центра связывания кислорода и регулирует сродство гемоглобина к кислороду в зависимости от парциального давления кислорода в легких. БФГ играет важную физиологическую роль при адаптации человека к пониженному уровню концентрации кислорода на больших высотах. 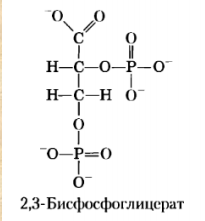 Центр связывания БФГ расположен в полости между β-субъединицами гемоглобина в состоянии Т, там расположены положительно заряженные группы аминокислотных остатков, которые взаимодействуют с отрицательно заряженными группами БФГ. Каждый тетрамер гемоглобина может связывать лишь одну молекулу БФГ. При связывании с гемоглобином БФГ стабилизирует состояние Т и тем самым снижает сродство гемоглобина к кислороду. Переход в состояние R сужает полость, в которой связывается БФГ, и мешает связыванию. В отсутствие БФГ гемоглобин легче переходит в состояние R. БФГ также играет важную роль в регуляции связывания кислорода с гемоглобином при развитии плода. Плод должен экстрагировать кислород из крови матери, поэтому гемоглобин плода должен иметь более высокое сродство к кислороду, чем гемоглобин матери. Гемоглобин плода содержит не β-, а γ-субъединицы, и представляет собой тетрамер состава α2γ2. Этот тетрамер гораздо слабее связывает БФГ, чем гемоглобин взрослого, и, следовательно, имеет более высокое сродство к кислороду. А  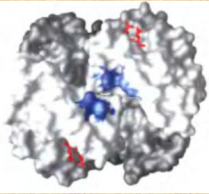 Б БА) Связывание БФГ в полости молекулы в Т-конформации. Б) Связывание кислорода с Rконформацией приводит к закрытию полости в молекуле. ► БЕЛКИ ПЛАЗМЫ КРОВИ Главным органом, реагирующим на повреждение тканей с помощью производимых в нем на экспорт продуктов, является печень. Белки плазмы обычно делят на альбумины, глобулины и фибриноген. Из 9-10% сухого остатка плазмы крови на долю белков приходится примерно 7,4%. Концентрация белков в плазме крови составляет 63-85г/л. Из них на долю альбуминов приходится 57%, a1-глобулинов - 5%, a2 - глобулинов - 9%, b-глобулинов - 13%, g-глобулинов - 16%. 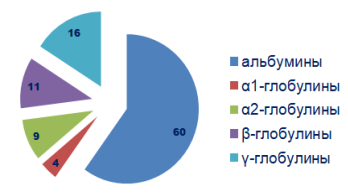 |
