10. Биохимия крови. Лекция 18 биохимия крови. Белки крови. Буферные системы крови. Кислотноосновное равновесие
 Скачать 1.1 Mb. Скачать 1.1 Mb.
|
|
Общий белок. Суммарная концентрация белков, находящихся в сыворотке крови, определяется понятием «общий белок» - суммарная концентрация альбумина и глобулинов, находящихся в сыворотке крови. Протеинограммы. Разделение на фракции основано на разной подвижности белков в разделяющей среде под действием электрического поля. Обычно методом электрофореза выделяют 5-6 стандартных фракций: 1 – альбумины и 4-5 фракций глобулинов (альфа1-, альфа2-, бета- и гамма-глобулины, иногда отдельно выделяют фракции бета-1 и бета-2 глобулинов). 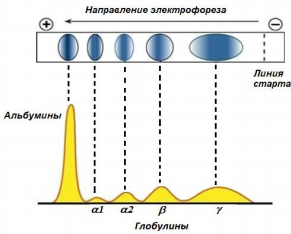 ► Альбумины. – самые легкие белки плазмы крови (Мол. масса 70000). Образуются в гепатоцитах печени. Относятся к простым белкам. Достаточно высоко гидрофильны. Функции: играют важную роль в поддержании коллоидно-осмотического давления крови (на 3/4 оно создается альбуминами); транспортируют многие вещества, в том числе билирубин, катионы металлов и красок, НЭЖК, холестерин и др.; служат богатым и быстро реализуемым резервом аминокислот. Снижение содержания альбуминов в плазме крови приводит к гипопротеинемии. Снижение концентрации альбуминов до 30 г/л вызывает отеки! Электрофорез белков сыворотки крови. Содержание и функции некоторых белков плазмы крови
► Глобулины. Подразделяются на фракции. a- и b-глобулины вырабатываются в ретикулоэндотелиальной системе, в том числе купферовскими клетками печени. α-глобулины состоят из глико- и липопротеидов. Они имеют самую высокую электрофоретическую подвижность. Подразделяются на фракции. Функции: транспорт различных веществ. Относительное содержание a-глобулинов обычно увеличивается при острых инфекционных или воспалительных заболеваниях, связанных с раздражением ретикулоэндотелиальной системы (РЭС). Фракция альфа-1-глобулинов включает в себя белки острой фазы альфа-1-антитрипсин (ингибитор многих протеолитических ферментов – трипсина, химотрипсина, плазмина и т.д.), а также альфа-кислый гликопротеин (орозомукоид); альфа-1-липопротеины (функция – участие в транспорте липидов), протромбин и транспортные белки: тироксинсвязывающий глобулин, транкортин (функции – связывание и транспорт кортизола и тироксина соответственно). Фракция альфа-2-глобулинов преимущественно включает белки острой фазы – альфа-2-макроглобулин (участвует в развитии инфекционных и воспалительных реакций), гаптоглобин, церулоплазмин, а также аполипопротеин В. b-глобулины состоят из глико-, липо- и металлопротеидов. Они выполняют транспортную и другие функции. Фракция бета-глобулинов содержит трансферрин (белок-переносчик железа), гемопексин (связывает гем, что предотвращает его выведение почками и потерю железа), компоненты комплемента (участвующие в реакциях иммунитета), бета-липопротеины (участвуют в транспорте холестерина и фосфолипидов). g-глобулины представлены разнообразными белками с самой низкой электрофоретической подвижностью. К этой группе относятся большинство защитных веществ крови, многие из которых обладают ферментативной активностью. g-глобулины синтезируются плазматическими клетками. Фракция гамма-глобулинов состоит из иммуноглобулинов, (в порядке количественного убывания - IgG, IgA, IgM, IgE), функционально представляющих собой антитела, обеспечивающие гуморальный иммунитет. Электрофорез белков сыворотки крови. Содержание и функции некоторых белков плазмы крови
► Транспортные белки плазмы крови. Трансферрин является b-глобулином. Может взаимодействовать с Сu2+ и Zn2+ , но главным образом связывает и переносит Fe3+ в различные ткани (особенно в ткани РЭС). Участвует, таким образом, в регуляции концентрации свободного железа в плазме, предотвращая избыточное накопление железа в тканях и потерю его с мочой. Гаптоглобин является a-2-глобулином. Функции: связывает гемоглобин в соотношении 1:1, в результате образуются высокомолекулярные комплексы, которые не могут выводиться почками. Это, с одной стороны, предотвращает потерю железа с мочой, с другой – защищает почки от повреждения гемоглобином. Комплекс "гемоглобин-гаптоглобин” захватывается клетками РЭС, где гемоглобин освобождается и подвергается метаболизму с образованием желчных пигментов, железа и аминокислот; транспортирует витамин В12; выполняет неспецифическую защитную функцию, образуя комплексы с различными белками и небелковыми веществами, появляющимися при распаде клеток; является естественным ингибитором катепсина В. Церулоплазмин является a-2-глобулином. Функции: является переносчиком и регулятором концентрации ионов меди в организме, особенно в печени. При его недостатке концентрация меди возрастает и она откладывается в органах, в частности, в печени и гипоталамических ядрах мозга, что вызывает неврологические расстройства (подергивание, тремор, потеря ориентации). Недостаток церулоплазмина вызывает болезнь Коновалова-Вильсона. Такое же состояние возникает и при потере способности церулоплазмина связывать медь; является оксидазой аскорбиновой кислоты, адреналина, диоксифенилаланина (ДОФА); является антиоксидантом (инактивирует свободные радикалы); обладает ферроксидазной и полиаминоксидазной активностями. ► Белки острой фазы. Это группа белков плазмы, содержание которых увеличивается в ответ на повреждение ткани, воспаление, опухолевый процесс. Эти белки синтезируются в печени и являются гликопротеинами. Количественный анализ показал, что подъем концентрации «реактантов острой фазы» на ранней стадии воспаления соответствует снижению концентрации альбумина. Если количество «реактантов» острой фазы увеличивается, повышается и онкотическое давление плазмы, что приводит к снижению синтеза и количества альбумина в сыворотке в пропорциональных соотношениях. Это функционально различные белки отличающиеся по своим антигенным свойствам. К ним относятся белки, представляющие различные функциональные системы: Белки с иммуномодулирующими свойствами – С-реактивный белок (СРБ), α1-гликопротеин (орозомукоид). Ингибиторы протеаз (α1-антитрипсин, антихимотрипсин и др.). Белки свертывания крови (фибриноген, фактор VIII). Белки комплемента (С3, С4). Транспортные белки (гаптоглобин, ферритин, церулоплазмин). ► С-реактивный белок. СРБ является главным реактантом острой фазы. Отсутствует в сыворотке здорового человека, но обнаруживается при патологических состояниях, сопровождающихся некрозом (острая фаза ревматизма, инфаркт миокарда и др.). Синтезируется гепатоцитами. СРБ принадлежит к эволюционно древнему, жизненно важному семейству белков, названному пентраксинами. СРБ состоит из 5 одинаковых субъединиц, нековалентно связанных между собой. Молекулярная масса каждой субъединицы 21-23 кДа. В молекуле СРБ есть специфический участок, в котором находится центр связывания с ионами кальция. В присутствии кальция СРБ связывается с лигандами (например, с фосфохолином – гидрофобным компонентом клеточных мембран). Другой участок в молекуле СРБ отвечает за связывание рецепторов и С1 компонента комплемента. Таким образом, одним своим участком СРБ «опознает врагов» - широкий спектр чужеродных агентов, а другим – привлекает к ним средства для их уничтожения. В целом, СРБ имеет много свойств, характерных для иммуноглобулинов: он связывается с бактериальными полисахаридами и гликолипидами, с поврежденными мембранами, с частицами некротизированной ткани, с экспонированными ядерными антигенами. Это приводит в активации каскада комплемента. СРБ повышает фагоцитоз определенных антигенов и микроорганизмов. В условиях нормы содержится в количестве, составляющем менее 0,01 г/л в плазме, мигрирует при электрофорезе с β-глобулинами. Концентрация С-реактивного белка во время воспаления быстро увеличивается в 20 и более раз, достигая максимума через 50 часов. Выше уровень СРБ – выше тяжесть воспалительного процесса. СРБ – самый чувствительный и самый быстрый индикатор повреждения тканей при воспалении, некрозе, травме. Иногда мониторинг СРБ применяют для выбора наиболее эффективного антимикробного средства. ► Нарушение белковых фракций плазмы крови. Гипоальбуминемия. Причинами гипоальбуминемии могут быть: снижение биосинтеза альбуминов из-за белкового голодания; нарушения переваривания и всасывания белков в ЖКТ; локального повреждения печени (повреждения гепатоцитов); потеря белка из кровяного русла из-за патологии почек; увеличения проницаемости сосудов; через ЖКТ; увеличение распада белков из-за активации катепсинов. Гиперпротеинемия связана преимущественно с глобулинами. Уровень g-глобулинов увеличивается при хронических заболеваниях. Существуют заболевания, при которых имеется недостаток g-глобулинов. Это состояние называется агаммаглобулинемия. Может быть и врожденной. Диспротеинемия – это такое состояние, когда изменяется процентное соотношение отдельных белковых фракций, а общее содержание белка при этом не изменяется. Парапротеинемия – это состояние, когда в сыворотке крови появляются патологические белки. Она связана с инфекционным или токсическим раздражением ретикулоэндотелиальной системы. Для диагностики заболеваний внутренних органов большое значение имеет комплексная оценка изменений всех выявляемых белковых фракций!   Снижение альбумина, увеличение γ-глобулинов Снижение альбумина, увеличение β- и γ-глобулинов, снижение α2- глобулинов Резкое снижение всех фракций при значительном увеличении α2-глобулинов Норма: альбумины 60% α1-Глобулины 4% α2-Глобулины 9% β-Глобулины 11% γ-Глобулины 16% 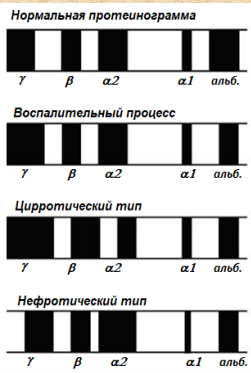 ► БУФЕРНЫЕ СИСТЕМЫ КРОВИ. КИСЛОТНО-ОСНОВНОЕ РАВНОВЕСИЕ. Измерение рН является одной из наиболее важных и часто используемых в биохимии процедур, поскольку от рН зависит структура и действие многих биологических макромолекул, в частности каталитическая активность ферментов. Измерения рН крови и мочи – это рутинные процедуры, постоянно используемые в медицинской диагностике. Например, у людей страдающих тяжелой формой диабета, значение рН крови часто снижено по сравнению с нормальным значением 7,4. Такое состояние носит название ацидоза. При некоторых других заболеваниях рН крови может быть выше нормы; такое заболевание называется алкалозом. Случаи сильного ацидоза или алкалоза могут быть опасны для жизни. В крови колебания концентрации водородных ионов очень невелики, в пределах 7,36‑7,48; пределы отклонения pH от нормы, совместимые с жизнью, от 7,0 при ацидозе и до 7,8 при алкалозе. Кислотно-основное равновесие – относительное постоянство реакции внутренней среды организма, количественно характеризующееся или концентрацией водородных ионов (протонов), выраженной в молях на 1 л, или водородным показателем – отрицательным десятичным логарифмом этой концентрации – рН (power hydrogen – сила водорода). Почти каждый биологический процесс от рН; даже незначительные изменения рН могут вызвать сильные изменения скоростей процессов. Ферменты, катализирующие реакции, протекающие в организме, содержат ионизируемые группы и характеризуются определенным значением рКа. Их состояние зависит от рН среды. Если ионизируемая группа спрятана вглубь белка, а не экспонирована на его поверхности, окруженной водным раствором, то кажущееся значение рКа может сильно отличаться от рКа в воде. рН как в клетках так и во внеклеточных жидкостях строго регулируется с помощью буферных систем – смесей слабых кислот и сопряженных оснований. Эти системы способны препятствовать изменению рН при добавлении небольших количеств кислоты (Н+) или основания (ОН-). Легкие и почки также задействованы в поддержании постоянства рН внутренней среды организма (легочная вентиляция (удаление Н2СО3), выделительная функция почек (удаление кислых фосфатов и солей аммония), кожи, пищеварительного тракта и печени Минеральные компоненты скелета регулируют кислотно‑щелочное равновесие путем обмена Н+ крови на ионы Сa2+ и Na+ костной ткани. Буферные системы крови ликвидируют сдвиг pH в течение 30 сек, легким необходимо 1-3 мин, а почкам — 10-20 часов.) |
