10. Биохимия крови. Лекция 18 биохимия крови. Белки крови. Буферные системы крови. Кислотноосновное равновесие
 Скачать 1.1 Mb. Скачать 1.1 Mb.
|
|
Буферная система состоит из слабой кислоты (донора протона) и сопряженного с ней основания (акцептора протона). Примером буферной системы может служить смесь равных концентраций уксусной кислоты и ацетата, которая образуется в средней точке кривой титрования. Кривая титрования уксусной кислоты имеет относительно прямой участок, распространяющийся приблизительно на одну единицу рН в каждую сторону от средней точки, соответствующей рН 4,76.  Кривая титрования уксусной кислоты. В рамках указаны преобладающие ионные формы уксусной кислоты при соответствующих значениях рН. Зона, выделенная голубым цветом, соответствует буферной зоне системы (когда ионизовано от 10 до 90% титруемой уксусной кислоты). 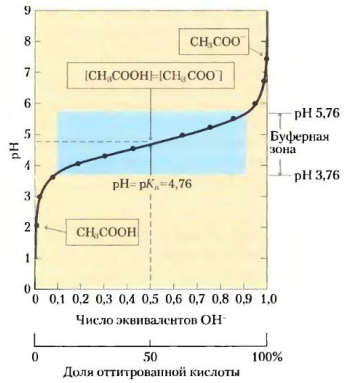 При увеличении концентрации ионов Н+ или ОН- в этой области происходит лишь слабое изменение рН, которое намного меньше, чем изменения, возникающие при добавлении такого же количества этих ионов за пределами данного участка. Этот относительно плоский участок кривой соответствует буферной зоне сопряженной кислотной-основной пары уксусная кислота / ацетат. В средней точке буферной зоны, где концентрация донора протона (уксусной кислоты) точно равна концентрации сопряженного основания (ацетата), буферная емкость системы максимальна. Это означает, что увеличение концентрации ионов Н+ или ОН- в этой области вызывает минимальные изменения рН. Значение рН в средней точке кривой титрования точно равно значению рКа титруемой кислоты. При добавлении небольших количеств ионов Н+ или ОН- в ацетатный буфер его рН несколько изменяется, но эти изменения несоизмеримо слабее тех, которые наблюдаются при добавлении тех же количеств ионов в чистую воду или в раствор соли сильного основания и сильной кислоты (например, NaCl), не обладающей буферной емкостью.  Сравнение кривых титрования трех слабых кислот: СН3СООН, Н2РО4 - и NH4 +. В рамках указаны преобладающие ионные формы этих соединений при соответствующих значениях рН. Справа указаны соответствующие буферные зоны. 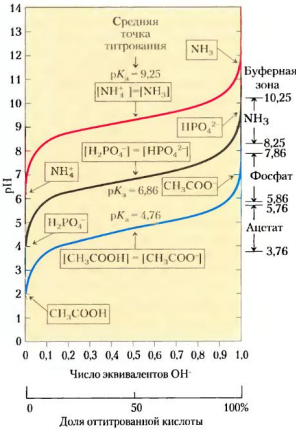 Буферная емкость – результат равновесия двух обратимых реакций, протекающих в растворе, содержащем приблизительно равные концентрации донора протонов и сопряженного с ним акцептора. Уменьшение концентрации одного из компонентов буферной системы точно уравновешивается повышением концентрации другого компонента. Сумма компонентов при этом не меняется, меняется лишь их соотношение. Для каждой сопряженной кислотно-основной пары характерна своя область рН, где она является эффективным буфером. Пара Н2РО4-/ НРО42- имеет рКа=6,86 и поэтому проявляет свойства буфера в диапазоне рН от 5,9 до 7,9; пара NH4+/ NH3 с рКа=9,25 может служить буфером в области рН от 8,3 до 10,3. Кривые титрования отражают некую общую закономерность. Форма кривой титрования любой кислоты описывается уравнением Хендерсона-Хассельбаха, анализ которого помогает понять буферные свойства и кислотно-основной баланс в крови и тканях позвоночных животных. Уравнение Х.-Х. для диссоциации слабой кислоты НА с образованием ионов Н+ и ОН- выглядит следующим образом: 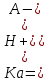 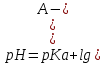 рКа слабой кислоты численно равно значению рН в средней точке на кривой титрования. В данной точке [НА] = [А-]. Уравнение Х.-Х. позволяет: А) рассчитать рКа при заданном значении рН и молярном соотношении донора и акцептора протонов; Б) рассчитать рН, зная рКа и молярное соотношение донора и акцептора протонов; В) рассчитать молярное соотношение донора и акцептора протонов, если известны рН и рКа. Наиболее мощные буферные системы крови: Белки плазмы играют роль буфера благодаря своим амфотерным свойствам. В кислой среде подавляется диссоциация СООН‑групп, а группы NH2 связывают избыток Н+, при этом белок заряжается положительно. В щелочной среде усиливается диссоциация карбоксильных групп, образующиеся Н+ связывают избыток ОН–-ионов и pH сохраняется, белки выступают как кислоты и заряжаются отрицательно. Все зависит от аминокислотного состава белков. Т.к. альфа-карбоксильная и альфа-аминогруппа в белке оказываются связанными пептидной связью, но главную роль в выполнении белками функций буферов играют группы радикалов аминокислот. Так рКа имидазольного кольца в боковой цепи гистидина составляет 6,0; таким, образом, белки, содержащие остатки гистидина, являются эффективными буферами в области нейтральных значений рН, а боковая цепь гистидина в этой области значений рН может существовать как в протонированной, так и в непротонированной форме. Гемоглобиновая буферная система обладает наибольшей мощностью. Эта буферная система состоит из свободного гемоглобина (Hb), восстановленного гемоглобина (H‑Hb), калиевой соли гемоглобина (K‑Hb), карбгемоглобина (Н‑НbСО2) и оксигемоглобина (К‑НbО2). На него приходится до 3/4 всей буферной емкости крови. Изменения кислотности гемоглобина в тканях и в легких при связывании соответственно H+ или О2 обусловлены конформационными перестройками глобиновой части молекулы. В основе буферных свойств гемоглобина лежит следующая особенность: восстановленный гемоглобин является более слабой, а оксигемоглобин более сильной кислотой по сравнению с угольной. Иными словами, когда в среде накапливается угольная кислота, то ее протон присоединяется к свободному гемоглобину и образуется восстановленный. При удалении Н2СО3 (капилляры легких) протон в среду поступает от оксигемоглобина. Процессы, происходящие в тканях. Выделяемый при клеточном дыхании CO2 в обратимой реакции под действием карбангидразы эритроцитов превращается в угольную кислоту, диссоциирует на H+ и HCO3– и смещает pH крови в тканевых капиллярах в кислую сторону: H2O + CO2 ↔ H2CO3 ↔ HCO3- + H+ Увеличение концентрации протонов водорода способствует отщеплению О2 от оксигемоглобина (К‑НbО2) и образуется калиевая соль гемоглобина. Параллельно кислые соединения взаимодействуют с калиевой солью гемоглобина (K‑Hb). При этом образуется соответствующая калийная соль кислоты и свободный гемоглобин. Свободный гемоглобин, обладая щелочными свойствами, связывает протоны водорода и образуется восстановленный гемоглобин, который впоследствии превращается в карбгемоглобин (H‑HbCO2). Таким образом, при диссоциации оксигемоглобина происходит увеличение количества оснований, они присоединяют ионы Н+, и это препятствует закислению крови. Процессы, происходящие в легочных капиллярах. Переход углекислого газа из крови в альвеолярный воздух ведет к снижению напряжения СО2 в плазме. Происходит отщепление СО2 от карбгемоглобина с образованием Н-Нb, присоединение кислорода, создание Н‑НbО2 и его диссоциация на Н+ и НbО2. Далее ион Н+ используется для синтеза угольной кислоты и ликвидирует защелачивание крови, а НbО2 присоединяет ион К+. Параллельно снижение напряжения СО2 в плазме смещает равновесие карбангидразной реакции в сторону образования СО2 и Н2О из угольной кислоты, которая синтезируется из КHCO3 и H+. Следовательно, бикарбонат-ионы и протоны водорода из среды исчезают. Таким образом, образование оксигемоглобина увеличивает степень диссоциации кислотных групп его белковой части, высвобождающиеся ионы водорода нейтрализуют HCO3– с образованием угольной кислоты и выделением СО2. Вместе с этим, диссоциация протона от оксигемоглобина препятствует защелачиванию крови. Бикарбонатный буфер. При поступлении в кровь более сильной кислоты, чем угольная, ионы бикарбоната натрия взаимодействуют с ней, происходит реакция обмена и образуется соответствующая соль и угольная кислота. Угольная кислота является очень слабой кислотой, следовательно, концентрация водородных ионов понижается. Вместе с тем, благодаря присутствию в эритроцитах фермента карбангидразы, она быстро расщепляется с образованием CO2, удаляемого с выдыхаемым воздухом, и H2O. Кроме эритроцитов, значительная активность карбангидразы отмечена в почках и печени. В случае поступления щелочных веществ они реагируют с угольной кислотой и образуют бикарбонаты. Возникающий при этом дефицит угольной кислоты немедленно компенсируется уменьшением выделения CO2 легкими. Состояние бикарбонатного буфера оценивается, исходя из уравнения реакции: H2O + CO2 ↔ H2CO3 ↔ HCO3 + H+ Углекислота находится в равновесии с растворенной в крови диокисью углерода и ионами, на которые она диссоциирует, при этом количество H2CO3 в двадцать раз меньше количества иона HCO3–. В клинике показателем реакции служат: стандартные бикарбонаты (СБ) — концентрация HCO3– в плазме при стандартных условиях: полное насыщение кислородом крови, уравновешенной при 38°С с газовой смесью, в которой pCO2 равно 40 мм рт.ст. актуальные бикарбонаты (АБ) — концентрация HCO3– в крови при 38°С и реальных значениях pH и pCO2. CO2— связывающая способность крови — отражает концентрацию бикарбонатов в плазме. Определяется газометрически и в настоящее время в связи с развитием электрохимических методов не используется. щелочной запас — отражает концентрацию щелочных соединений в цельной крови, определяется титрометрически, относится к устаревшим методам. парциальное давление углекислого газа (pCO2) — давление СО2 в газе, находящемся в равновесии с плазмой артериальной крови при температуре 38°С. Отражает концентрацию углекислоты в крови, зависящей от вентиляции легких и диффузии СО2 в воздух альвеол. Изменяется при нарушении дыхания и доставке углекислоты к легким. Величина парциального давления зависит от суммы концентраций в крови CO2 и H2CO3 согласно уравнению: [CO2 + H2CO3] = a × pСО2, где a — коэффициент абсорбции Бунзена, a=0,0301 Фосфатная буферная система образована дигидрофосфатом (NaH2PO4) и гидрофосфатом (Na2HPO4) натрия. Первое соединение слабо диссоциирует и ведет себя как слабая кислота, второе обладает щелочными свойствами. При взаимодействии ионов водорода (в том числе и угольной кислоты) с двузамещенным фосфатом натрия (Na2HPO4) образуется нейтральная соль и NaH2PO4. Таким образом, благодаря связыванию введенной в систему кислоты, концентрация ионов водорода значительно понижается. При поступлении в кровь оснований избыток ОН–‑групп нейтрализуется кислотными Н+, а расход ионов Н+ восполняется повышением диссоциации NaH2PO4. Основное значение фосфатный буфер имеет для регуляции pH интерстициальной жидкости и мочи. В моче роль его состоит в сбережении бикарбоната натрия, а также бикарбонатов других катионов — калия, магния, кальция, за счет дополнительного иона водорода (по сравнению с NaHCO3) в составе выводимого NaH2PO4: Na2HPO4 + H2CO3 ↔ NaH2PO4 + NaHCO3 Бикарбонат натрия в почечных канальцах реабсорбируется, а реакция мочи зависит только от содержания дигидрофосфата. |
