Занятие 3. Занятие 3 тема взаимодействие белка с лигандом. Связь структуры и функций белков цель Рассмотреть современные представления о функционировании белка. Получить представление о взаимосвязи структурной организацией белков с их биологическими функциями
 Скачать 143.69 Kb. Скачать 143.69 Kb.
|
|
Занятие 3 ТЕМА: ВЗАИМОДЕЙСТВИЕ БЕЛКА С ЛИГАНДОМ. СВЯЗЬ СТРУКТУРЫ И ФУНКЦИЙ БЕЛКОВ Цель: Рассмотреть современные представления о функционировании белка. Получить представление о взаимосвязи структурной организацией белков с их биологическими функциями. 1. Многообразие белков. Классификация белков по: форме молекул, химическому строению, функциям. Благодаря необъятному количеству возможных комбинаций при синтезе белка из 20 аминокислот существует множество разнообразных аминокислотных последовательностей, каждая из которых потенциально соответствует определенному белку. Все эти белки легко сгруппировать по отдельным классам, выделяя определенный признак – функцию или особенности строения. Классификация по функции В соответствии с биологическими функциями выделяют:
Классификация по строению 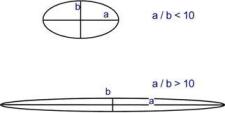 В зависимости от формы молекулы выделяют глобулярные и фибриллярные белки. В глобулярныхбелках соотношение продольной и поперечной осей составляет менее 10 и в большинстве случаев не более 3-4. Эти белки характеризуются компактной трехмерной укладкой полипептидных цепей. Например: инсулин, альбумин, глобулины плазмы крови. Фибриллярные белки имеют соотношение осей более 10. Они состоят из пучков полипептидных цепей, спиралью навитых друг на друга и связанные между собой поперечными ковалентными и водородными связями. Выполняют защитную и структурную функции. Например: кератин, миозин, коллаген. По количеству белковых цепей в одной молекуле выделяют мономерные белки, которые имеют одну субъединицу (протомер) и полимерные белки, имеющие несколько субъединиц. Например, к мономерным белкам относятся альбумины, миоглобин, к полимерным - гемоглобин (4 субъединицы), лактатдегидрогеназа (4 субъединицы), креатинкиназа (2 субъединицы), гексокиназа (2 субъединицы). Субъединицы в белке могут быть как одинакового, так и различного строения. Есть и более крупные белки. К ним относятся РНК-полимераза E.coli – 5 цепей, аспартаткарбамоилтрансфераза – 12 протомеров, глутаминсинтетаза – 12 протомеров, пируватдегидрогеназа – 72 белковых цепи. По химическому составу все белки подразделяют на простые и сложные. Простые белки содержат в структуре только аминокислоты (альбумины, глобулины, гистоны, протамины). Сложные белки, кроме аминокислот, имеют небелковые компоненты:
2. Взаимодействие белков с лигандами как основа их функционирования. Понятие об активном центре белка. Особенности формирования активного центра. Специфичность связывания белка с лигандом. Принцип комплементарности. Две гипотезы соответствия структур активного центра и лиганда (гипотеза «ключ – замок» и гипотеза индуцированного соответствия). Обратимость связывания и сродство активного центра к лиганду. Функционирование белков Каждый индивидуальный белок, имеющий уникальную первичную структуру и конформацию, обладает и уникальной функцией, отличающей его от всех остальных белков. Набор индивидуальных белков выполняет в клетке множество разнообразных и сложных функций. В активном центре условно различают каталитический участок, непосредственно вступающий в химическое взаимодействие с субстратом и участок связывания, который обеспечивает специфическое сродство к субстрату и формирование его комплекса с ферментом. Необходимое условие для функцинирования белков – присоединение к нему другого вещества, которое называют лигандом. Лигандами могут быть как низкомолекулярные вещества, так и макромолекулы. Взаимодействие белка с лигандом высокоспецифично, что определяется строением участка белка, называемого центром связывания белка с лигандом или активным центром. Активный центр белков и избирательность связывания его с лигандом Активный центр белков – определённый участок белковой молекулы, как правило, находящийся в её углублении, сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга. Высокая специфичность связывания белка с лигандом обеспечивается комплементарностью структуры активного центра белка и структуры лиганда. Под комплементарностью понимают пространственное и химическое соответствие взаимодействующих молекул. Лиганд должен обладать способностью входить и пространственно совпадать с конформацией активного центра. Это совпадение может быть неполным, но благодаря конформационной лабильности белка, активный центр способен к небольшим изменениям и «подгоняется» под лиганд. Кроме того, между функциональными группами лиганда и радикалами аминокислот, образующих активный центр, должны возникать связи, удерживающие лиганд в активном центре. Связи между лигандом и активным центром белка могут быть как нековалентными (ионными, водородными, гидрофобными), так и ковалентными. Характеристика активного центра Активный центр белка – относительно изолированный от окружающей белок среды участок, сформированный аминокислотными остатками. В этом участке каждый остаток, благодаря своему индивидуальному размеру и функциональным группам, формирует «рельеф» активного центра. Уникальные свойства активного центра зависят не только от химических свойств формирующих его аминокислот, но и от их точной взаимной ориентации в пространстве. Поэтому даже незначительные нарушения общей конформации белка в результате точечных изменений его первичной структуры или условий окружающей среды могут привести к изменению химических и функциональных свойств радикалов, формирующих активный центр, нарушать связывание белка с лигандом и его функцию. При денатурации активный центр белков разрушается, и происходит утрата их биологической активности. Часто активный центр формируется таким образом, что доступ воды к функциональным группам его радикалов ограничен, т.е. создаются условия для связывания лиганда с радикалами аминокислот. Центр связывания белка с лигандом часто располагается между доменами. Например, протеолитический фермент трипсин, участвующий в гидролизе пептидных связей пищевых белков в кишечнике, имеет 2 домена, разделённых бороздкой. Внутренняя поверхность бороздки формируется аминокислотными радикалами этих доменов, стоящими в полипептидной цепи далеко друг от друга (Сер177, Гис40, Асп85). Разные домены в белке могут перемещаться друг относительно друга при взаимодействии с лигандом, что облегчает дальнейшее функционирование белка. Основное свойство белков, лежащее в основе их функций – избирательность присоединения специфических лигандов к определённым участкам белковой молекулы. Многообразие лигандов: 1. Лигандами могут быть неорганические (часто ионы металлов) и органические вещества, низкомолекулярные и высокомолекулярные вещества; 2. существуют лиганды, которые изменяют свою химическую структуру при присоединении к активному центру белка (изменения субстрата в активном центре фермента); 3. существуют лиганды, присоединяющиеся к белку только в момент функционирования (например, О2, транспортируемый гемоглобином), и лиганды, постоянно связанные с белком, выполняющие вспомогательную роль при функционировании белков (например, железо, входящее в состав гемоглобина). Механизмы специфичностиВ общем виде все сводится к комплементарному взаимодействию фермента и субстрата. При этом функциональные группы субстрата взаимодействуют с соответствующими им функциональными группами фермента. Наличие субстратной специфичности объясняют две гипотезы: 1. Теория Фишера (модель "жесткой матрицы", "ключ-замок") – активный центр фермента строго соответствует конфигурации субстрата и не изменяется при его присоединении. Эта модель хорошо объясняет абсолютную специфичность, но не групповую.  Схематичное представление теории Фишера2. Теория Кошланда (модель "индуцированного соответствия", "рука-перчатка") – подразумевает гибкость активного центра. Присоединение субстрата к якорному участку фермента вызывает изменение конфигурации каталитического центра таким образом, чтобы его форма соответствовала форме субстрата.  3. Доменная организация белков. Понятие о доменах. Особенности пространственной организации и функционирования доменных белков. Эволюционное значение доменной организации. Роль пространственной структуры и доменной организации в функционировании иммуноглобулинов. Доме́н белка́— элемент третичной структурыбелка, представляющий собой достаточно стабильную и независимую подструктуру белка, чейфолдингпроходит независимо от остальных частей. В состав домена обычно входит несколько элементоввторичной структуры. Сходные по структуре домены встречаются не только в родственных белках (например, в гемоглобинах разных животных), но и в совершенно разных белках. Домены могут выполнять разные функции и подвергаться складыванию (свертыванию) в независимые компактные глобулярные структурные единицы, соединенные между собой гибкими участками внутри белковой молекулы.  Домены в одном белке могут быть одинаковыми или различными как по структуре, так и по функции. Часто домен по своей структуре и свойствам сходен с отдельным глобулярным белком. Представлена молекула, в которой два крупных, четко различимых домена.Нередко в белках, различающихся по структуре и функции, встречаются однотипные сочетания а- и (3-структур (структурные мотивы), обозначаемые как супервторичная структура. Представлен домен молекулы фермента пируват-киназы, имеющий супервторичную структуру типа бочонка (она есть и в некоторых других белках). В этом домене 8 а-спиральных участков образуют «бочонок», внутри которого находятся 8 (3-структурных участков. Многие ферменты содержат домен, в центре которого расположены (3-структурные участки в виде скрученного листа, и а-спирали, расположенные по периферии домена. Характерные супервторичные структуры имеются в белках, связывающихся с ДНК. Белковая глобула не является абсолютно жесткой структурой: в известных пределах возможны обратимые перемещения частей пептидной цепи относительно друг друга с разрывом небольшого числа слабых связей и образованием новых. Молекула в растворе как бы пульсирует в разных своих частях. Эти изменения можно рассматривать как тепловое (броуновское) движение отдельных участков пептидной цепи. Они не нарушают основного плана конформации молекулы,подобно тому, как тепловые колебания атомов в кристалле не изменяют структуру кристалла, если температура не настолько велика, что наступает плавление. Небольшие изменения конформации белковых молекул происходят и при взаимодействии их с другими молекулами. Например, конформация гемоглобина с присоединенным к нему кислородом немного отличается от конформации гемоглобина в отсутствие кислорода. Достаточно часто доменам присваивают отдельные названия, так как их присутствие непосредственно влияет на выполняемые белкомбиологической функции, к примеру, Ca2+-связывающий доменкальмодулина,гомеодомен, отвечающий за связывание сДНКв различныхфакторах транскрипции. Разные домены в белке могут перемещаться друг относительно друга при взаимодействии с лигандом, что облегчает дальнейшее функционирование белка. Иммуноглобулины представляют собой сложные гликопротеиновые молекулы с четко выраженной доменной структурой. Доменом в молекулах иммуноглобулинов называют фрагменты молекулы, включащающие примерно 110 аминокислотных остатков и имеющие характерную для этого класса молекул укладку цепи в виде двух слоев с антипараллельной бета-складчатой структурой, один из которых построен из трех, а другой - из четырех сегментов. Различные домены имеют заметную структурную гомологию. Внутридоменный дисульфидный мостик связывает оба слоя. Следует отметить, что антитела были первыми представителями позднее детально изученного семейства белков иммунной системы, названного суперсемейством иммуноглобулинов. Было показано, что бета2-микроглобулин , Т-клеточные рецепторы и многие другие молекулы семейства построены из доменов, имеющих аналогичную структуру. Впервые, в 1969г., еще до получения рентгеноструктурных данных, Дж.Эдельман предположил, что каждый гомологичный участок иммуноглобулинов организован в глобулярную замкнутую сферу - домен - за счет внутрицепьевых дисульфидных связей, образующихся полуцистеиновыми остатками ( рис. 2.5 ). 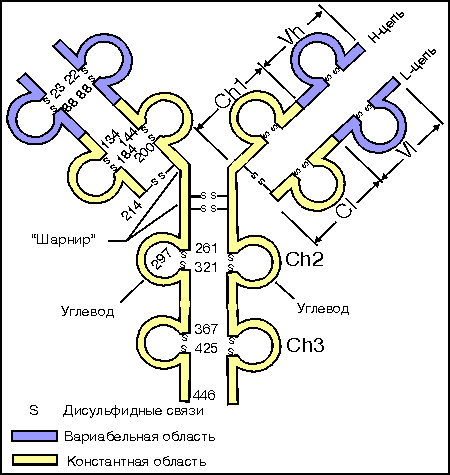 Дисульфидная связь в IgG замыкает в петлю около 60-70 остатков. Приблизительно по 20 аминокислот, не входящих в замкнутую часть домена, служат для соединения с соседними доменами. Легкие цепи образуют по два домена ( VL-домен и CL-домен ), тяжелые - четыре или пять в зависимости от класса Ig (один VH-домен и три или четыре CH-домена , соответственно). Рентгеноструктурный анализ подтвердил общий принцип доменной организации полипептидных цепей иммуноглобулинов и вскрыл ряд тонких деталей строения. На рис.2.6 показано схематическое изображение пространственной организации легкой цепи : VL-домена и CL-домена. Каждый домен состоит из двух слоев с бета-складчатой структурой, один из которых построен из четырех антипараллельных сегментов, а второй - из трех сегментов. Слои ковалентно связаны дисульфидным мостиком примерно в середине домена. 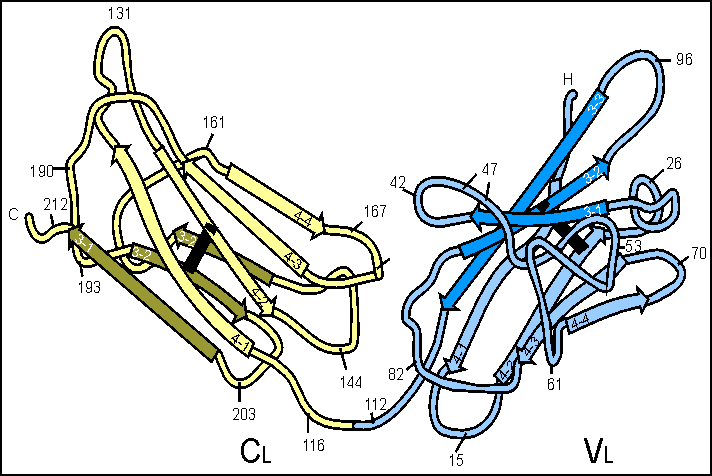 Общая пространственная организация IgG человека представлена на рис. 2.7 . Видно, что тяжелые и легкие цепи, взаимодействуя друг с другом, образуют плотно упакованную структуру с тремя частями: два Fab-фрагмента и один Fc-фрагмент . 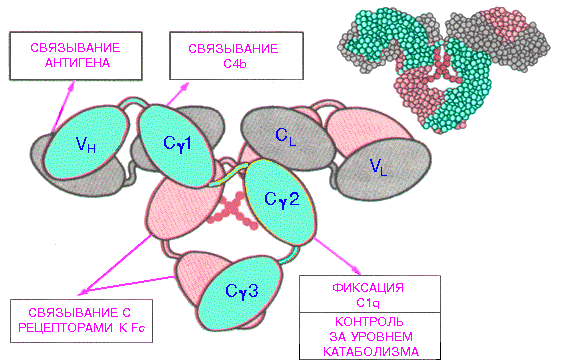 4. Особенности функционирования олигомерных белков. Кооперативность. Эволюционные преимущества олигомерных белков перед мономерными (сравнение гемоглобина и миоглобина). Регуляция функционирования гемоглобина. ОСОБЕННОСТИ СТРОЕНИЯ И ФУНКЦИОНИРОВАНИЯ ОЛИГОМЕРНЫХ БЕЛКОВ 1.Олигомерные белки могут содержать разное количество протомеров (например, димеры, тетра-меры, гексамеры и т. д.). 2. В состав олигомерных белков могут входить одинаковые или разные протомеры, например го-модимеры - белки содержащие 2 одинаковых про томера, гетеродимеры - белки, содержащие 2 раз ных протомера. 3. Различные по структуре протомеры могут свя зывать разные лиганды. 4. Взаимодействие одного протомера со специ фическим лигандом вызывает конформационные изменения всего олигомерного белка и изменяет сродство других протомеров к лигандам. Это явле ние носит название кооперативных изменений конформации протомеров. 5. У олигомерных белков появляется новое по сравнению с одноцепочечными белками свойст во — способность к аллостерической регуляции их функций. Кооперативность — это явление в биохимии, характерное для ферментов или рецепторов, которые имеют множественные сайты связывания. Также явление кооперативности отмечено для больших молекул, имеющих многие идентичные субъединицы (ДНК, белки, фосфолипиды), в момент, когда происходят фазовые переходы — плавление, разворачивание, расплетание. Когда субстрат связывается с активным центром одной субъединицы фермента, остальные субъединицы активируются. Лиганды могут иметь некооперативный, положительный или отрицательный кооперативный эффект. Примером положительной кооперативности может служить связывание кислорода гемоглобином. Отрицательная кооперативность означает противоположное — в момент связывания лиганда белком, аффинность белка к лиганду снижается. Примером может служить взаимодействие между глицеральдегид-3-фосфатом и ферментом глицеральдегид-3-фосфат дегидрогеназой. Молекула миоглобина может присоединять только 1 молекулу кислорода в свой активный центр: Гемоглобин является олигомерным белком и имеет ряд особенностей функционирования, характерных для всех олигомерных белков. Молекула гемоглобина состоит из 4 протомеров и имеет 4 центра связывания О2(активные центры). Гемоглобин может существовать как в свободной (дезоксигемоглобин), так и в оксигенированной форме, присоединяя до 4 молекул кислорода. Взаимодействие с кислородом 1-го протомера вызывает изменение его конформации, а также кооперативные конформационные изменения остальных протомеров (рис. 1.23, А). Сродство к кислороду возрастает, и присоединение О2 к активному центру 2-го протомера происходит легче, вызывая дальнейшую конформационную перестройку всей молекулы. В результате еще сильнее изменяется структура оставшихся протомеров и их активных центров, взаимодействие с О2 еще больше облегчается. В итоге 4-я молекула кислорода присоединяется к Hb примерно в 300 раз легче, чем 1-я (рис. 1.23, Б). Так происходит в легких при высоком парциальном давлении кислорода. В тканях, где содержание кислорода ниже, наоборот, отщепление каждой молекулы О2 облегчает освобождение последующих. 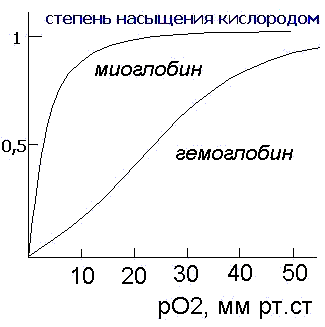 Таким образом, взаимодействие олигомерного белка гемоглобина с лигандом (О2) в одном центре связывания приводит к изменению конформации всей молекулы и других, пространственно удаленных центров, расположенных на других субъединицах (принцип «домино»). Подобные взаимосвязанные изменения структуры белка называют кооперативными конформационными изменениями.Они характерны для всех олигомерных белков и используются для регуляции их активности. Взаимодействие обоих белков (Mb и Hb) с кислородом зависит от его парциального давления в тканях. Эта зависимость имеет разный характер, что связано с их особенностями структуры и функционирования (рис. 1.24). Гемоглобин имеет S-образную кривую насыщения, которая показывает, что субъединицы белка работают кооперативно, и чем больше кислорода они отдают, тем легче идет освобождение остальных молекул О2. Этот процесс зависит от изменения парциального давления кислорода в тканях. количество транспортируемого гемоглобином в ткани кислорода регулируется и повышается при увеличении содержания СО2 и Н+ в крови (например, при интенсивной физической работе); при сдвиге рН крови в щелочную сторону (алкалозе) доставка кислорода в ткани понижается. 5. Вещества, влияющие на функционирование белков. Лиганды, связываясь с белками, способны изменять их конформацию таким образом, что формируются новые активные центры для связи и другими лигандами. Как уже было указано выше, взаимодействие белка с лигандом имеет высокую специфичность. Тем не менее, всегда можно подобрать вещество (природное или синтетическое), которое является структурным аналогом лиганда и может быть комплиментарным активному центру белка. Если это вещество соединится с белком вместо естественного лиганда, функция белка будет заблокирована. Вещество, взаимодействующее с активным центром белка и блокирующее действие белка, называется ингибитором белка или антагонистом. Так молекула угарного газа СО2 сходна с молекулой О2 и ее средство к гемоглобину в 200 раз больше, чем к О2, поэтому даже при низкой концентрации СО2 в воздухе, значительная часть гемоглобина оказывается блокированной угарным газом и не участвует в транспорте О2, что приводит к тяжелому отправлению. Дитилин (лекарственное вещество) является аналогом ацетилхолина, который обеспечивает передачу импульса нерва на мышцу, являясь медиатором синапса. При введении в организм дитилина он связывается с Н-холинорецепторами холинергических синапсов, являясь антагонистом ацетилхолина - нейромедиатора, вызывающего сокращение мыщц. В результате передача блокируется и возникает расслабление мышцы (паралич). Поэтому дитилин применяют как миорелаксант при операциях и эндоскопических обследованиях. Следовательно, структурные аналоги естественных лигандов могут быть и ядами, и лекарственными вещест- вами. Другим лекарственным веществом, выступающим как ингибитор белка, является атропин – алкалоид растительного происхождения, который явяляется также естественным аналогом ацетилхолина, но взаимодействует с М-холинорецепторами мембраны эффекторных клеток. Являясь антагонистом ацетилхолина, он устраняет раздражение парасимпатических нервов, и вместо сокращения гладких мышц, которое стимулируется ацетилхолином, снимает их спазм. Ингибиторами белков являются яды, которые связываются с молекулами белка, ингибируют их и тем самым вызывают нарушение его биологических свойств. Например, яд кобры содержит ά-нейротоксин, который соединяясь с рецепторами постсинап- тических мембран, блокируют их работу, нарушая их функцию (восприятие сигнала). Другая группа лекарственных веществ, будучи структурными аналогами лигандов не являются ингибиторами, а вызывает такие же, но более сильные длительные физиологические эффекты, как природные лиганды. Эта группа называется агонисты. Мезатон, аналог нейромедиаторов симпатической нервной системы норадреналина и адреналина, сильнее и длительнее их повышает тонус сосудов и артериальное давление и используется при гипотонии и коллапсе. Лиганды могут оказывать влияние на конформацию белков; при этом форма белок-лигандных взаимодействий может быть разной: 1 - связываясь с белком, лиганд стабилизирует его конформацию, не нарушая ее. Так, лиганд (ионы Са2+) лизоцима обеспечивает возникновение дополнительных связей между радикалами, что снижает степень денатурации белка. 2 - лиганд может значительно менять третичную структуру белка, что делает белок функционально более активным. Иногда присоединение какого-либо лиганда изменяет конформацию белка, в результате чего формируются центры связывания с другими лигандами и белок приобретает способность взаимодействовать с ферментами, меняя их активность. Так, белок кальмодулин – 4Са2+, который может присоединяться ко многим ферментам и активировать их. Например, сокращение гладких мышц связано с активацией их ферментов комплексом кальмодулин - 4Са2+ . 3 - лиганды завершают процессы образования вторичной, третичной и четвертичной структур белка. Без лиганда белок находится в состоянии расплавленной глобулы (вторичная завершена не до конца, третичной нети). У белка лактальбумина лигандом является ион Са2+, без которого третичная структура разрушается, хотя компактная глобулярная форма сохраняется. У остеокальцина - белка матрикса кости лигандом выступают 5 ионов Са2+ ,при связывании с которыми существенно уменьшается объем глобулы, формируется третичная структура и глобулы объединяются в олигомеры. У цитохрома С (белок цепи переноса электронов в митохондриях) удаление лиганда (гем) приводит к полному разворачиванию молекулы. 4 - связывание лиганда с белком вызывает масштабные подвижки доменов и субъединиц белка. Взаимодействие гемоглобина с лигандном (О2) вызывают многочисленные и сложные конформационные превращения, в частности поворот субъединиц гемоглобина относительно друг друга (рис.39). 6. Особенности первичной и пространственной структуры мембранных белков. 7. Взаимосвязь функции и особенностей строения структурных фибриллярных белков. Фибриллярные белки имеют вытянутую, нитевидную структуру, в которой соотношение продольной и поперечной осей составляет более 1:10. К фибриллярным белкам относят коллагены, эластин, кератин, выполняющие в организме человека структурную функцию, а также миозин, участвующий в мышечном сокращении, и фибрин - белок свёртывающей системы крови. На примере коллагенов и эластина рассмотрим особенности строения этих белков и связь их строения с функцией. 1. Строение и функции коллагеновКоллагены - семейство родственных фибриллярных белков, секретируемых клетками соединительной ткани. Коллагены - самые распространённые белки не только межклеточного матрикса, но и организма в целом, они составляют около 1/4 всех белков организма человека. В межклеточном матриксе молекулы коллагена образуют полимеры, называемые фибриллами коллагена. Фибриллы коллагена обладают огромной прочностью и практически нерастяжимы. Они могут выдерживать нагрузку, в 10 000 раз превышающую их собственный вес. По прочности коллагеновые фибриллы превосходят прочность стальной проволоки того же сечения. Именно поэтому большое количество коллагеновых волокон, состоящих из коллагеновых фибрилл, входит в состав кожи, сухожилий, хрящей и костей. Необычные механические свойства коллагенов связаны с их первичной и пространственной структурами. Молекулы коллагена состоят из трёх полипептидных цепей, называемых α-цепями. Идентифицировано более 20 α-цепей, большинство которых имеет в своём составе 1000 аминокислотных остатков, но цепи несколько отличаются аминокислотной последовательностью. В состав коллагенов могут входить три одинаковые или разные цепи. Первичная структура α-цепей коллагена необычна, так как каждая третья аминокислота в полипептидной цепи представлена глицином, около 1/4 аминокислотных остатков составляют пролин, около 11% - аланин. В коллагене отсутствуют такие аминокислоты, как цистеин и триптофан, α гистидин, метионин и тирозин находятся лишь в очень небольшом количестве. В составе первичной структуры α-цепи коллагена содержится также необычная аминокислота - гидроксилизин. Полипептидную цепь коллагена можно представить как последовательность триплетов Гли-X-Y, где X и Y могут быть любыми аминокислотами, но чаще в положении X стоит пролин, а в положении Y - гидроксипролин или гидроксилизин. Каждая из этих аминокислот имеет большое значение для формирования коллагеновых фибрилл. Пролин благодаря своей структуре вызывает изгибы в полипептидной цепи, стабилизируя ле-возакрученную спиральную конформацию. Спираль пептидной цепи коллагена стабилизирована не за счёт водородных связей (так как пролин их не образует), а силами стерического отталкивания пирролидиновых колец в остатках пролина. В результате расстояние между аминокислотными остатками по оси спирали увеличивается, и она оказывается более развёрнутой по сравнению с туго закрученной α-спиралью глобулярных белков. Таким образом, аминокислотная последовательность полипептидных цепей коллагена позволяет сформировать уникальную по своим механическим свойствам структуру, обладающую огромной прочностью. Изменение в первичной структуре коллагена может приводить к развитию наследственных болезней. 8. Изменение белкового состава организма. Изобелками (изоформами)белковназывают семейство белков, выполняющих почти одинаковую или похожую функцию у особей одного вида. Они имеют сходное строение, но некоторые особенности строения определяют различие в выполнении их физиологической роли. Например, изоформами являются виды белка гемоглобина: НbА, НbА2, НbF, которые различаются набором протомеров НbА - 2αβ; НbF - 2α2β; НbА -2α2β. НbF имеет большее сродство к кислороду, чем НbА и может отнимать у него кислород, т.к., НbF характерен для эмбрионов. Это вещество обеспечивает диффузии кислорода от НbА из крови матери к НbF характерен для эмбрионов. К изобелкам относятся 19 изоформ коллагена, изоферменты. Белки, подобные изобелкам, то есть имеющие сходное строение и выполняющие одинаковые функции, но функционирующие у особей разных видов, называются гомологичными. Среди множества пищевых веществ белки занимают особое место. Биологическим критерием ценности пищевых белков, как компонентов пищи, является аминокислотный состав белков. Белки, поступающие с пищей, подвергаются гидролизу до простых аминокислот. Часть из них поступает в ткани для биосинтеза собственных белков, часть - используется как энергетический материал. Для собственного биосинтеза важен состав аминокислот, поступающих с пищей. Именно он определяет ценность пищевых продуктов и их усвояемость, так как, в разных продуктах содержание аминокислот различно и не всегда включает все 20 видов аминокислот. Все аминокислоты можно поделить на 3 группы: 1 – незаменимыеаминокислоты, поступающие только с пищей растительного и животного происхождения (валин, лейцин, изолейцин, треонин, метионин, лизин, фенилаланин, триптофан); 2 - полузаменимые аминокислоты, синтезируемые в организме, но в недостаточном количестве, поэтому частично они должны поступать с пищей (аргинин, тирозин, гистидин: последний у детей вообще не синтезируется); 3 - заменимые аминокислоты (все остальные), синтезируемые в орга- низме в достаточном количестве из незаменимых и других аминокислот. При отсутствии незаменимых аминокислот возникают патологические состояния - болезни: отсутствие триптофана – пеллагра, цистеина – некроз печени и др. Белковый состав организма взрослого человека относительно постоянен; изменения количества отдельных белков в органах и тканях зависит от состава пищи, режима питания, биологических ритмов и пр. В процессе развития организма, особенно в процессе дифференцировки клеток, состав белков меняется: в клетках наряду с белками общего пользования появляются специфические белки, белки «роскоши» определяющие выполнение функций клетки (гемоглобин в эритроцитах, родопсин в сетчатке глаза, пищеварительные ферменты в эпителиях желудочно-кишечного тракта и т.д.). В результате мутаций генетического аппарата какие-то виды белков исчезают или сохраняются, но с измененной первичной структурой, что приводит к возникновению болезней - протеинопатий, которые могут быть наследственными или приобретенными. Наследственные протеинопатии обусловлены структурными изменениями в молекуле белка и в зависимости от характера повреждения, степени нарушения функции и роли дефектного белка могут вызвать болезни с разной степенью тяжести, вплоть до летального исхода, до рождения или в первые месяцы после рождения. Приобретенныепротеинопатии обусловлены изменениями коли- чества белка при сохранении его структуры. По такому механизму развивается панкреатит в результате снижения выработки ферментов пищеварительного сока. Изменение количества белков может быть вызвано разными причинами, но практически всегда болезнь вызывает нарушения функционирования других белков. Кроме того, в клетке происходит не только синтез, но и распад белков,что также оказывает влияние на количественный и качественный белковый состав организма. Распад происходит по нескольким причинам: 1 - распад обусловлен старением белков, которое происходит в резуль- тате разного рода воздействий среды: действию свободных радикалов, излучению, нагреванию и др. 2 - содержание некоторых белков должно изменяется в соответствии с меняющимися условиями: адаптация к ним требует ускоренного синтеза определенных белков. Для сохранения общей концентрации белков какую-то их часть необходимо подвергнуть распаду. 3 - распад обусловлен продолжительностью жизни белков и необходи- мостью их обновления. Белки могут разрушаться в тех же клетках, где они функционируют, но могут образоваться в одних клетках, а распадаться в других. Механизм и место разрушения белков полностью не изучены, но для короткоживущих белков установлено, что этот процесс убиквитин- зависимый (убиквитин - белок, который связывается с разрушаемым белком и тем самым его «метит»), и происходит в протеосомах(мультибелковые цилиндрические структуры, содержащие ферменты, разрушающие белки -протеазы). Долгоживущие белки разрушаются в лизосомах; транспорт белков к месту их разрушения обеспечиваютшапероны. |
