Тема 25. Многоядерные ароматические соединения. Лекция 19 полиядерные ароматические углеводороды план Полиядерные арены с конденсированными циклами
 Скачать 0.63 Mb. Скачать 0.63 Mb.
|
НафталинПростейшее бициклическое ароматическое соединение. 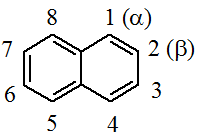 Хотя молекулярная формула указывает на ненасышенный характер нафталина, его свойства типичные для ароматических соединений. Нафталин удовлетворяет структурным критериям ароматичности. Циклическая плоская система, имеющая непрерывную цепь сопряжения, в котором участвую 10 p-электронов. Следует помнить, что Хюккель формулировал свое правило (4n + 2) для моноциклических систем. В случае нафталина считают, что в каждом цикле находится по 6 делокализованных электронов, а одна из пар является общей для обоих колец. Сопряжение показывают с помощью канонических структур: 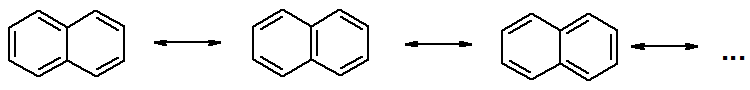 В результате: выше и ниже плоскости циклов находятся p-электронные облака, имеющие форму «восьмерки» Рис. 20.1. 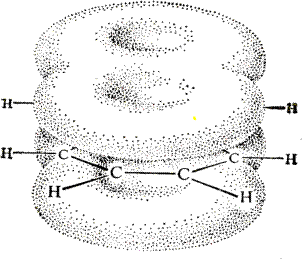 Рис. 20.1. Форма p-электронных облаков молекулы нафталина В нафталине не все С-С связи одинаковы. Так, длина С1-С2 равна 1,365 Å, а С2-С3 – 1,404 Å. Энергия сопряжения нафталина 61 ккал/моль, что меньше удвоенной энергии делокализации бензола (2х36 ккал/моль). Второй цикл вносит в сопряжение меньше, чем первый. Нафталин менее ароматичен, чем бензол. Нарушение ароматичности одного из его циклов требует всего 25 ккал/моль, что и проявляется в его реакциях. РеакцииОкисление нафталина протекает аналогично окислению бензола.  Образующаяся фталевая кислота в условиях реакции превращается во фталевый ангидрид, который и выделяют в результате реакции. Реакции восстановления также иллюстрируют меньшую ароматичность нафталина в сравнении с бензолом. Нафталин можно гидрировать химическими восстановителями в мягких условиях. 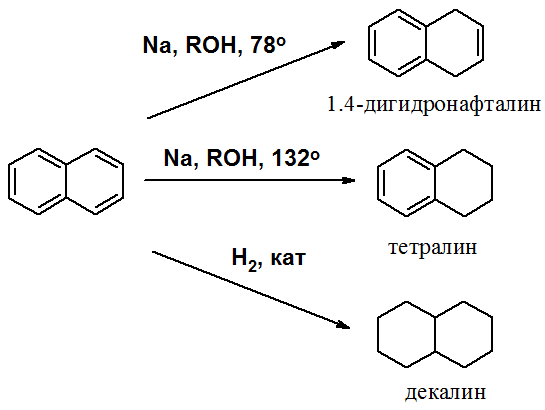 Реакции ароматического электрофильного замещенияВ целом реакции SEAr в нафталине протекают по общему механизму, рассмотренному ранее. Особенность реакций в нафталиновом ряду заключается в том, что монозамещенные нафталины существуют в виде двух изомеров (1- и 2-производные). Особенности реакций SEAr рассмотрены на примере реакции нитрования, основной продукт которой 1-нитронафталин (2-изомера – следы). 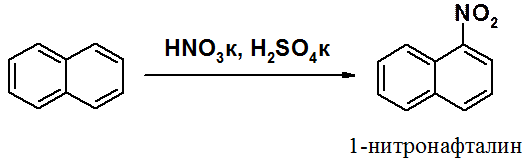 Ключевая стадия реакции - образование s-комплекса, которых может быть два. Надо определить структурные факторы, которые стабилизируют или дестабилизируют интермедиат. На этой основе можно предсказать и объяснить протекание замещения. Рассмотрим строение возможных промежуточных продуктов. При атаке электрофила по положению 1 нафталина образуется s-комплекс, строение которого может быть описано двумя граничными структурами, в которых сохраняется бензольный цикл. Такие структуры более стабильны за счет бензольного сопряжения. При атаке электрофила в положение 2 можно нарисовать только одну энергетически выгодную структуру.  Можно сделать вывод, что электрофильная атака в положение 1 нафталина приводит к более устойчивому s-комплексу, чем реакция в положение 2. Многоядерные арены с изолированными бензольными циклами Наиболее важными представителями этой группы соединений являются бифенил, дифенилметан и трифенилметан. 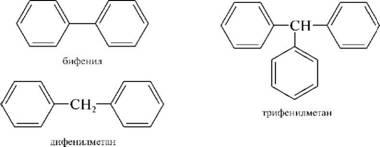 БИФЕНИЛ 1¥±олекула бифенила содержит два бензольных кольца, соединенных ст-связью. Нумерацию каждого бензольного ядра проводят отдельно. 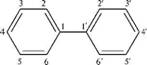 способы получения. 1. ыиц/енил выделяп*ш из каменноуголинои смолы, где он содержится в небольшом количестве. 2. Дегидрогенизация бензола. Пары бензола пропускают через раскаленные трубки. Выход бифенила достигает 70 \%. Л-3 13. Многоядерные арены с изолированными бензольными циклами з. реакция ^глимана. нагревание йодбензола в присутствии порошка меди: твердое вещество с I = /0 с, легкорастворим в спирте, эфире. Строение. лимические свойства. Два бензольных кольца в молекуле бифенила соединены между собой с-связью, длина которой (0,148 нм) несколько меньше длины углерод-углеродной связи в алканах (0,154 нм). Вокруг с-связи в молекуле бифенила возможно свободное вращение, при этом барьер вращения невелик. Но если в орто-по-ложениях обоих бензольных колец содержатся объемные заместители, то из-за пространственных препятствий вращение вокруг с-связи, соединяющей два цикла, сильно затрудняется или становится невозможным. Бензольные кольца располагаются под углом. Если в орто-положениях каждого бензольного ядра молекулы бифенила находятся разные заместители, то такие соединения проявляют оптическую активность. Обусловлено это тем, что эти соединения хотя и не содержат асимметрического атома углерода (центра хиральности), но не имеют также и плоскости симметрии. Их молекула асимметрична в целом. Так, 6,6'-динитродифеновая кислота существует в виде двух энантиомеров (зеркальных изомеров): 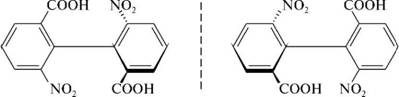 Вид пространственной изомерии, обусловленный ограничением свободного вращения вокруг простой связи, называется атропи-зомерией (от греч. атропо — нет поворота). Для проявления атропизомерии необязательно наличие четырех заместителей в орто- положениях, иногда достаточно трех или даже двух объемных заместителей. Лимические свойства. Химические свойства бифенила аналогичны свойствам моноядерных аренов. Для него характерны реакции электрофильного замещения (нитрование, галогенирова Многоядерные арены ние, сульфирование и т. д.). в эти реакции бифенил вступает легче, чем бензол, при этом образуются преимущественно продукты пара- и орто-замещения. Связано это с тем, что фенильные группы оказывают по отношению друг к другу слабые электронодо-норные свойства, то есть одно из колец при этом выполняет роль заместителя I рода. 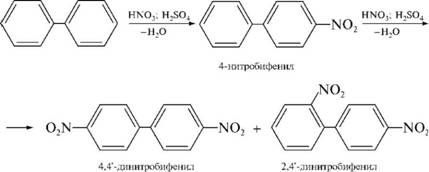 Нитрогруппа в молекуле 4-нитробифенила уменьшает электронную плотность, прежде всего в бензольном кольце, в котором она находится, поэтому вторая нитрогруппа вступает в незамещенное ядро. ДИФЕНИЛМЕТАН и молекуле дифенилметана два иензолиныл цикла связаны через метиленовую группу. Нумерацию углеродный атомов в каждом цикле проводят отдельно: 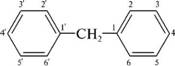 ^миі/ішім пил^тснпл. дифенилметан получают по реакции ^ри- деля—Крафтса алкилированием иензола иензилллоридом или ди-ллорметаном: 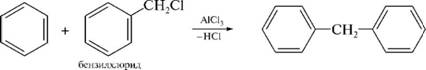 13. Многоядерные арены с изолированными бензольными циклами  ■чилические свойства. дифенилметан — твердое кристаллическое вещество с ^ё = 26...27 °С и запахом герани, легкорастворим в спирте, диэтиловом эфире, хлороформе. лимические свойства. Для дифенилметана характерны реакции с участием бензольных циклов и активной метиленовой группы. Как ароматический углеводород дифенилметан вступает в реакции электрофильного замещения, образуя 4,4'-дизамещенные и 2,4,2',4'-тетразамещенные продукты: 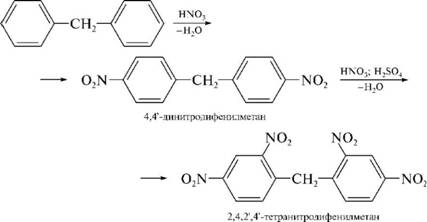 гдтомпы водорода мметиленовой группы в молекуле дифенил- метана подвижны вследствие электроноакцепторного действия двух бензольных ядер. В результате дифенилметан легко окисляется по положению 7: 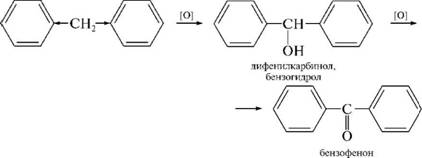 Многоядерные арены ^ипоитдрил лолл^1^л и^лидпшм ирид^мим при нил)м^ппп димедрола (C6H5)2CHOCH2CH2N(CH3)2 - HCl — аптигистамиппого средства. Водородпые атомы метилеповой груииы также легко замещаются па галогеп: 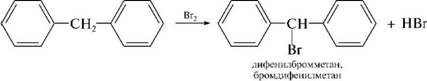 дифенилметан используется в парфюмерной промышленности для отдушки мыл; некоторые его производные являются пестицидами. ТРИФЕНИЛМЕГАН jj милсл^лс ірифспилмсіапа три иіп^илопшл циічла іклоапи через метиновую группу CH:  ^uutuum нил^чспнл. ірифенилметан получают по реакции Фриделя—Крафтса из хлороформа и бензола: 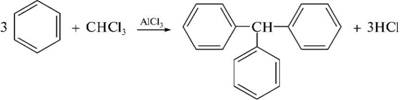 13. Многоядерные арены с изолированными бензольными циклами ^нонмсскис сьиисіьа. ірифенилметан — кристаллическое вещество с ґпл = 76 °С, труднорастворимое в воде, легко — в органических растворителял. Хнмнческне свойства. По лимическим свойствам трифенилме-тан во многом напоминает дифенилметан. Для него также ларак-терны реакции электрофильного замещения с участием бензольныл циклов и реакции с участием атома водорода группы СИ. Фенильные радикалы, проявляя —/-эффект, смещают на себя электронную плотность с атома углерода СН-группы, вследствие чего атом водорода этой группы приобретает подвижность и легко замещается на металлы и галогены. За счет метиновой группы трифенилметан легко окисляется. іак, при действии натрия амида в жидком аммиаке трифенил-метан образует трифенилметилнатрий: 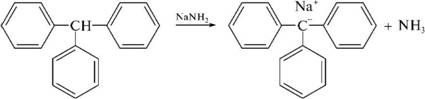 Трифенилметилнатрий окрашен в желтый цвет, он имеет ионное строение, его эфирные растворы проводят электрический ток. Стабильность трифенилметил-аниона и наличие окраски объясняется тем, что в делокализации отрицательного заряда принимают участие все три бензольных ядра: 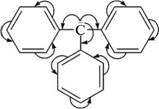 трифенилметил-анион При взаимодействии трифенилметана с хлором атом водорода СН-группы замещается на хлор, продуктом реакции является три-фенилхлорметан. гтом хлора в его молекуле очень подвижен. При растворении трифенилхлорметана в жидком Б02 (растворитель с высокой диэлектрической постоянной) в присутствии А1С13 происходит его ионизация с образованием трифенилметил-катиона: Многоядерные арены 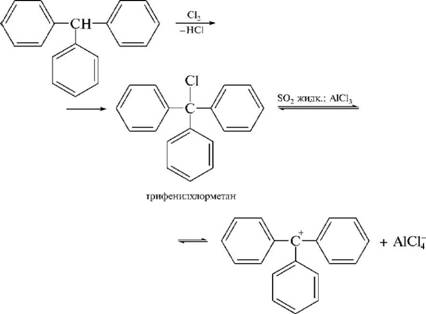 трифенилкарбокатион При окислении трифенилметана образуется трифенилкарбинол, который подвергается ионизации в концентрированной сер ной кислоте: 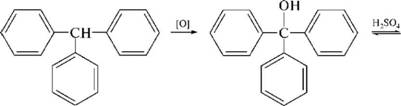 трифенилкарбинол 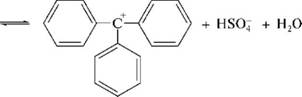 13. Многоядерные арены с изолированными бензольными циклами 141 остойчивость трифенишметил-катиона также обусловлена участием бензольных колец в делокализации положительного заряда за счет сопряжения: 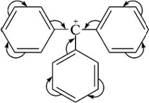 трифенилметил-катион При обработке трифенилхлорметана цинком в бензольном растворе образуется свободный трифенилметильный радикал, находящийся в равновесии со своим димером: 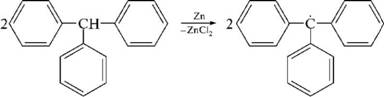 трифенмл метил- ра д икал 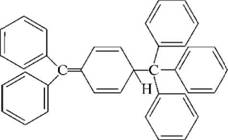 производное шпстогексадиена Трифенилметильный радикс — это первый радикал, полученный в свободном виде. Он был получен в 1900 году американским химиком М. Гомбергом. Столь высокая устойчивость три-фенилметила по сравнению с алкильными радикалами объясняется значительной делокализацией неспаренного электрона по всем бензольным кольцам. Многоядерные арены  свободный радикал трифенилметила окрашен в желтый цвет. Красители трифенилметанового ряда. К красителям трифенил-метанового ряда относятся бриллиантовый зеленый и фенолфталеин. Бриллиантовый зеленый — представитель аминопроизводных трифенилметана. Его получают конденсацией бензальдегида с К,К'-диэтиланилином в присутствии кислотного катализатора (хлороводородной кислоты) согласно схеме: 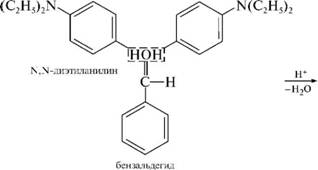 (С2Н5)^-^ ^Ч/Н(СД)  [О]; РЬ02 4,4'- бис- (диэти ламино) трифенилм етан, лейко основание бріїллі^антового зеленого (бесц ветн ое вещество) 13. Многоядерные арены с изолированными бензольными циклами 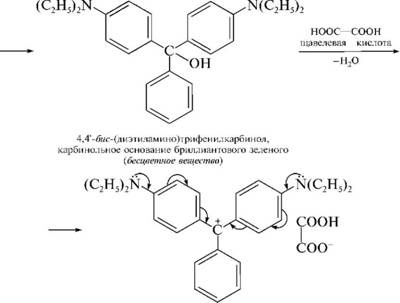 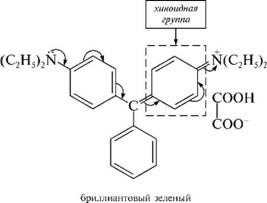 бриллиантовихй зеленый широко применяется в медицине в виде 1—2 \%-ных водных или спиртовых растворов как антисептическое средство, а также при изготовлении бактерицидных пластырей. Фенолфталеин является представителем гидроксипроизводных трифенилметана. Получают фенолфталеин конденсацией фенола со фталевым ангидридом в присутствии концентрированной сер- ной кислоты: Многоядерные арены 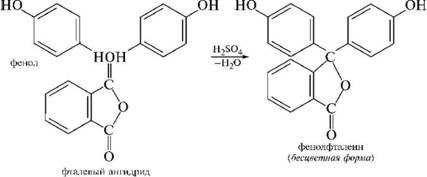 фенолфталеин представляет собой белое кристаллическое вещество с ^ = 259...263 °С, практически не растворяется в воде, хорошо растворяется в этаноле. Фенолфталеин применяется в аналитической практике как кислотно-основный индикатор. В кислой и нейтральной среде он находится в бесцветной лактонной форме, в щелочной среде (при рН = 8,2...10,0) приобретает малиновую окраску вследствие образования хиноидной структуры. 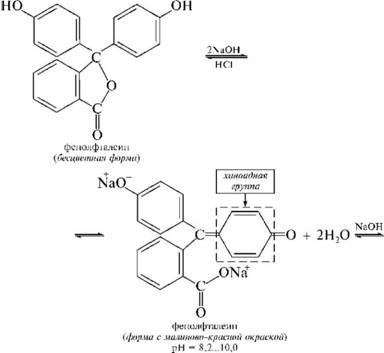 13. Многоядерные арены с изолированными бензольными циклами 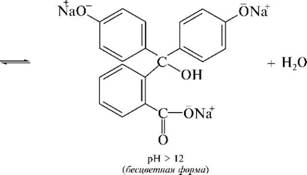 Малиновая окраска исчезает в избытке щелочи. Фенолфталеин применяется в медицине как слабительное сред- ство при лроническил запорал. Выше уже было сказано, что свободные бензильный и аллильный радикалы стабилизованы вследствие резонанса; это означает, что они устойчивы только в сравнении с простыми алкильными радикалами, такими, как метальный и этильный. Свободные бензильный и аллильный радикалы — очень реакционноспособные неустойчивые частицы, кратковременное существование которых (тысячные доли секунды) было предложено для объяснения некоторых экспериментальных данных. В лабораториях нет сосудов с этикетками «бензильные радикалы» или «аллильные радикалы». Существует ли какое-нибудь прямое доказательство существования свободных радикалов? В 1900 г. в журнале «Journal of the American Chemical Society» и в «Berichte der Deutschen Chemischen Gesellschaft» появилась интересная статья; ее автором был молодой химик, родившийся в России, Мозес Гомберг, работавший в то время в Мичиганском университете. Гомберг занимался исследованием полностью фенилированных алканов. Он получил тетрафенилметан (ряд химиков прежде пытались осуществить этот синтез, но безуспешно) и поставил задачу синтезировать гексафенилэтан. Имея три-фенилхлорметан (разд. 12.6), он проводил синтез так, как сделал бы это сегодня; посредством реакции Вюрца он пытался соединить вместе две три-фенилметильные группы. 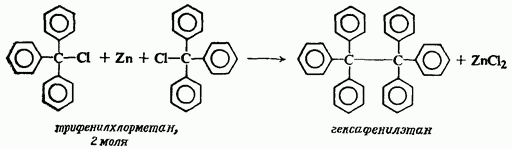 Поскольку натрий дает плохие результаты, Гомберг использовал мелко раздробленное серебро, ртуть или цинковую пыль. Он оставлял бензольный раствор трифенилхлорметана над одним из этих металлов и затем отфильтровывал раствор от галогенида металла. После упаривания бензола оставалось белое кристаллическое вещество, которое после кристаллизации плавилось при 185 °С; он думал, что это гексафенилэтан. Как всегда, Гомберг проанализировал новое вещество на содержание углерода и водорода. К его удивлению, анализ дал 88% углерода и 6% водорода, т. е. в сумме только 94%. Думая, что сожжение прошло не полностью, он повторил анализ, на этот раз более тщательно и в более жестких условиях; однако результаты были такие же, как и в первом случае. Повторив анализы образцов, полученных как из трифенилхлорметана, так и из трифенилброммегана и очищенных кристаллизацией из различных растворителей, он убедился, что получил не углеводород гексафенилэтан, а соединение, содержащее 6% какого-то другого элемента, возможно кислорода. Кислород мог попасть из Примесей в металлах, но такие же результаты были получены и при использовании исключительно чистых образцов металлов, тщательно очищенных от кислорода. Кислород мог попасть из воздуха, хотя Гомберг не мог предположить, как молекула кислорода может реагировать с углеводородом при комнатной температуре. Он провел реакцию снова, но на этот раз в атмосфере двуокиси углерода. После фильтрования раствора (также в атмосфере двуокиси углерода) и упаривания растворителя он получил вещество с температурой плавления не 185 °С; это оказалось совершенно другое соединение, значительно более растворимое в бензоле, чем вещество с т. пл. 185 °С, и имеющее более низкую температуру плавления. Данные анализа этого вещества после очистки соответствовали гексафенилэтану: 9-3,8% углерода и 6,2% водорода При растворении этого нового вещества в бензоле образовывался желтый раствор. При добавлении в сосуд небольшого количества воздуха желтая окраска исчезала, но через несколько минут появлялась снова. При добавлении новых порций кислорода повторялось то же: окраска исчезала, а затем медленно появлялась. Наконец, окраска исчезала совсем; при упаривании раствора оставалось первое вещество с т. пл. 185 °С. Охлажденный до Соединение с температурой плавления 185 °С было перекисью Если полученное им новое вещество действительно было гексафенилэтаном, то оно вело себя очень странно. Расщепление углерод-углеродной связи такими мягкими реагентами, как кислород и иод, было неизвестно химикам-органикам. «Экспериментальные данные, описанные выше, привели меня к выводу, что в данном случае мы имеем дело со свободным радикалом, трифенилметилом Однако предположение Гомберга было признано только десять лег спустя. Теперь очевидно, что происходит следующее: металл отщепляет атом хлора от трифенилхлорметана с образованием свободного радикала трифенилметила; два этих радикала соединяются с образованием гексафенилэтана. Но эта углерод-углеродная связь очень непрочна и даже при комнатной температуре может разорваться с образованием радикалов. Таким образом, существует равновесие между свободными радикалами и углеводородом. Хотя это равновесие сдвинуто в сторону углеводорода, любой раствор гексафенилэтана содержит заметное количество свободных трифенилметильных радикалов. Количество вещества, существующего в виде свободных радикалов, составляет около 2% в 1 М растворе, 10% в 0,01 М растворе и почти 100% в очень разбавленных растворах. Поэтому не будет ошибкой, если на сосуде с разбавленным раствором этого вещества написать «трифенилметильные радикалы». 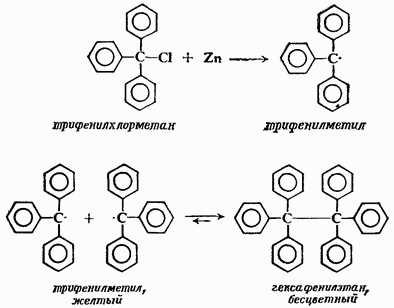 Трифенилметил имеет желтую окраску, а гексафенилэтан и перекись бесцветны. Раствор гексафенилэтана желтый, потому что в равновесной смеси присутствуют трифенилметильные радикалы. При добавлении кислорода трифенилметил быстро реагирует с образованием перекиси, и желтая окраска исчезает. Часть гексафенилэтана диссоциирует для восстановления равновесия, и раствор вновь окрашивается в желтый цвет. Только когда вся смесь гексафенилэтана и трифенилметана превратится в перекись, желтая окраска больше не появляется. Аналогично трифенилметил реагирует с иодом 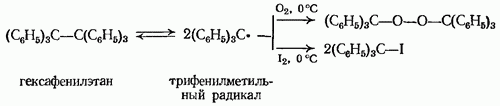 Таким образом, гексафенилэтан вступает в эти удивительные реакции, диссоциируя сначала на трифенилметильные радикалы, которые, хотя и необычно устойчивы для свободных радикалов, тем не менее являются очень реакционноспособными частицами. Получены многие другие гексаарилэтаны, и существование триарилметильных свободных радикалов доказано несколькими способами; в действительности некоторые из этих соединений, по-видимому, существуют целиком в виде свободных радикалов даже в твердом состоянии. Наиболее убедительным доказательством свободнорадикальной природы этих соединений являются свойства, которые непосредственно обусловлены неспаренный электроном, наличие которого характерно для свободного радикала. Два электрона, которые занимают одну и ту же орбиталь и составляют таким образом пару, имеют противоположные спины (разд. 1.6); магнитные моменты, соответствующие их спинам, компенсируют друг друга. Но, согласно определению (разд. 2.12), нечетный электрон свободного радикала не спарен и, следовательно, эффект спина не компенсирован. Этот спин определяет суммарный магнитный момент свободного радикала. Этот магнитный момент проявляется двумя путями: а) соединение парамагнитно, т. е. в отличие от других соединений оно взаимодействует с магнитным полем; б) соединение дает характерный спектр парамагнитного резонанса (или спектр электронного парамагнитного резонанса, разд. 13.15), который зависит от ориентации спина неспаренного электрона в изменяющемся внешнем магнитном поле. Последнее свойство позволяет обнаружить не только устойчивые свободные радикалы, но и небольшую концентрацию короткоживущих промежуточных радикалов в химических реакциях, и может даже дать информацию об их строении (см., например, разд. 6.17). Значительная диссоциация гексафенилэтана обусловлена двумя факторами. Во-первых, трифенилметильные радикалы необычно устойчивы вследствие резонанса, аналогично тому как было предложено для бензильного радикала. В данном случае, конечно, существует еще большее число структур (36), которые стабилизуют радикал, но не углеводород; неспаренный электрон сильно делокализован, поскольку он распределен по трем ароматическим кольцам. Во-вторых, пространственное взаимодействие больших ароматических колец имеет тенденцию растянуть и ослабить углерод-углеродную связь, соединяющую трифенилметильные группы. После того как радикалы образовались, объемистые группы затрудняют подход атомов углерода друг к другу на расстояние, достаточно близкое, чтобы образовалась связь. Строение молекулы сильно влияет на энергию связи; об этом свидетельствует тот факт, что энергия диссоциации углерод-углеродной связи в этане составляет 84 ккал Трудно переоценить значение работ Гомберга в химии свободных радикалов и вообще в органической химии. Хотя трифенилметильный радикал был выделен только благодаря тому, что он не является типичным свободным радикалом, его химические свойства характерны для свободных радикалов; главное, Гомберг доказал, что такие частицы, как свободные радикалы, могут вообще существовать. |
