Тема 25. Многоядерные ароматические соединения. Лекция 19 полиядерные ароматические углеводороды план Полиядерные арены с конденсированными циклами
 Скачать 0.63 Mb. Скачать 0.63 Mb.
|
|
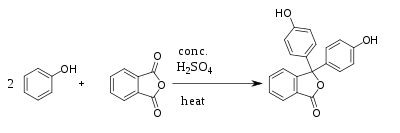
Синтез Синтезируется путём конденсации фенола и фталевого ангидрида при 105—110 °C в присутствии ZnCl2 или концентрированной серной кислоты.
Химические свойства При сплавлении фенолфталеина с NaOH образуется 4,4'-дигидроксибензофенон, при нагревании с конц. H2SO4 — фенол и 2-гидроксиантрахинон. Получают флуоресцеин конденсациейфталевого ангидрида с резорцином: 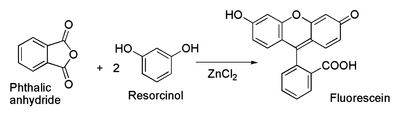 ЭОЗИН (2,4,5,7-тетрабромфлуоресцеин, кислотный красный 87), мол. м. 647,9; красно-желтые кристаллы; т. пл. 295-296 °С (с разл.); раств. в этаноле, плохо раств. в бензоле, уксусной к-те, хлороформе, не раств. в воде, диэтиловом эфире. Эозин относится к группе ксантеновых красителей. Его получают действием Вr2 на флуоресцеин в присут. NaClO3. 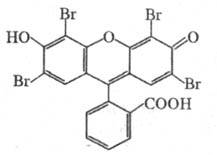 Na-соль эозина - кислотный краситель (окрашивает натуральный шелк в ярко-розовый цвет с желтой флуоресценцией). Применяют гл. обр. для приготовления красных чернил и карандашей, губной помады, румян, для окрашивания бумаги, моторных топлив, биол. препаратов, как компонент полиграфич. красок. Динатриевая соль эозина (эозин желтоватый, эозин Н) - кислотно-основный люминесцентный индикатор (хорошо раств. в воде, хуже - в этаноле; при рН 1-3 появляется зеленая люминесценция); адсорбц. индикатор для аргентометрич. определения Вr-, I- и SCN- (цвет люминесценции меняется от красного к фиолетовому), этиловый эфир эозина - реагент для определения Pt при рН 10 [l 555 нм; мешают Rh(III) и Fе(III)]. НАФТОЛЫ, мол. м. 144,16. 1-Hафтол (a-нафтол, ф-ла I) и 2-нафтол (b-нафтол, II)-бесцв. кристаллы (см. табл.) со слабым фенольным запахом; хорошо раств. в этаноле, диэтиловом эфире, хлороформе, бензоле, плохо-в воде. 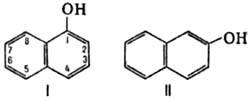 По хим. св-вам - типичные фенолы. С водными р-рами щелочей образуют р-римые в воде соли. С ангидридами и хлорангидридами орг. к-т дают ацетильные производные, со спиртами в присут. НСl или Н2SО4-эфиры, напр. метиловый эфир 2-нафтола ("яра-яра"), т. пл. 72-73 °С, т. кип. 274 °С; эфиры раств. в этаноле, не раств. в воде. При нагр. с NaHSO3 и NH3 нафтолы образуют бисульфитные производные, к-рые с избытком NH3 превращ. в нафтиламины (р-ция Бухерера - Лепти), напр.: 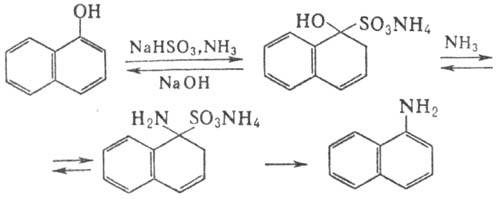 НАФТИЛАМИНЫ, мол. м. 143,18. 1-Нафтиламин (a-нафтиламин, ф-ла I) и 2-нафтиламин (b-нафтиламин, II)-бесцв. кристаллы (см. табл.), темнеющие на воздухе; хорошо раств. в этаноле, диэтиловом эфире, плохо-в воде; возгоняются, перегоняются с водяным паром.  НЕКОТОРЫЕ СВОЙСТВА НАФТИЛАМИНОВ  По хим. св-вам-типичные ароматач. амины. Образуют соли с сильными неорг. к-тами; при нагр. с орг. к-тами ацилируются, с ангидридами к-т дают диацетильные производные. Под действием NaOH, NaHSO3, водных р-ров H2SO4 (180°C) и воды (400-460 °С, кат.-Аl2О3) превращ. в соответствующие нафтолы. При нитровании смесью конц. HNO3 и H2SO4 группа NO2 вступает преим. в положение 5, а также в положение 8. При сульфировании конц. H2SO4 1-нафтиламин образует сульфат, к-рый при 180-200 °С превращ. в 4-аминонафталин-1-сульфокислоту (нафтионовую к-ту); при сульфировании олеумом при 20-30 °С сульфогруппа вступает в положение 5, при 130°С-в положения 4 и 6 или 4 и 7. При сульфировании 2-нафтиламина конц. H2SO4 (80 °С) или олеумом при 20-80°С сульфогруппа вступает в положения 5,6,7 или 8; при взаимод. с SO3 и СlSО3Н-в положение 1 с образованием 2-аминонафталин-1-сульфокислоты (к-ты Тобиаса). При дальнейшем сульфировании сульфокислот группа SO3H вступает в положения 6 и 8 или 5 и 7. Окисление 1-нафтиламина кислородом приводит к фталимиду и фталевому ангидриду, окисление 2-нафтиламина в присут. V2O5 при 400-420 °С-к фталимиду и HCN. Нафтиламины легко диазотируются с образованием солей диазония. 1-Нафтиламин получают нитрованием нафталина с послед. гидриро-ванием образовавшегося нитронафталина (кат.-Ni или Сu) или действием Na2S2; 2-нафтиламин может быть получен взаимод. 2-нафтола с NH4HSO3 и NH3 (180 °С, 1,5 МПа). 1-Нафтиламин -полупродукт в синтезе азокрасителей, исходное в-во в произ-ве аминонафталинсулъфокислот, 1-нафтола, нек-рых гербицидов и пигментов. N-Фенил-1-нафтиламин и N-фенил-2-нафтиламин - антиоксидантыкаучуков. НАФТАЛИН, мол. м. 128,2; бесцв. кристаллы с характерным запахом; т. пл. 80,29 °С (с возг.), т. кип. 218oС. 87,6oС/10 мм рт. ст.; d204 1,0253, d485 0,9754; пD85 1,5898; C0p 159,28 Дж/(моль.К); DH0пл 19,288 кДж/моль, DH0исп 43,5 кДж/моль, DH0сгор-5158,4 кДж/моль, DH0обр-78,53 кДж/моль; ркрит 4,051 МПа, tкрит 475,2 °С; e 2,85 (25 °С); m 0 (25 °С, бензол). Хорошо раств. в орг. р-рителях, плохо-в воде. Р-римость в воде: 0,019 г/л (0°С), 0,0344 г/л (25 °С). Перегоняется с водяным паром.  Молекула нафталина плоская; в отличие от бензола, длины связей С—С (нм) неодинаковы (см. ф-лу I). 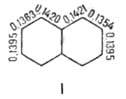 В УФ спектре в этаноле lмакс (lgel) 275 (3,75), 286 (3,60), 312 (2,40), 320 (1,40). Нафталин - конденсир. ароматич. углеводород. Молекула нафталина представляет собой 10-p-электронную систему; электронная плотность у a-атомов С выше, чем у р-атомов. Нафталин обладает меньшей ароматичностью, чем бензол (см. Ароматичность). Монозамещенные нафталина существуют в виде 1- и 2-изомеров. Положения 1 и 5 в нафталиновом кольце наз. ана-, положения 2 и 6-амфи-, положения 1 и 8-пери-положениями. Для нафталина наиб. характерны р-ции электроф. замещения. Нафталин нитруется HNO3 в р-ре H2SO4 при 60 °С с образованием 1-нитронафталина с примесью 2-нитронафталина (1,7-4,5%); дальнейшее нитрование 1-нитронафталина при 80oС приводит к образованию смеси 1,5- и 1,8-динитронафтали-нов (1:2). Хлорированиепропусканием Сl2 в расплав нафталина при 110-120°С в присут. соед. Fe приводит к образованию 1-хлорнафталина (примесь ок. 5% 2-хлорнафталина); при т-ре до 150 С получается смесь полихлоридов нафталина (т. наз. галоваксы), применяемая в качестве электроизоляц. материалов. Сульфирование нафталина конц. H2SO4 при т-ре ниже 80 °С приводит к 1-нафталинсульфокислоте, при т-ре выше 150°С-к 2-нафталинсульфокислоте; при действии 20%-ного олеума при 40 °С 1-нафталинсульфокислота превращ. в смесь 1,5- и 1,6-нафталиндисульфокислот, дальнейшее суль-фирование к-рых 30%-ным олеумом при 90 °С приводит к смеси 1,3,5- и 1,3,6-нафталинтрисульфокислот (см. также Нафталинсульфокислоты). Нафталин легко вступает в р-цию Фриделя-Крафтса. Так, при ацетилировании в среде дихлорэтана с выходом 98% образуется 1-ацетилнафталин, в среде нитробензола - 2-ацетил-нафталин (выход 70%). Бензоилирование нафталина под действием бензоилхлорида в присут. АlСl3 в среде полихлорбензолов приводит к смеси 1,5- (80%) и 1,8-(20%) дибензоилнафтали-нов. Алкилирование нафталина идет обычно с низкими выходами; напр., при взаимод. нафталина с СН3Сl при 25°С в CS2 в присут. АlСl3 с выходом 11% получается 2-метилнафталин. Нафталин алкилируется также в положение 2 при пропускании его смеси с алкилхлоридом над Аl2О3 при 400 °С. Алкилирование спиртами в присут. АlСl3 идет в b-положения с образованием смеси равных кол-в моно- и 2,6-диалкилнафталинов (выход 60-90%). Хлорметилируют нафталин нагреванием с хлороформом, ледяной СН3СООН, Н3РО4 и конц. НСl с образованием исключительно 1 -хлорметилнафталина. Нафталин окисляется и гидрируется значительно легче, чем бензол. Действием Сr2О3 в СН3СООН нафталин окисляется до 1,4-нафтохинона (выход 43%), КМnО4 в воде при 100°С-до фталевой к-ты, воздухом при 350-500 °С в присут. Мо2О3 или V2О5-до фталевого ангидрида. При восстановлении нафталина Na в С2Н5ОН в зависимости от условий проведения р-ции образуются 1,4-, 1,2-дигидронафталины или 1,2,3,4-тетра-гидронафталин (тeтралин). При действии Na на нафталин в отсутствие влаги и воздуха образуется промежут. анион-радикал зеленого цвета. При восстановлении Li в тех же условиях получается дианион красного цвета. Каталитич. гидрирова-ние нафталина при 150°С (кат.-Ni) приводит к тетралину, при 200 °С - к декагидронафталину (декалину). Декалин образуется также при гидрировании нафталина при 120-180°С на платиновом катализаторе.  АНТРАХИНОНОВЫЕ КРАСИТЕЛИ, содержат ядро антрахинона, его карбо- или гетероциклич. производных. Один из наиб. обширных классов красителей. Отличаются, как правило, высокой устойчивостью окрасок, особенно к действию света. Введение электронодонорных заместителей в антрахинон приводит к донорно-акцепторному взаимод. этих заместителей с электроноакцепторными карбонильными группами, сближению энергетических уровней основного и возбужденного состояний и, в результате, к углублению окраски (от желтой для антрахинонадо синей). Изменяя положение, число и характер заместителей, из к-рых наиб. часто используются амино-, алкил- и ариламиногруппы, окси-, алкокси- и арилоксигруппы, добиваются необходимого цвета и оттенка красителя. Напр., для Наиб. практич. значение имеют производные 1,4-диаминоантрахинона. Сам 1,4-диаминоантрахинон и его N-алкилзамещенные - дисперсные красители, напр. фиолетовый краситель (ф-ла I, R = R' = Н), сине-фиолетовый (I, R = = Н, R' = СН3) и синий (I, R = СН3, R' = СН2СН2ОН). Симметричные антрахиноновые красители (R = R') получают аминированием лейко-1,4-дигидроксиантрахинона (хинизарина) в избытке соответствующего амина при 90-130оС в присут. Н3ВО3 с послед. окислением воздухом. 1,4-Ди-n-толиламино-, 1,4-димезитиламиноантрахиноны - жирорастворимые синий и зеленый красители, их дисульфопроизводныеценные кислотные красители для шерсти. Введение в ариламиногруппы длинных алкильных радикалов (всего 8-12 атомов С на молекулу антрахинонового красителя) улучшает устойчивость кислотных антрахиноновых красителей к мокрым обработкам и позволяет проводить крашение из менее кислых р-ров; это важно для окраски полушерстяных волокон, к-рые менее стойки к сильно кислым красильным р-рам. Напр., кислотный зеленый антрахиноновый Н2С (I, R = R' = OSO2C6H4C4H9-n) более прочен на шерсти, чем 1,4-ди-n-толиламиноантрахинон. 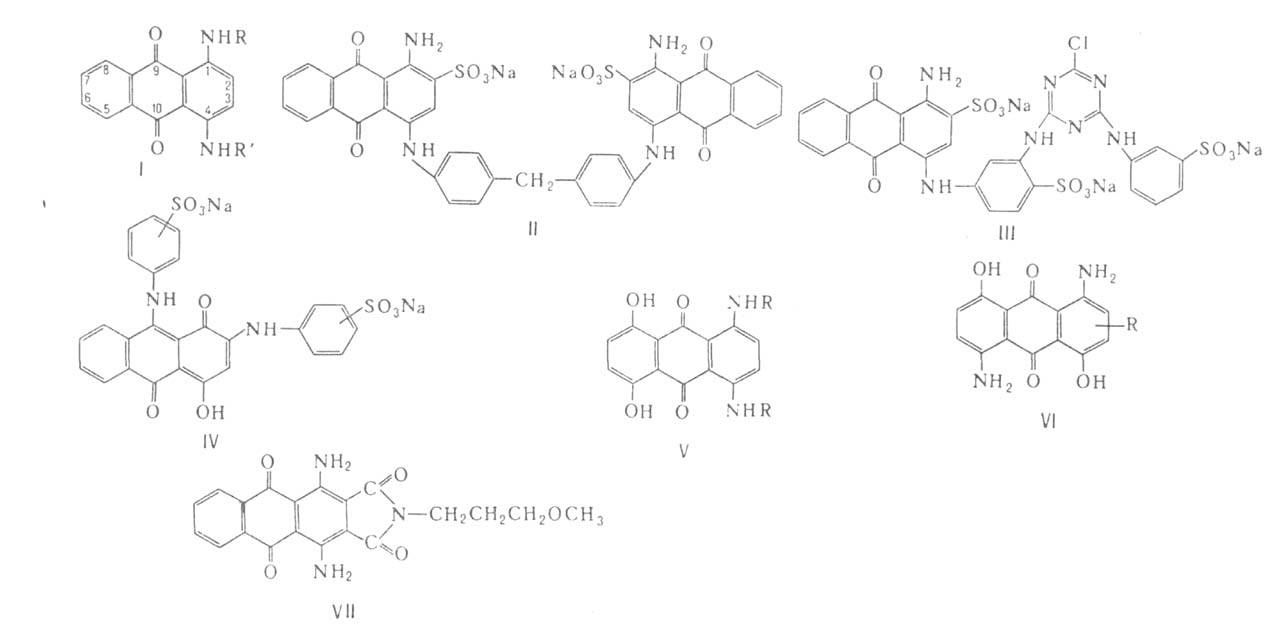 Несимметричные производные 1,4-диаминоантрахинона получают аминированием 1-амино-4-галогенантрахинонов, напр. 1-амино-2,4-дибромантрахинона, 1-метиламино-4-бром- и 1-амино-4-бромантрахинон-2-сульфокислоты (т. наз. бромаминовой к-ты). Р-цию проводят с небольшим избытком амина в присут. кат. (Си, соли Сu+ и Сu2 +, СuО) и кислотосвязывающих агентов (Na2CO3, NaOH, CH3COONa) при 70-120°С. Атомы брома или сульфогруппа в положении 2 м. б. замещены на эфирные группы действием алкоголятов или фенолятов при 90-180°С. При этом цвет антрахиноновых красителей повышается от синего до фиолетового. Напр., 1-амино-4-мезидиноантрахинон-2-сульфокислота -синий кислотный антрахиноновый краситель, а дисульфокислота 1-амино-2- (n-трет-бутилфенокси) - 4-мезидиноантрахинона-фиолетовый. С увеличением мол. массы кислотных антрахиноновых красителей улучшается прочность окрасок к мокрым обработкам. Напр., показатели прочности окрасок кислотным голубым антрахиноновым Н23 (II)-продукта взаимод. бромаминовой к-ты с 0,5 моль 4,4'-диаминодифенилметана (окрашивает шерсть из слабокислой среды) выше, чем у окрасок аналогичным красителем, полученным с применением анилина. Активные антрахиноновые красители синего цвета для хлопка и шерсти получают введением в ариламиногруппу, напр., остатков цианурхлорида, дихлорпиримидина, гидроксиэтилсульфонильной группы или дибромпропиониламиногруппы. Напр., синий активный антрахиноновый краситель для хлопка (III) получают взаимод. бромаминовой к-ты с м-фенилендиамин-3-сульфокислотой с послед. обработкой цианурхлоридом и заменой одного из атомов С1 в нем на остаток метаниловой к-ты. Др. активный краситель голубого цвета получают взаимод. бромаминовой к-ты с 3-( 1,4-Аминогидроксипроизводные антрахинона - красители от розового до фиолетового цвета. Их получают: 1) взаимод. лейко-1,4-дигидроксиантрахинона с амином в орг. р-рителе при 70-90°С в присут. Н3ВО3 с послед. окислением воздухом; 2) заменой атома галогена на группу ОН в 1-амино-4-галогенантрахинонах действием H2SO4 в присут. Н3ВО3. Напр., 1-амино-4-гидрокси-, 1-амино-2-метокси-и 1-амино-2-фенокси-4-гидроксиантрахиноны - дисперсные красители красного цвета, розового с желтоватым и розового с синеватым оттенками соответственно, 1-(n-толиламино)-4-гидроксиантрахинон-жирорастворимый фиолетовый краситель, а его сульфопроизводное-кислотный краситель для шерсти. Среди др. аминогидроксипроизводных антрахинонаиспользуют соед. ф-лы IV; его получают взаимод. 1,2,4-тригидроксиантрахинона (пурпурина) с анилином в присут. Н3ВО3 и послед, сульфированием. Этот краситель окрашивает шерсть по хромовой протраве в сине-черный цвет. Гидроксипроизводные антрахинона реже используются в кач-ве красителей. наиб. значение имеет 1,2-дигидроксиантрахинон (ализарин) и его 3-сульфокислота - протравной краситель для шерсти; цвет окраски по хромовой протраве красный. Из тетра Среди гетероциклич. антрахиноновых красителей наиб, значение имеет бирюзовый дисперсный краситель (VII), к-рый получают взаимод. 1,4-диамино-2,3-дигалогенантрахинона с NaCN с послед. омылением групп CN и амидированием Ализарин 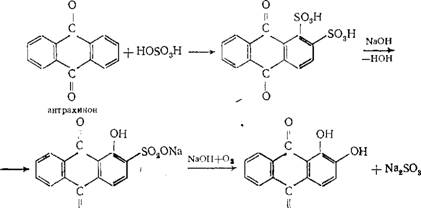 |